定点突变FGF21提高表达量研究
李德山,曹荣邱,高华山,任桂萍,刘明瑶
(东北农业大学生命科学学院,哈尔滨 150030)
成纤维细胞生长因子(FGF),家族共有22名成员,分别通过与细胞膜上四种FGF受体(FGFR)结合,激活下游信号传导通路而起到各自生物学作用。FGF家族成员为150~300个氨基酸组成的多肽,成员间同源性约为30%~60%[1]。FGF21是FGF19亚家族新成员,最早由Nishimura等发现,肝脏[1]、脂肪[3]和骨骼肌[4]为主要表达器官或组织[2]。FGF21由于其独特代谢调节功能,一直是代谢疾病研究热点,其功能主要表现在能促进脂肪细胞糖吸收[5],研究表明FGF21可不依赖胰岛素降低血糖。FGF21可改善胰岛β细胞功能,促进胰岛素分泌,增强靶细胞对胰岛素敏感性。啮齿类动物及灵长类动物2型糖尿病模型和饮食诱导肥胖小鼠模型上研究[6-7]表明,FGF21可降低血糖及甘油三酯水平,增加脂肪消耗并抑制脂肪合成,逆转肝脂肪变性及胰岛素抵抗,并能起到减肥作用。FGF21在治疗代谢疾病特别是糖尿病方面具有广阔市场前景。研究发现FGF21在大肠杆菌中表达量低且主要以包涵体形式表达,严重制约FGF21成药可能性[8-9]。
任何一种具有应用价值蛋白质和多肽可通过蛋白质工程进行改造以提高其活性、特异性和稳定性,降低免疫原性和毒副反应,延长在体内半衰期等。何昆等在FGF21C端添加两个精氨酸提高FGF蛋白稳定性和表达量,而国内外研究运用定点突变技术对FGF21进行改造的文献很少[10]。
本研究对比FGF21及FGF家族其他成员氨基酸序列,根据FGF21与同源序列差异,用基因突变方法,对FGF21氨基酸进行定点突变,构建mutFGF21基因,成功实现其在大肠杆菌中高水平可溶性表达,并对其生物学活性进行验证。
1 材料与方法
1.1 载体和菌株
表达载体pSUMO-FGF21及表达菌株、扩增用大肠杆菌DH5α及表达用菌Rosetta(DE3)均为东北农业大学生命中心生物制药实验室保存;PCR克隆产物扩增载体pMD18-T vector购自TAKARA公司。
1.2 酶和主要试剂
DpnI, Primer Star DNA polymerase, dNTP Mixture,IPTG(异丙基硫代-β-D-半乳糖苷)(均购自TAKARA公司);AxyPrep质粒DNA小量提取试剂盒,AxyPrep DNA胶回收试剂盒,AxyPrep PCR清洁试剂盒(均购自Axygen公司);填料Ni Sepha⁃rose 6 Fast Flow及预装柱HiPrepTM 26/10 Desalting(均购自GE公司);高糖DMEM培养基、优质胎牛血清(FBS)、新生牛血清(NCS)(均购自Invitrogen Corporation公司);Insulin和牛血清白蛋白(均购自Sigma公司),葡萄糖检测试剂盒(购自四川迈克科技有限责任公司);SUMO蛋白酶、兔抗人FGF21多克隆抗体由本实验室制备;辣根过氧化物酶(HRP)标记二抗(羊抗兔IgG)(购自Santa Cruz Bio⁃technology);其余试剂均为国产分析纯。
1.3 FGF家族氨基酸序列比较
FGF1(UniProtKB/Swiss-Prot:P05230.1),FGF2(UniProtKB/Swiss-Prot:P09038),FGF4(UniProtKB/Swiss-Prot:P08620.1), FGF10(UniProtKB/Swiss-Prot:O15520.1),FGF17(UniProtKB/Swiss-Prot:O602 58),FGF19(UniProtKB/Swiss-Prot:O95750),FGF21(UniProtKB/Swiss-Prot:Q9NSA1)及 FGF23(UniProt KB/Swiss-Prot:9GZV9)序列检索自UniProt数据库。序列比对采用DNAMAN软件。
通过序列对比发现,FGF21第141位氨基酸为G,是一个亲水极性氨基酸;而该位点FGF家族其他成员保守氨基酸为F或M,是疏水非极性氨基酸。本试验将G变成F,使FGF21在表达时更易形成疏水核心,蛋白结构更紧密,提高其在大肠杆菌中稳定性,从而增加FGF21产量。
采用生物信息软件DNASTAR对mutFGF21和hFGF21氨基酸序列进行二级结构预测,二者预测结果进行比较。根据hFGF21基因序列在突变位点附近设计一对互补引物:Forward:5'CTCGCTTCC TGCCACTACCATTCCTGCCCCCCGCACTCCCG 3',Reverse:5'CGGGAGTGCGGGGGG CAGGAATGG⁃TAGTGGCAGGAAGCGAG 3',下划线部分为突变位置。采用定点突变方法PCR(Polymerase Chain Reaction,多聚酶链式反应)扩增环状pSUMO-FGF21表达载体。PCR纯化产物经DpnⅠ核酸内切酶酶切,消化掉模板链。取5 μL酶切产物转化DH5α感受态菌,涂布于含100 μg·mL-1Amp抗性LB固体培养基平板上,37℃培养12~16 h。随机挑取单菌落,接种于含100 μg·mL-1AmpLB液体培养基培养过夜,提取质粒。重组质粒样品由宝生物工程(大连)有限公司进行序列测定。
1.4 SUMO-mutFGF21融合蛋白表达
鉴定正确pSUMO-mutFGF21转化Rosetta表达菌,培养过夜,挑取单菌落接种于含100 μg·mL-1AmpLB液体培养基中,37℃培养过夜。取上述过夜培养菌液以1%比例接种于含100 μg·mL-1Am⁃pLB液体培养基中,37℃振荡培养2~3 h,当OD600至 0.4~0.6时,加 IPTG 至终浓度 0.25 mmol·L-1,37℃继续培养,每隔1 h取1 mL菌液4℃备用。收集菌体用PBS重悬,超声破碎进行SDS-PAGE分析mutFGF21融合蛋白表达量与时间关系。对照组为不加IPTG培养3 h菌体。
1.5 mutFGF21可溶性表达分析及与hFGF21表达量比较
mutFGF21表达菌37℃摇瓶培养3 h后加入IPTG至终浓度0.25 mmol·L-1,诱导3 h收集菌体,破碎后菌体离心取上清和沉淀进行SDS-PAGE分析表达蛋白包涵体情况。mutFGF21和hFGF21表达菌37℃摇瓶培养至OD为0.4,加入终浓度为0.25 mmol·L-1IPTG继续培养诱导3 h,取1 mL菌液收集菌体,超声破碎后离心取上清进行SDS-PAGE,上样量均为40 mL。
1.6 mutFGF21蛋白纯化
表达菌株扩大培养,收集菌体超声波破碎后,2 000 g,40 min离心收集上清。运用AKTA purifier 100纯化系统,收集上清经HisTrapTM FF crude亲和层析柱纯化SUMO-mutFGF21融合蛋白,用HiPrepTM 26/10 Desalting柱脱盐后加入SUMO蛋白酶,将SUMO标签切除。酶切后经HisTrapTM FF crude亲和层析纯化mutFGF21成熟蛋白。SDSPAGE分析蛋白纯化情况。
1.7 Western blot分析mutFGf21免疫特异性
将纯化后mutFGF21蛋白经SDS-PAGE电泳后,电转膜至硝酸纤维膜进行Western blot;5%脱脂奶粉封闭1 h,兔抗人FGF21多克隆抗体为一抗(1∶500稀释)孵育过夜,洗涤,羊抗兔HRP标记IgG抗体为二抗(1∶7 500稀释)孵育1 h,洗涤,加入化学发光底物Super Signal检测试剂(Pierce)后,暗室X光片暗匣曝光、显影。
1.8 mutFGF21蛋白生物学分析
取生长状态良好HepG2细胞用0.25%胰蛋白酶消化液消化,离心收集细胞,按照2.5×104密度将细胞接种于96孔板中继续培养,培养液为200 μL·孔-1。当细胞长成均匀单层时,把原培养基换成无血清培养基饥饿12 h后,分别加入浓度分别为0.2,2,20 mg·L-1FGF21成熟蛋白和mutFGF21成熟蛋白200 μL,每个处理重复3次,24 h后取细胞培养上清液2 mL用GOD-POD法检测培养基中葡萄糖含量[11],用Excel软件分析试验结果,组间比较采用t检验。
培养基中残留葡萄糖含量计算公式为:
葡萄糖浓度(mmol·L-1)=OD样品/OD标准×5.55 mmol·L-1
计算葡萄糖消耗率公式为:
葡萄糖消耗率(%)=[(C空白葡萄糖-C给药葡萄糖)/C空白葡萄糖]×100%。
2 结果与分析
2.1 mutFGF21与野生型FGF21二级结构预测结果比较
采用DNASTAR软件对mutFGF21和野生型FGF21氨基酸序列进行二级结构预测,所用方法为Garnier-Robson Method。二者预测结果如图1所示。比较发现氨基酸序列从140位至158位除α螺旋外二级结构均发生变化(两竖线间区域所示),与此同时,其他部位均未发生改变。变化主要有β折叠、转角、无规则卷曲位置变化、增加一个无规则卷曲及柔性区域减少等。
2.2 pSUMO-FGF21基因定点突变
采用定向突变方法扩增环状pSUMO-FGF21表达载体,将PCR扩增产物进行纯化,纯化PCR产物经DpnI核酸内切酶酶切,消化掉模板链,酶切产物取样转化DH5α,挑单菌落提质粒鉴定测序,测序结果发现第421和422位核苷酸GG突变为TT,相应氨基酸序列第141位G突变为F,与试验设计一致。
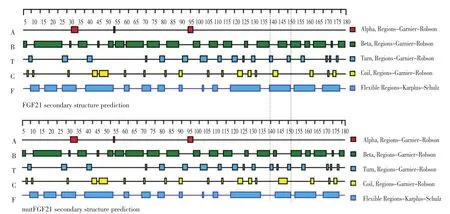
图1 hFGF21和mutFGF21二级结构预测结果比较Fig.1 Comparison of secondary structure prediction results of hFGF21 and mutFGF21
2.3 SUMO-mutFGF21融合蛋白表达
将阳性菌在37℃,0.25 mmol·L-1IPTG条件下,诱导培养,SUMO-mutFGF21表达菌株诱导3 h后菌体经超声破碎离心后,分别取沉淀和上清进行电泳,结果分析表明融合蛋白大部分以可溶形式存在,见图2。
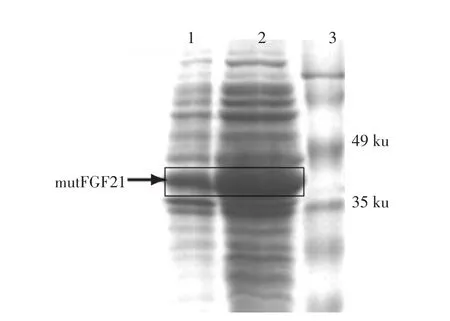
图2 SUMO-mutFGF21融合蛋白可溶性分析Fig.2 Analysis of the portion of soluble SUMO-mutFGF21 fusion protein
mutFGF21和hFGF21表达菌株37℃均培养至OD为0.4,加入相同浓度IPTG继续诱导3 h,然后取相同湿重菌体,用等体积PBS重悬后超声破碎,进行SDS-PAGE,上样量均为40 mL。结果见图3,灰度值分析显示mutFGF21蛋白产量比hFGF21提高50%。
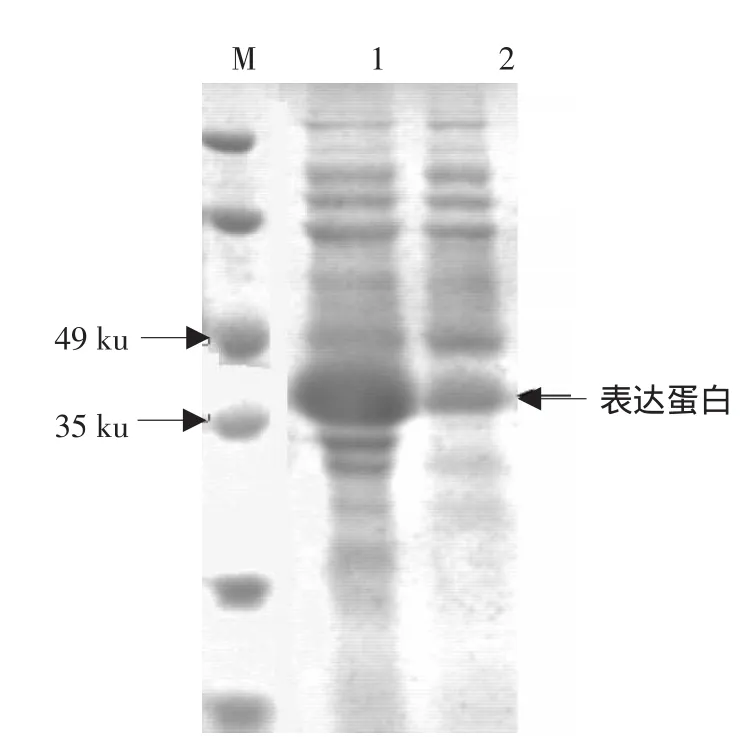
图3 hFGF21和mutFGF21产量比较Fig.3 Yield comparison of hFGF21 and mutFGF21
2.4 mutFGF21蛋白纯化
大量培养后收集菌体经超声破碎后,12 000 g,离心30 min,收集菌体,超声破碎后取上清。上清通过AKTApurifier 100系统经过HisTrapTMFF crude亲和层析,用Elution Buffer洗脱,收集洗脱峰,得到纯度较高融合蛋白。融合蛋白通过HiPrepTM26/10 Desalting柱buffer置换,加入SUMO蛋白酶进行酶切。酶切后产物,经HisTrapTM FF crude亲和层析,收集流穿峰,15%SDS-PAGE电泳检测纯化情况。表明经过两次亲和层析,得到mutFGF21其分子质量为20 ku,与mutFGF21蛋白理论值19.4 ku相差不大。见图4。
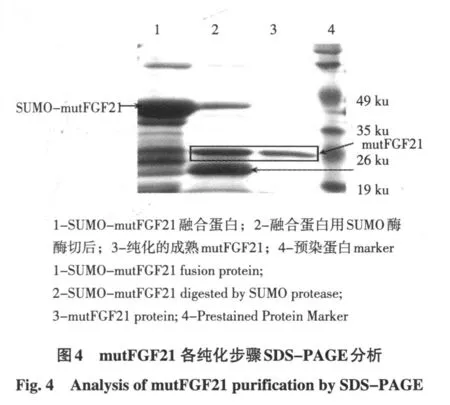
2.5 Western blot分析
纯化后成熟mutFGF21蛋白经Western blot检测证明,1号泳道mutFGF21能与兔抗hFGF21抗体发生特异性反应(见图5)。
2.6 mutFGF21蛋白活性分析
用不同浓度mutFGF21和hFGF21蛋白分别处理HepG2细胞24 h后,与对照相比,两种蛋白处理HepG2细胞葡萄糖消耗率显著增加,并且随着蛋白浓度增加而增加,呈剂量依赖关系。说明mut⁃FGF21蛋白同hFGF21蛋白一样具有调节细胞葡萄糖代谢作用;另外,mutFGF21细胞活性与hFGF21相比,略有提高,但不具有统计学意义,如图6所示。
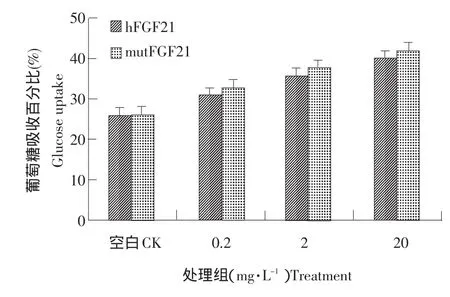
图6 mutFGF21和hFGF21糖吸收活性比较Fig.6 Comparison of glucose uptake efficiency in of mutFGF21 and hFGF21 protein
3 讨论与结论
FGF21是一类重要糖脂代谢调节因子,可有效调节血液中葡萄糖和甘油三脂水平,抑制肝脏生酮作用,改善脂谱。FGF21作为潜在糖尿病治疗药物,不会像FGF1、FGF2等诱发癌症,与传统药物胰岛素相比,具有疗效持久、无低血糖、无体重增加等优势。FGF21目前主要以大肠杆菌为宿主生产,但产量较低。因此急需通过蛋白质工程手段对FGF21进行改造,提高其表达量。
蛋白质工程改造蛋白首先是靶位点选择,分子设计不精确性、盲目性使被改进实用蛋白质不多,多数成果集中于理论和技术。本研究通过FGF21与FGF家族其他成员间氨基酸序列比对,从同源序列差异入手进行试验设计,获得较好结果。从这一出发点改造FGF21,有利于了解其对空间结构和生物活性影响。
FGF家族成员间氨基酸序列同源性约为30%~60%,其中高度保守氨基酸序列对蛋白质功能影响较大,其中核心区第5个氨基酸Y,第84个氨基酸Y,第121位氨基酸L,对蛋白质功能影响最大,这在FGF4突变中已得到证实。通过对比FGF1-FGFR1、FGF2-FGFR1、FGF2-FGFR2晶体结构发现,FGFR与FGF结合位点在D2(FGFRIg样结构域2)和D2-D3linker区域。通过重叠FGF4晶体结构到FGF2-FGFR1结构上,得到一个FGF4-FGFR1模型,在FGF4-D2表面,发现FGF4上87位Y、166位Y,203位L被FGFR1D2上几个疏水氨基酸包围[12]。为验证这种相互作用的正确性,Bellostap等突变FGF4 87位Y、166位Y,203位L为A,发现FGF4在受体亲和力,以及促进DNA合成方面都降低超过100倍,验证结构正确性[13]。因此,推断FGF家族中保守氨基酸序列发生变化将对功能产生影响。通过序列对比发现FGF家族中一个保守区域内其中一个氨基酸与FGF21不同,因此通过定点突变该氨基酸以研究其对FGF21表达量影响。
FGF家族成员具有120个氨基酸构成11(内分泌FGFs)或12(旁分泌FGFs)个β片层结构组成“β-trefoil”结构,这一保守区侧翼连接不同N端和C端赋予FGF家族成员特异生物活性[13]。该核心结构决定于18个大疏水残基,与蛋白稳定性有关。与FGF21一样,FGF1存在稳定性差、体内半衰期短问题,Brych等在FGF1该同源区内进行定点突变,得到稳定性增加FGF1突变蛋白[14]。本试验所尝试突变位点位于该保守结构内,把G突变为F,增加核心结构疏水性,使多肽在折叠时更易形成疏水核心,减少不稳定蛋白产生,同时蛋白结构更紧密,减少降解。是突变提高FGF21表达量重要原因。突变蛋白稳定性还需进一步研究。
本研究通过比较FGF21氨基酸序列和FGF家族保守序列,根据二者间差异,设计mutFGF21基因,使用生物信息学手段预测突变蛋白结构变化,提供理论依据。使用基于PCR定点突变方法,进行一步PCR得到mutFGF21表达载体并在大肠杆菌中成功表达突变蛋白。结果表明,mutFGF21蛋白大部分以可溶性形式表达,表达量与hFGF21相比提高50%,HepG2细胞糖吸收试验表明突变蛋白具有促进糖吸收功能,且与hFGF21相比略有提高。综上所述,对FGF21改造,即第141位G突变为F,在不改变hFGF21细胞活性基础上提高FGF21表达量,为FGF21后续研究及产业化奠定基础。
[1] Itoh N,Ornitz D M.Evolution of theFGFandFGFRgene families[J].TRENDS in Genetics,2004,20(11):563-569.
[2] Nishimura T,Nakatake Y,Konishi M,et al.Identification of a nov⁃el FGF,FGF-21,preferentially expressed in the liver[J].Biochim Biophys Acta,2000,1492:203-206.
[3] Wang H,Qiang L,Farmer S R.Identification of a domain within peroxisome proliferator-activated receptor gamma regulating ex⁃pression of a group of genes containing fibroblast growth factor 21 that are selectively repressed by SIRT1 in adipocytes[J].Mol Cell Biol,2008,28,188-200.
[4] Izumiya Y,Bina H A,Ouchi N,et al.FGF21 is an Akt-regulated myokine[J].FEBS Lett,2008,582,3805-3810.
[5] Kharitonenkov A,Shiyanova T L,Koester A et al.FGF-21 as a novel metabolic regulator[J].Journal of Clinical Investigation,2005,115(6):1627-1635.
[6] Xu J,Lloyd D J,Hale C,et al.Fibroblast growth factor 21 revers⁃es hepatic steatosis,Increases energy expenditure,and improves insulin sensitivity in diet-induced obese mice[J].Diabetes,2009,58(1):250-259.
[7] Kharitonenkov A,Wroblewski V.J.,Koester,A.et al.The meta⁃bolic state of diabetic monkeys is regulated by fibroblast growth factor-21[J].Endocrinology,2007,148(2):774-781.
[8] 姜媛媛,尹成凯,李晋南,等.SUMO融合系统高效表达可溶性重组蛋白的研究[J].东北农业大学学报,2008,39(10):57-62.
[9] 任桂萍,姜媛媛,刘明瑶,等.SUMO融合系统高效表达可溶性鼠源FGF-21及其活性的研究[J].东北农业大学学报,2009,40(5):62-67.
[10] 何昆,张雅坤,叶贤龙,等.精氨酸修饰FGF21及修饰后蛋白体内稳定性和糖代谢调节作用的研究[J].生物化学与生物物理进展,2012,07-06.
[11] 高红梅,王文飞,张巧,等.筛选糖尿病候选药物FGF-21受体激动剂的新型细胞模型的建立[J].药学学报,2011,46:904-909.
[12] Stauber D J,Digabriele A D,Hendrickson W A.Structural inter⁃actions of fibroblast growth factor receptor with its ligands[J].PNAS,2000,97:49-54.
[13] Bellosta P,Iwahori a,Plotnikov A N,et al.Identification of Recep⁃tor and Heparin Binding Sites in Fibroblast Growth Factor 4 by Structure-Based Mutagenesis[J].Mol Cell Biol,21(17):5946-5957.
[14] Brych S R,Blaber S I,Logan T M.Structure and stability effects of mutations designed to increase the primary sequence symmetry within the core region of aβ-trefoil[J].Protein Science,2001,10:2587-2599.

