用正交试验法优化毛木耳多糖提取工艺*
许晓燕,余梦瑶,江 南,魏 巍,罗 霞
(四川省中医药科学院,四川 成都 610041)
毛木耳Auricularia polytricha(Mont)Sacl.是我国主栽食 (药)用菌品种之一,具有栽培简便、产量大等优点。毛木耳中富含毛木耳多糖(Auricularia polytricha Polysaccharide,APP),据研究表明APP具有提高免疫[1]、抗肿瘤[2]、抗氧化[3]、抗凝血[4]、抗血栓[5]、降血脂[4]以及保护机体细胞[6]等作用。
采用热水为媒介,以浸提温度、浸提时间、料水比和浸提次数为主要因素进行正交试验,确定毛木耳多糖最佳提取工艺,为毛木耳多糖的开发及利用提供科学依据。
1 材料与方法
1.1 材料
毛木耳,购自四川省德阳市,洗净烘干后备用。
浓硫酸、苯酚、葡萄糖等试剂均为分析纯。
昆明种标准小鼠,体重18 g~22 g,雌雄各半,SPF级,合格证号:SCXK(川)2008-19。
紫外分光光度计,北京谱析通用仪器有限责任公司TU-1800;电子天平,METTLER TOLEDO AL104;纯水机,Millipore,Milli-Q;移液器,Finnpipette;电热鼓风干燥箱,上海实验仪器厂有限公司,101A-2型;电热恒温水槽,上海精宏实验设备有限公司,DK-80型;旋转蒸发仪,上海申生科技有限公司。
1.2 方法
1.2.1 标准曲线绘制
采用硫酸-苯酚比色法[7]测定多糖含量。分别吸取葡萄糖标准溶液(40 μg·mL-1)0.2 mL、0.3 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL,各以蒸馏水补充至1.0 mL,然后加入0.5 mL的苯酚溶液(6.0%),再迅速滴加2.5 mL的浓硫酸(每个浓度做3个平行)。另取2个试管各加1.0 mL蒸馏水同上操作,为空白。于40℃水浴中恒温0.5 h,取出,冷却15 min后,于490 nm处测其吸光度值。以葡萄糖浓度为纵坐标,OD490值为横坐标作图,绘制多糖标准曲线。得到回归方程为Y=142.08X-0.0596,R2=0.9923。
1.2.2 提取方法
准确称取适量毛木耳子实体样品,按一定比例加入蒸馏水,于恒温水浴中浸提,然后离心分离,沉淀用同样的方法浸提,合并上清液,用旋转蒸发仪将上清液浓缩到适当体积后,缓慢加入4倍体积的95%乙醇,4℃低温静置24 h,4500 r·min-1离心30 min,收集沉淀,用95%乙醇洗涤得粗多糖。采用硫酸-苯酚比色法测定多糖含量,计算得率。
1.2.3 单因素试验
料液比的选择:精密称取10.00 g干燥的毛木耳子实体粉末(过20目筛)5份,按料液比(g·mL-1)1∶10、1∶20、1∶30、1∶40、1∶50,在 100℃条件下浸提 4 h,共提取 3次,每份平行做3次。然后用硫酸-苯酚法测定多糖含量,比较不同料液比条件下的多糖提取率[8]。
浸提温度的选择:分别称取10.00 g毛木耳子实体粉末5份,按上述试验确定的料液比加入蒸馏水,选择温度60℃、70℃、80℃、90℃、100℃,浸提2 h,共提取3次,每份平行做3次。然后用硫酸-苯酚法测定多糖含量,比较不同浸提温度条件下的多糖提取率。
浸提时间的选择:分别称取10.00 g毛木耳子实体粉末5份,按照上述确定的料液比和浸提温度,选择浸提时间1 h、2 h、3 h、4 h和5 h,每份平行做3次,比较不同浸提时间条件下的多糖提取率[9]。
浸提次数的选择:分别称取10.00 g毛木耳子实体粉末5份,按上述确定的料液比、浸提温度和浸提时间,选择浸提次数1次、2次、3次、4次和5次,每份平行做3次,比较不同浸提次数条件下的多糖提取率。
1.2.4 正交试验
在单因素试验基础上,采用L9(34)正交试验进行提取工艺的优化[10]。以浸提温度(A)、浸提时间(B)、料水比(C)和浸提次数(D)为主要因素,每个组合设3个重复,取平均值作为多糖得率。
1.2.5 正交试验验证试验
重复验证正交试验得到的多糖提取试验最佳组合。
1.2.6 小鼠血清溶血素抗体生成试验
小鼠30只,随机分为3组,每组10只,给药组经口给予毛木耳多糖100 mg·kg-1,空白组和模型组给予同等体积的蒸馏水,连续给药30 d。在首次给药后第23天,每只小鼠腹腔注射5%鸡红细胞溶液0.2 mL。在第23天、第25天、第27天,除正常组腹腔注射生理盐水外,其余小鼠均腹腔注射CY 20 mg·kg-1。末次给药30 min后,从小鼠眼后静脉丛取血20μL,加入盛有1 mL生理盐水的试管中,并加入4%鸡红细胞溶液0.5 mL、15%豚鼠血清0.5 mL,在37℃水浴中静置1 h后,放入冰水中终止反应10 min,在2000 r·min-1离心10 min,取上清液1 mL,加入3 mL现配制的血红蛋白应用液中,于540 nm处比色[11]。
1.2.7 小鼠碳粒廓清能力实验
动物分组与给药同1.2.5。给药后第23天至第29天,除正常组皮下注射生理盐水外,其余小鼠均皮下注射氢化可的松25 mg·kg-1。给药后第30天,小鼠灌胃30 min后,小鼠按0.1 mL/10g体重尾静脉注射以1%明胶配制的25%印度墨汁。于注射后30 s和6 min分别在小鼠眼后静脉丛用尖嘴吸管取血20μL,加入盛有0.1%Na2CO3于2 mL溶液的试管中,摇匀后于675 nm处分别测定2次吸光值。吞噬指数K和校正吞噬指数α公式为:
K=(lgOD1-lgOD2)/(T1-T2),α=K1/3·W/WLS
式中:OD为吸光度;T为时间;W为体重;WLS为肝脾合重)[12]。
2 结果与分析
2.1 单因素对毛木耳多糖得率的影响
2.1.1 料水比对毛木耳多糖得率的影响
取原料 10.00 g,料液比分别为 1∶10、1∶20、1∶30、1∶40、1∶50,按工艺路线提取多糖。料液比对多糖得率的影响见图1。

图1结果表明,随着料液比的增加,毛木耳多糖的得率逐渐增加,当料液比1∶40时,多糖得率4.97%;当料液比超过1∶40,多糖得率增加趋于平稳,从节约成本角度考虑,选择1∶40为适宜的料液比。
2.1.2 浸提温度对多糖得率的影响
取原料10.00 g,浸提温度分别为60℃、70℃、80℃、90℃、100℃,按工艺路线提取多糖。浸提温度对多糖得率的影响见图2。
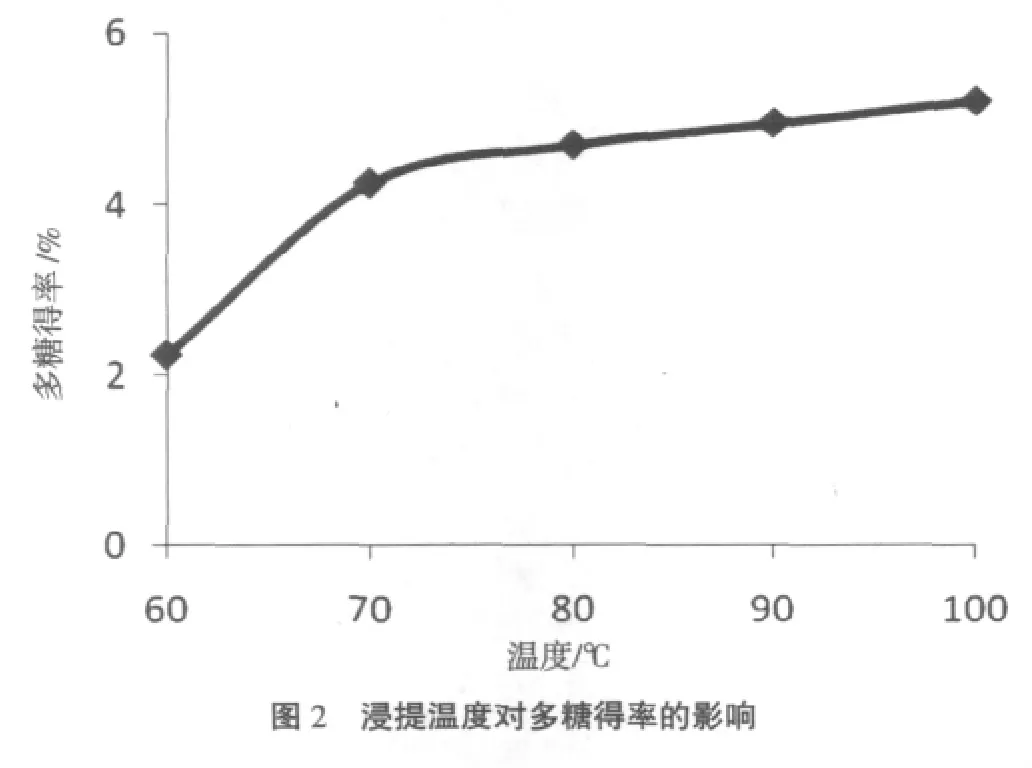
图2结果表明,在试验温度范围内,随着温度的升高,多糖的得率逐渐升高,当温度升高到100℃时,多糖得率最高,为5.23%。采用100℃作为水浸提的适宜温度。
2.1.3 浸提时间对多糖得率的影响
取原料10.00 g,浸提时间分别为1 h、2 h、3 h、4 h和5 h,按工艺路线提取多糖。浸提时间对多糖得率的影响见图3。

图3结果表明,随着提取时间的延长,毛木耳多糖的得率逐渐增大,当浸提时间为4 h时,多糖得率为4.99%,因此选择浸提时间4 h为宜。
2.1.4 浸提次数对多糖得率的影响
取原料10.00 g,浸提次数分别为1次、2次、3次、4次和5次,按工艺路线提取多糖。浸提次数对多糖得率的影响见图4。
图4结果表明,随着浸提次数的增加,毛木耳多糖的得率逐渐增大,当浸提次数达到2次时,多糖得率达到4.67%;当提取次数增加,多糖提取率增加趋于平稳,从提取成本、节约能源方面考虑,选择浸提次数2次较好。

2.2 毛木耳子实体多糖提取正交试验
以浸提温度(A)、浸提时间(B)、料水比(C)和浸提次数(D)为主要因素,每个组合设3个重复,取平均值作为多糖得率,其因素、水平见表1。

表1 正交试验因素水平
毛木耳多糖提取正交试验结果见表2。
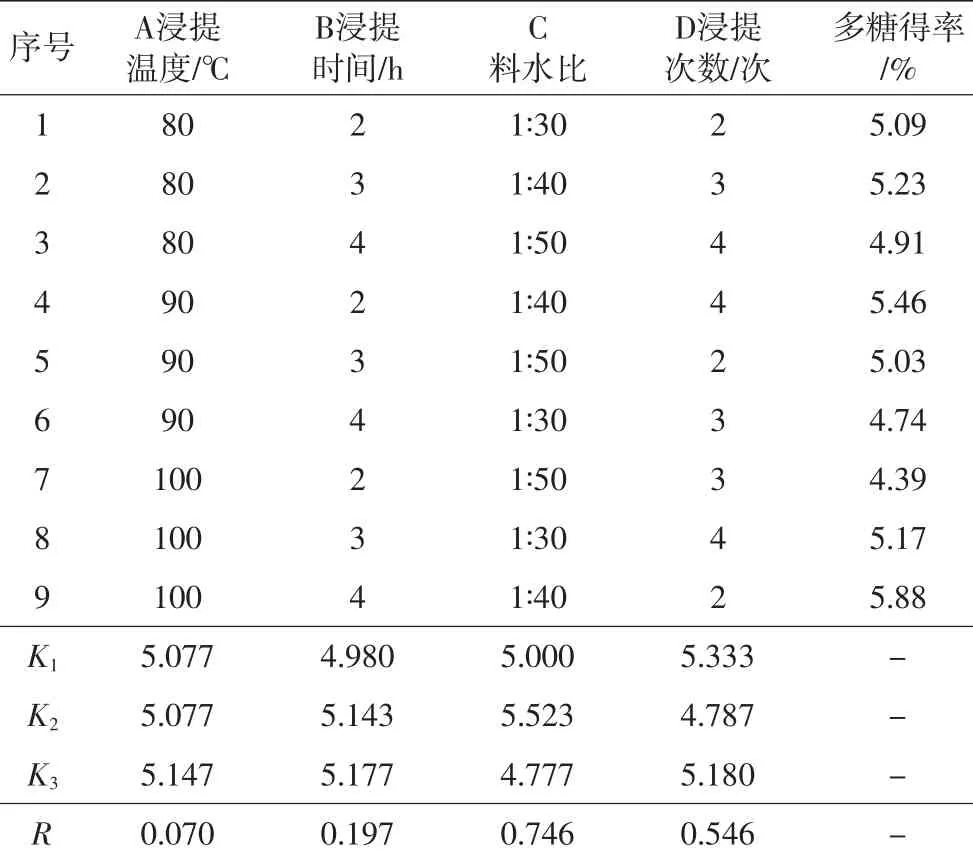
表2 毛木耳多糖提取正交试验结果
由表2可知,影响毛木耳子实体多糖提取的主要因素依次为C>D>B>A,试验结果组合为A3B3C2D1,即料水比1∶40,浸提次数2次,浸提时间4 h,浸提温度100℃时,多糖得率最高。
2.3 验证试验
最佳工艺条件下进行多糖提取验证试验结果见表3。
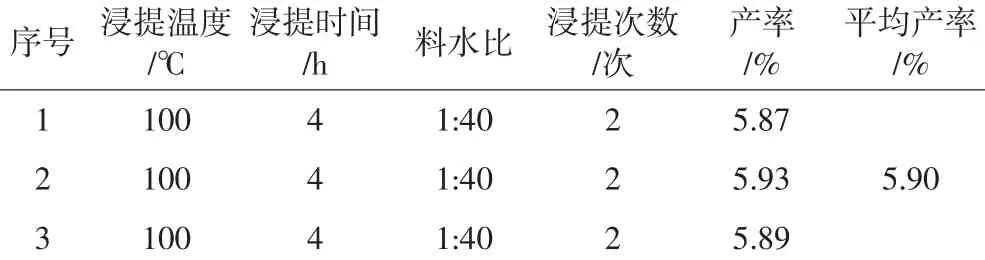
表3 最佳工艺验证试验
试验结果表明,在最佳工艺条件下提取多糖,提取率达到5.90%。
2.4 对小鼠血清溶血素抗体生成的影响
对小鼠血清溶血素抗体生成的影响见表4。

表4 毛木耳多糖对小鼠血清溶血素抗体生成的影响
由表4可见,注射CY(20 mg·kg-1)后模型组血清溶血素水平明显降低,与空白组比较有显著性差异(p<0.01)。而灌胃毛木耳多糖30 d后,血清溶血素抗体生成水平明显提高,与模型组相比具有显著差异(p<0.05)并呈剂量关系。
2.5 小鼠碳粒廓清能力的影响
对小鼠碳粒廓清能力的影响见表5。
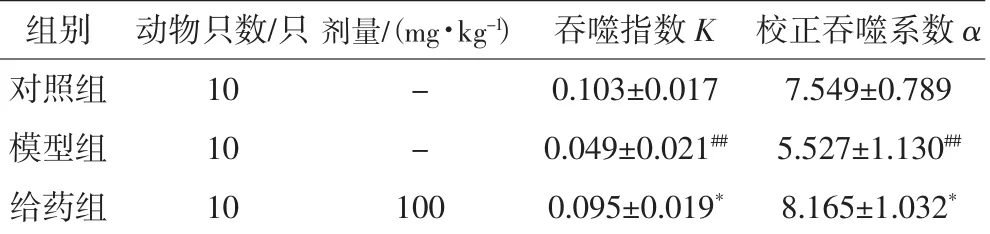
表5 毛木耳多糖对小鼠碳粒廓清能力的影响
由表5可见,注射氢化可的松(25 mg·kg-1)后,模型组碳粒廓清能力显降低,与空白组比较有显著性差异(p<0.01)。灌胃毛木耳后多糖30 d后,小鼠碳粒廓清能力有明显提高(p<0.05)。
3 讨论
毛木耳含有丰富的毛木耳多糖,具有提高免疫、抗肿瘤、抗氧化、抗凝血、抗血栓、降血脂等作用。在单因素试验的基础上,通过正交试验及其验证试验确定了毛木耳多糖的最佳提取条件为料水比1∶40,浸提时间4 h,浸提次数2次,浸提温度100℃,在此条件下,毛木耳多糖得率可达5.90%。
小鼠溶血素抗体生成试验,属于机体体液特异性免疫实验中的一种,其实验原理是通过鸡血细胞免疫小鼠,使血清中出现鸡红细胞抗体(溶血素)。然后将小鼠血液、豚鼠补体及抗原(鸡血细胞)在适温下一起孵育,此时发生溶血反应,释放血红蛋白。通过Hb试剂盒测定血红蛋白含量,其可反映血清中溶血素的含量。吸光度越高,表示产生抗体越多,小鼠的免疫能力就越强[13]。通过本论文研究发现给药组的吸光度值比模型组大,呈显著性差异(p<0.05),表明毛木耳多糖在100 mg·kg-1剂量下可提高免疫低下模型小鼠血清中溶血素抗体含量,具有增强小鼠体液特异性免疫功能的作用。
小鼠碳廓清实验,属于机体巨噬细胞非特异性免疫实验中的一种,其实验原理是当小鼠静脉注入特定大小的惰性碳粒后,它即可被RES细胞迅速吞噬而从血液中廓清,因此可以借助测定血液中碳粒的消失速度来反映RES吞噬异物的能力[14]。K是反映RES巨噬细胞对所注入血中碳粒的吞噬廓清能力和速度,由于RES的激活包括巨噬细胞增殖及功能活跃两个方面,为排除增殖因素,一般以矫正的α表示。因而测定血液中碳粒的清除速度,速度越快表明吞噬异物能力越强,说明小鼠RES单核巨噬细胞非特异性免疫的能力越强[15]。经研究发现给药组K值和α值比模型组高,呈显著性差异(p<0.05),表明毛木耳多糖在100 mg·kg-1剂量下,可增强免疫低下小鼠巨噬细胞吞噬碳粒异物的能力,具有增强免疫低下模型小鼠的巨噬细胞非特异性免疫能力。因此,毛木耳多糖能从体液免疫和细胞免疫两个方面提高小鼠的免疫功能。
本文的研究为毛木耳多糖的提取提供了实验依据,并且为毛木耳的进一步开发利用奠定了科学基础。
[1]许晓燕,余梦瑶,罗霞,等.黄背木耳多糖对巨噬细胞的激活作用[J].中国食用菌,28 (3):41-42,49.
[2]GL Song,QZ Du.Isolation of a polysaccharide with anticancer activity from Auricularia polytricha using high-speed countercurrent chromatography with an aqueous two-phase system[J].Journal of Chromatography,2010 (1217):5930-5934.
[3]周学君,俞发.毛木耳多糖的抗氧化作用[J].中国医院药学杂志,2000,20(10):610-611.
[4]吴春敏,陈琼华.毛木耳多糖抗凝血和降血脂作用[J].中国药科大学学报,1991,22(3):164-166.
[5]吴春敏,陈琼华.毛木耳多糖对实验性血栓形成的影响[J].中国生化药物杂志,1992,60(2):45-46.
[6]吴春敏,陈琼华.毛木耳多糖对机体细胞的保护作用[J].中国药科大学学报,1991,22(5):305-307.
[7]张惟杰.糖复合物生化研究技术[M].浙江:浙江大学出版社,1999.
[8]杨鑫,王鑫淼,丁怡,等.红松松塔多糖提取工艺优化及含量测定[J].中成药,2011,33(2):351-353.
[9]翟延君,伍伟超,王添敏,等.正交试验优选柘木多糖提取工艺研究[J].中成药,2011,33(4):703-704.
[10]王伟,陈凡,王玉玲.毛木耳多糖提取工艺的研究[J].漳州师范学院学院:自然科学版,2009,22(3):121-124.
[11]郭雯,王英军,姜秀莲,等.赤灵芝提取物对小鼠免疫功能系统的影响[J].中国老年学杂志,2009,29(10):2636-2638.
[12]刘高阳,杨士明,赵戈清,等.益气解毒颗粒对小鼠免疫功能的影响[J].四川大学学报.自然科学版,2005,42(10):610-612.
[13]丁晓红,孙远岭,杨珍,等.运脾方对小鼠血清溶血素抗体生成作用的影响[J].中国中医药信息杂志,2009,16(9):27-28.
[14]田建超,陈建荣,季颖.半夏厚朴汤加味对抑郁模型小时碳轮廓清指数级胸腺淋巴细胞增殖活性的影响[J].吉林中医药,2010,30 (1):78-79.
[15]王曦.具有增强免疫能力的乳酸菌-黄芪发酵产物的筛选、优化及评价[D].四川大学,2011.

