葡萄籽粗多糖的超声波提取工艺优化及抗氧化活性
王 强,赵 欣
(重庆第二师范学院生物与化学工程系,食品安全与营养研究所,重庆 400067)
葡萄,葡萄科(Cucurbitaceae),葡萄属(Cucurbita),是仅次于柑橘之后的世界第二大水果,含有多酚、矿物质、维生素等生物活性成分[1-2],是一种优质的功效成分提取资源。国内外研究表明[3-5],葡萄提取物对预防心血管疾病和抑制肿瘤生长等具有显著的疗效,葡萄提取物备受人们重视。现代营养学的研究表明葡萄中的活性多糖具有抑菌和抗氧化等功能,多糖研究已成为当前医药和食品领域研究与开发的热点[6-8]。
据联合国粮食与农业组织(FAO)统计2004年全球葡萄总产量约6500万t,其中约71%用来酿酒,产生的副产物皮渣等占到总加工量的20%[9-10]。在我国80%的葡萄用于酿酒,酿酒产生约25%(m/m)的皮渣,其中20%~26%是葡萄籽,因此,利用酿酒皮渣可以增加商品附加值[11-12]。但目前食品行业对葡萄籽资源的利用十分有限,若将这些废弃的葡萄籽作为生产粗多糖的原料,可以提高原料利用率,同时产生大量的优质活性多糖。本实验运用响应曲面法进行超声波提取葡萄籽粗多糖的最佳工艺研究,分析各因素对提取效果的影响,并对最终粗多糖的化学组成、分子质量分布和抗氧化活性等进行评价,对于葡萄籽粗多糖的科学研究、引导葡萄籽产业发展、指导消费及宣传具有重要意义。
1 材料与方法
1.1 材料、试剂与仪器
1,1-二苯基-2-三硝基苯肼(DPPH) 美国Sigma-Aldrich公司;Dextrans系列标样(T-10、T-40、T-70、T-500)、Sephadex-G150 瑞典Pharmacia公司;VC 成都科龙化工试剂厂;双蒸水、所用溶液均自行配制;MD44-14型号透析袋 美国Union Carbide公司;其他化学试剂均为国产分析纯。
DHG-9240A电热恒温鼓风干燥箱、DK-8D三孔电热恒温水槽 上海齐欣科学仪器有限公司;超声波 宁波新芝生物科技有限责任公司;UV-2450紫外-可见分光光度计 日本岛津公司;凝胶色谱柱(1.6cm×100cm)、恒流泵、自动部分收集器 上海华美化学仪器厂;冷冻离心机 美国贝克曼公司;LSC真空冷冻干燥机 德国Martin Christ公司;NDJ-1型旋转式黏度计 上海菁海仪器有限公司。
1.2 方法
1.2.1 提取葡萄籽粗多糖
1.2.1.1 原料预处理
原料清洗、去除杂质;将葡萄籽干燥置于电热恒温鼓风干燥箱(65℃)干燥至水分含量8%(烘箱法测定);粉碎机粉碎,过60目筛。用95%的乙醇40℃热处理2次,每次1h,以除去单糖、低聚糖和色素等小分子物质的干扰,同时灭酶活以防止在超声波提取过程中粗多糖的降解。抽滤、干燥,即得到预处理葡萄籽粉原料。
1.2.1.2 超声波辅助提取葡萄籽粗多糖
预处理后的葡萄籽粉于设定条件(蒸馏水与葡萄籽液料比:10:1~50:1(mL/g,下同);超声功率:70~110W;温度:30~70℃;超声时间:10~50min)热水提取2次,离心(3000r/min,10min)后合并上清液,95%乙醇、100%乙醇和丙酮分别处理,4℃放置24h后离心(3000r/min,10min),溶解,Sevag方法脱蛋白[13],透析(采用透析袋透析)后真空冷冻干燥,即得葡萄籽粗多糖(GSCPs);GSCPs得率按式(1)计算。

1.2.2 单因素和响应面试验设计
单因素固定条件为:液料比20:1、超声功率80W、超声温度40℃、超声时间25min。在单因素试验的基础上,选取液料比、超声功率、超声温度、超声时间为自变量,GSCPs得率为响应值(Y),根据Box-Behnken 试验设计原理,进行四因素三水平的响应面分析试验。通过Design-Expert 7.1.6软件(STAT-EASE Inc., Minneapolis,USA)对试验数据进行回归分析,实验结果通过多元回归分析方法来拟合多元二次方程。
1.2.3 GSCPs组成分析
以葡萄糖为标样,采用苯酚-硫酸法测定总糖含量,具体参考方法见文献[14];蛋白质含量测定参考AOCS Ba 4a-38方法[15],灰分含量测定参考AOAC 942.05方法[16];采用NDJ-1型旋转式黏度计测定GSCPs的相对黏度,GSCPs溶液质量浓度为10mg/mL(25℃)[17]。
1.2.4 GSCPs分子质量分析
采用凝胶过滤色谱法测定GSCPs分子质量。分别将已知分子质量(MW)的DextranT-10、DextranT-40、DextranT-70、DextranT-500(相对分子质量分别为1万、4万、7万、50万)溶解于蒸馏水中,质量浓度为2mg/mL。上Sephadex G-150凝胶柱(1.6cm×100cm),以纯水洗脱,上样量1mL,流速24mL/h,自动部分收集仪收集洗出液,用苯酚-硫酸法于490nm波长处检测葡聚糖,根据洗脱体积求得相对分子质量标准曲线。以相同的条件将样品上柱,根据洗脱体积,求得分子质量[18]。
1.2.5 GSCPs清除DPPH自由基的测定
参照文献方法Liu等[19]进行,将DPPH溶液1mL(10–4mol/L,95%乙醇)与不同质量浓度(0~0.80mg/mL)的样品和对照品(VC)溶液3mL混匀后于波长517nm处测定吸光度Ai,同时,将DPPH溶液1mL与样品空白3mL混匀后测定吸光度Ac,将不同质量浓度的样品溶液3mL与95%乙醇1mL混匀后测定吸光度Aj,按式(2)计算DPPH自由基清除率。

1.2.6 数据统计分析
2 结果与分析
2.1 提取参数对GSCPs提取效果的影响
液料比是影响粗多糖提取效果的一个重要因素,根据传质速率理论,主要表现在影响固相体和液相体之间的浓度差。


图 1 液料比(A)、超声功率(B)、超声温度(C)、超声时间(D)对GSCPs提取效果的影响Fig.1 Effect of water/raw material ratio (A), ultrasonic power (B), ultrasonic temperatures (C) and ultrasonic times (D) on yield of GSCPs
由图1A可知,随着液体比例的增加,GSCPs得率逐渐从0.94%增加到1.82%,当液料比超过40:1时,GSCPs得率增大不显著。由图1B可知,随着超声功率的增大,GSCPs得率先增大后降低,当超声功率为100W时GSCPs得率达到最大值1.91%,当超声功率继续增加时,GSCPs得率降低,其可能原因是在较高的功率条件下,粗多糖发生降解。由图1C可知,在超声温度30~40℃范围,GSCPs得率增加不显著,之后随着超声温度增加,GSCPs得率呈逐渐增大的趋势。但当超声温度超过60℃时,GSCPs得率增加不显著。超声时间对GSCPs得率的影响与超声温度较为相似,如图1D所示。
国内外研究发现,超声波辅助提取粗多糖比传统水提的效果更好。一方面,原因可能是超声波辅助处理提高了粗多糖提取的效率;另一方面,超声波辅助处理破坏了原料细胞壁组织,促使水溶性多糖与纤维素、蛋白质等的连接健断裂,转变为可溶性多糖,加速了多糖的溶出[20-21]。故本研究把液料比35:1~45:1、超声功率95~105W、超声温度55~65℃、超声时间35~45min作为响应面试验的考察范围。
2.2 响应面提取葡萄籽粗多糖工艺的优化
2.2.1 数学模型的建立与检验
利用Design-Expert软件中的Box-Behnken试验设计,以A料液比、B超声功率、C超声温度、D超声时间作四因素三水平试验设计,可获得GSCPs得率(Y)的试验设计及结果见表1。对表1中数据进行统计分析,可建立如下二次回归方程:
Y=2.22+0.072A+0.097B-0.15C-0.025D-0.067AB+0.077AC-0.17AD-0.13BC-0.075BD+0.050CD-0.18A2-0.10B2-0.18C2-0.13D2
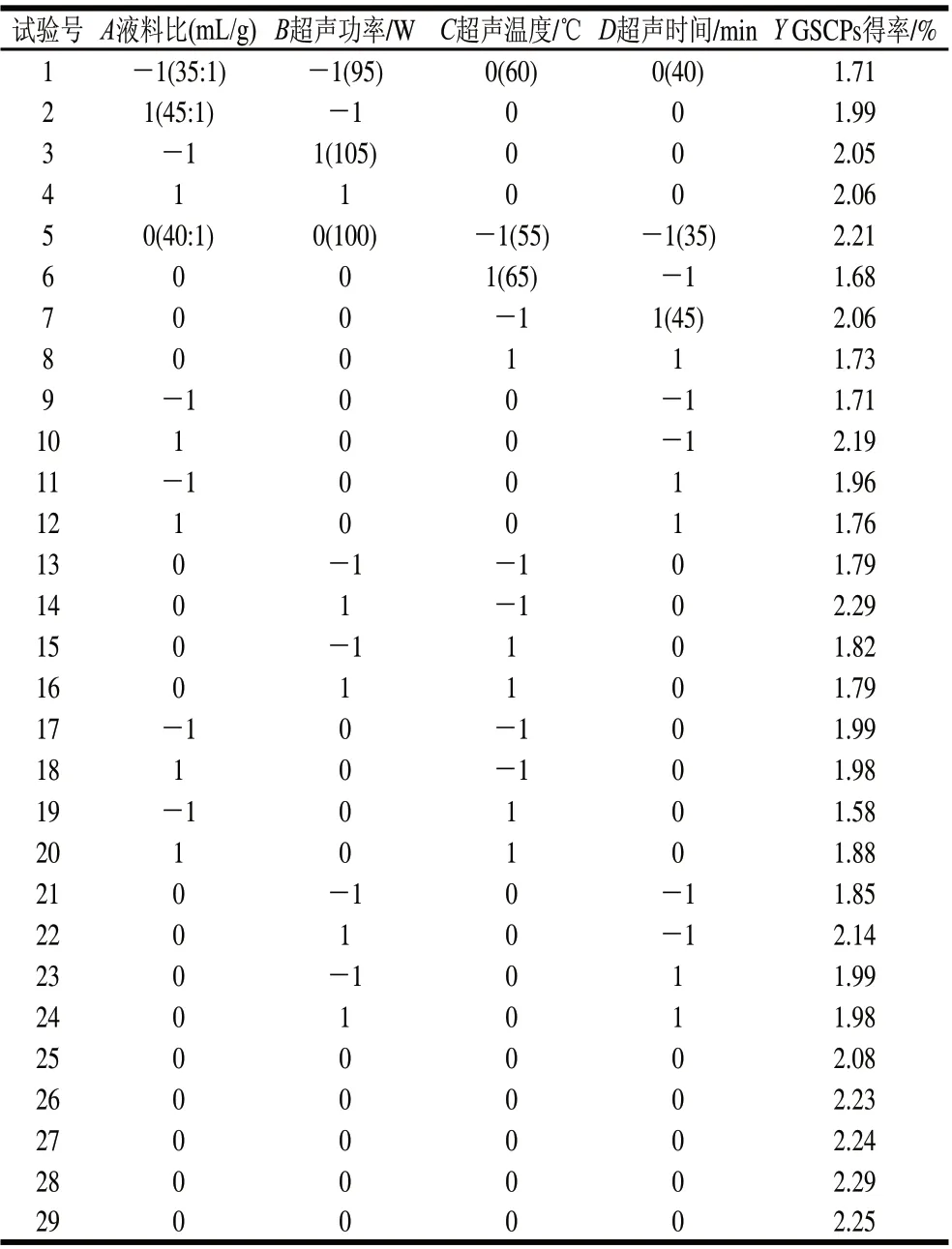
表1 响应面分析方案及试验结果Table 1 Experimental design and results of response surface methodology
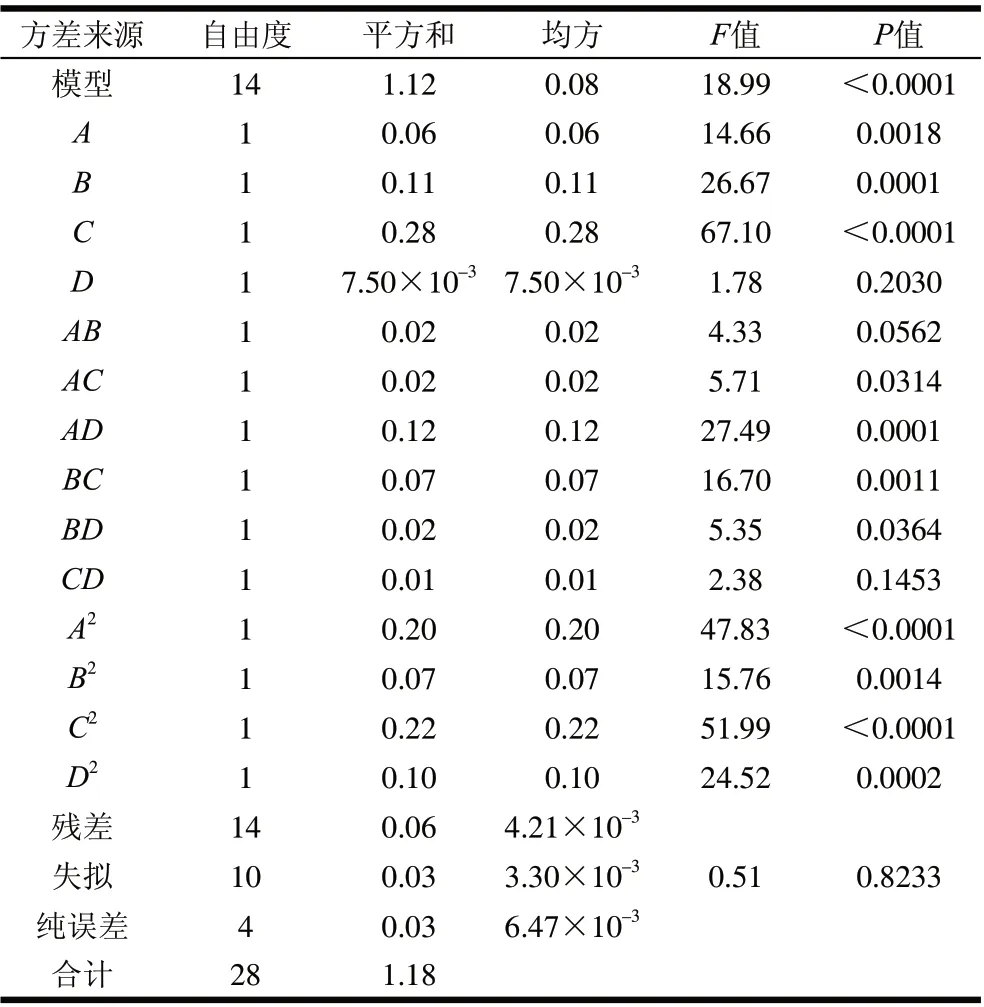
表2 粗多糖得率回归方程方差分析表Table 2 Analysis of variance of regression equations
对二次回归方程进行方差分析,结果见表2。Y的A、B、C、AC、AD、BC、BD、A2、B2、C2、D2均表现出了显著水平,二次回归方程整体模型极显著,并且失拟项不显著,该回归模型与实测值能较好地拟合。进一步对该回归模型进行显著性检验发现,模型Y的决定系数R2和校正决定系数R2Adj分别为95.00%和90.00%,均不小于90%,说明模型相关度很好,P<0.0001,回归模型极显著。模型失拟项表示模型预测值与实际值不拟合的概率[19],表2中,失拟项P>0.05,不显著,因此证明该模型可以充分地解释响应中的变异,模型拟合度良好。
2.2.2 响应面分析和优化参数的优化与验证
为了考察交互项对GSCPs得率的影响,在其他因素条件固定为0水平时,考察交互项对GSCPs得率的影响,对模型进行降维分析。经Design-Expert 7.1.6软件分析,所得的响应面图见图2。
Design-Expert软件分析结果表明,回归模型存在稳定点编码值(0.146, 1.000,-0.837,-0.661),稳定点的特征值表明稳定点为最大值点,即液料比41:1、超声功率105W、超声温度56℃、超声时间37min时,GSCPs得率达到最大值(2.37%)。用此最优提取条件进行验证,得到GSCPs得率为(2.41±0.11)%,与理论值较为接近,表明数学模型对优化GSCPs提取工艺是可行的。


图 2 粗多糖得率的响应面图Fig.2 Response surface plots showing the effects water/raw material ratio (A), ultrasonic power (B), ultrasonic temperatures (C) and ultrasonic times (D) on the yield of crude polysaccharides
2.3 GSCPs化学组成和结构特性

图 3 超声波辅助提取葡萄籽粗多糖的相对分子质量分布Fig.3 Molecular size distribution of GSCPs
测定GSCPs的理化组成,结果发现,GSCPs总糖含量为(73.25±3.79)%,其中含有(3.86±0.17)%蛋白质和(2.60±0.14)%灰分,GSCPs黏度为(1.51±0.11)Pa·s。
采用凝胶过滤色谱法测定GSCPs分子质量,如图3所示。超声波辅助提取GSCPs凝胶柱洗脱曲线主要有4个洗脱峰,且相对分子质量分布范围很宽,分别为13.59×104、4.55×104、1.68×104和1.02×104。
2.4 GSCPs清除DPPH自由基活性
自由基是新陈代谢的副产物,在体内稳态平衡失调的情况下,过多的自由基和活性氧的产生、反应会导致许多疾病的发生、发展及有机体的衰老。因此,探讨粗多糖新资源对自由基的清除作用具有重要意义。DPPH在有机溶剂中是一种稳定的自由基,在517nm波长附近有强吸收(呈深紫色)。而当有自由基清除剂存在时,DPPH的孤对电子被配对,其517nm波长吸收消失或减弱,通过测定吸收减弱的程度,可评价自由基清除剂的活性。由图4可知,GSCPs清除DPPH自由基的能力与VC较为接近,揭示了GSCPs具有较高的抗氧化活性。
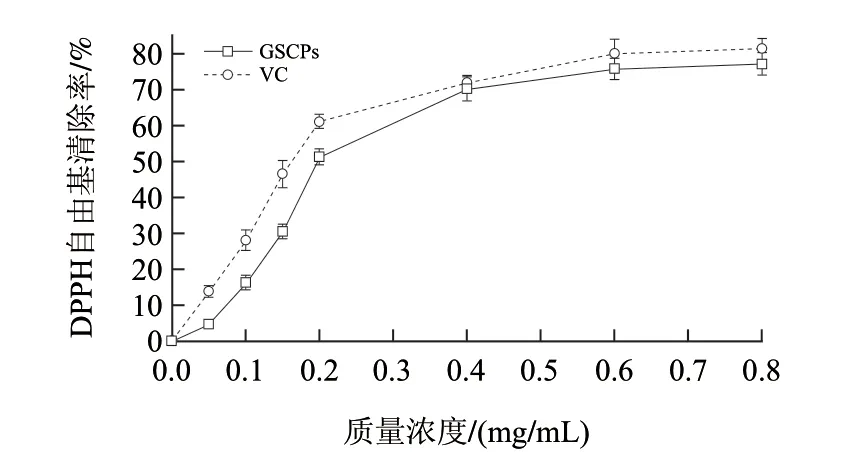
图 4 超声波辅助提取GSCPs清除DPPH自由基能力Fig.4 DPPH free radical scavenging activity of GSCPs
据国内外相关文献报道[3,6,22],葡萄提取物的生物活性涉及抗氧化、抑菌、预防心血管疾病及抑制肿瘤生长等方面。本实验研究发现,GSCPs具有较高的清除DPPH自由基的能力。基于此,与其他合成抗氧化剂相比,GSCPs具有较高的清除自由基能力,可用于开发研制抗衰老的保健食品和辅助药物。
3 结 论
葡萄籽是生产葡萄制品时的副产物,葡萄籽含有大量的膳食纤维和粗多糖等活性成分,是一种优质的功效成分提取资源。为提高葡萄籽粗多糖的提取率,本实验通过超声波辅助提取技术优化了GSCPs提取工艺参数,测定了其理化组成、分子质量分布和抗氧化活性。结果表明,最佳提取GSCPs工艺参数为蒸馏水与葡萄籽液料比41:1、超声功率105W、超声温度56℃、超声时间37min,在此条件下GSCPs得率为2.37%。此外,GSCPs分子质量分布较广,清除DPPH自由基实验揭示了GSCPs具有较高的抗氧化能力。
[1] JAYAPRAKASHA G K, SINGH R P, SAKARIAH K K. Antioxidant activity of grape seed (Vitis vinifera) extracts on peroxidation models in vitro[J]. Food Chemistry, 2001, 73: 285-290.
[2] BAIL S, STUEBIGER G, KRIST S, et al. Characterisation of various grape seed oils by volatile compounds, triacylglycerol composition, total phenols and antioxidant capacity[J]. Food Chemistry, 2008, 108: 1122-1132.
[3] 梁志强, 陈秋宇, 孙向军. 葡萄籽和皮萃取物对小鼠乳腺癌细胞迁移的影响[J]. 食品科学, 2012, 33(1): 239-243.
[4] 李贞, 高丽萍, 冷洪涛, 等. 葡萄籽原花青素对顺铂所致人胚肾细胞毒性的拮抗作用[J]. 食品科学, 2011, 32(7): 315-318.
[5] 郭金英, 李松彪, 刘开永, 等. 葡萄籽超微粉对高血脂金黄地鼠血浆NO、ET-1和C反应蛋白的影响[J]. 食品科学, 2008, 29(9): 598-600.
[6] 王忠民, 王跃进, 周鹏. 葡萄多糖抑菌特性的研究[J]. 食品与发酵工业, 2005(1): 77-79.
[7] CHAMORRO S, VIVEROS A, ALVAREZ I, et al. Changes in polyphenol and polysaccharide content of grape seed extract and grape pomace after enzymatic treatment[J]. Food Chemistry, 2012, 133: 308-314.
[8] PROZIL S O, COSTA E V, EVTUGUIN D V, et al. Structural characterization of polysaccharides isolated from grape stalks of Vitis vinifera L[J]. Carbohydrate Research, 2012, 356: 252-259.
[9] PASSOS C P, YILMAZ S, SILVA C M, et al. Enhancement of grape seed oil extraction using a cell wall degrading enzyme cocktail[J]. Food Chemistry, 2009, 115: 48-53.
[10] CREWS C, HOUGH P, BRERETON P, et al. Quantitation of the main constituents of some authentic sesame seed oils of different origin[J]. Journal of Agricultural and Food Chemistry, 2006, 54: 6266-6270.
[11] RICE A C. Solid-waste generation and by-product recovery potential from winery residues[J]. American Journal of Enology and Viticulture, 1976, 27(1): 21-26.
[12] GOMEZ A M, LOPEZ C P. Recovery of grape seed oil by liquid and supercritical carbon dioxide extraction: a comparison with conventional solvent extraction[J]. Chemical Engineering Journal and the Biochemical Engineering Journal, 1996, 61: 227-231.
[13] SEVAG M G, LACKMAN D B, SMOLENS J. The isolation of components of streptococcal nucleoproteins in serologically active form[J]. Journal of Biological Chemistry, 1938, 124: 425.
[14] DUBOIS M, GILLES K A, HAMILTON J K, et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry, 1956, 28: 350-356.
[15] AOCS Official Method Ba 4a-38. Nitrogen-ammonia-protein modified kjedahl method[S]. FIRESTONE D. Official Methods and Recommended Practices of the AOCS. American Oil Chemists’ Society, Champaign, IL, USA, 1997.
[16] AOAC-942.05. Ash of animal feed[S]. HELRICH K. Official Methods of Analysis of the Association of Official Analytical Chemists. 15th ed. AOAC, Arlington, VA, 1990: 70.
[17] QIAO D, HU B, GAN D, et al. Extraction optimized by using response surface methodology, purification and preliminary characterization of polysaccharides from Hyriopsis cumingii[J]. Carbohydrate Polymers, 2009, 76: 422-429.
[18] LU R, YOSHIDA T. Structure and molecular weight of Asian lacquer polysaccharides[J]. Carhydrate Polymers, 2003, 54: 419-424.
[19] LIU L, SUN Y, LAURA T, et al. Determination of polyphenolic content and antioxidant activity of kudingcha made from Ilex kudingcha C.J. Tseng[J]. Food Chemistry, 2009, 112: 35-41.
[20] 陈红, 张波, 刘秀奇, 等. 超声波辅助提取水溶性大豆多糖及纯化工艺[J]. 食品科学, 2011, 32(6): 139-142.
[21] WEI X, CHEN M, XIAO J, et al. Composition and bioactivity of tea flower polysaccharides obtained by different methods[J]. Carbohydrate Polymers, 2010, 79: 418-422.
[22] 王忠民, 程明冬, 王有平. 葡萄多糖的抑菌作用研究[J]. 食品科学, 2007, 28(7): 35-38.

