拟康氏木霉菌丝多糖提取工艺优化
李 萍,秦国正,王国栋,陈靠山,2,*,陈富华
(1.皖南医学院药学系,安徽 芜湖 241002;2.山东大学生命科学学院,山东 济南 250100)
拟康氏木霉(Trichiderma seudokoningii)是本课题组从玉米秸秆中筛选分离出的一株真菌。该真菌可产纤维素酶[1-2],菌丝富含壳聚糖[3]。郝林华等[4]对该菌的液体深层发酵条件进行了优化,并在100L发酵罐中进行了中试放大实验。该菌的发酵产物——拟康氏木霉胞外多糖具有诱导植物系统抗性的作用[5-9]。Huang Taotao等[10]研究发现,拟康氏木霉胞外多糖经纯化后得到的均一多糖EPS可通过线粒体途径诱导白血病细胞K562凋亡,此外,该多糖也有明显免疫活性[11]。真菌多糖的提取一般采取水提法[12],采用单纯水提取[13]或者用联合超声波[14-15]、微波[16-17]、酶[18-19]等方法辅助提取。水提法具有多糖溶出率高、有机溶剂使用量少、对多糖活性破坏小的的特点,在时间、温度、粉碎粒度、提取次数和料液比的单因素试验结果基础上,进行正交试验,考察最佳提取条件,为拟康氏木霉菌菌丝多糖的进一步研究和生产提供科学依据。
1 材料与方法
1.1 材料与试剂
拟康氏木霉发酵产物由本实验室自制;木瓜蛋白酶 上海华蓝化学科技公司;透析袋(union carbide);石油醚、氯仿、正丁醇、95%乙醇等均为国产分析纯。
1.2 仪器与设备
UV-2550紫外-可见分光光度计 日本岛津公司;N-1001D-W旋转蒸发仪 日本东京理化;4K15低速大容量冷冻离心机 美国Sigma公司;冷冻离心浓缩干燥系统 美国Labconco公司;GY601电子天平 上海良品仪器仪表有限公司;HH-4恒温水浴锅 巩义予华公司;SHZ-3循环水真空泵 上海康华公司。
1.3 方法
1.3.1 拟康氏木霉多糖的提取
1.3.1.1 实验样品的前处理[20-21]
将拟康氏木霉菌发酵产物用8层纱布过滤收集菌丝,用蒸馏水洗涤3次,用纱布拧出水分。加入3倍体积石油醚,60℃回流2次脱脂,每次2h。脱脂后过滤,滤渣挥干溶剂,加入3倍体积90%乙醇,80℃回流2次,每次2h。过滤,滤渣挥干溶剂脱去单糖和小分子物质,备用。
1.3.1.2 多糖含量的测定方法(苯酚-硫酸法)[22]
苯酚溶液的配制:5.0g重蒸苯酚,加入100mL蒸馏水溶解,配制成5g/100mL苯酚溶液,置棕色试剂瓶中,放入4℃冰箱保存,备用。
标准曲线的绘制:用移液器准确吸取葡萄糖标准溶液0、0.1、0.2、0.6、0.8、1.0mL置于25mL的干燥比色管中,依次加蒸馏水,使总体积均为1.0mL。各管再分别加入5g/100mL苯酚溶液1.0mL,摇匀,迅速滴加H2SO45.0mL,充分摇匀,置于沸水浴中保温10min,冷却至室温后静置15min,在490nm波长处测吸光度A,以吸光度(Y)为纵坐标,葡萄糖质量浓度(X,μg/mL)为横坐标,绘制标准曲线图,计算回归方程。
1.3.1.3 单因素试验
1)提取时间对菌丝多糖提取率的影响:预处理后干菌丝过20目筛,准确称取4份样品,每份2.0g,料液比1:100(g/mL),分别在沸水浴中回流1、2、3、4h,提取液用苯酚-硫酸法在490nm波长处测定吸光度。2)提取温度对菌丝多糖提取率的影响:预处理后干菌丝过80目筛,准确称取4份样品,每份2.0g,料液比1:100(g/mL),分别于25、50、75、100℃(沸水)加热回流1h,提取液用苯酚-硫酸法在490nm波长处测定吸光度。3)粉碎度对菌丝多糖提取率的影响:预处理后干菌丝分别过20、40、80、120目筛,准确称取4份样品,每份2.0g,料液比1:100(g/mL),沸水浴回流1h,提取液用苯酚-硫酸法在490nm波长处测定吸光度。4)提取次数对菌丝多糖提取率的影响:预处理后干菌丝过80目筛,准确称取4份样品,每份2.0g,料液比1:100,沸水浴中分别回流提取1、2、3、4次,每次1h,提取液用苯酚-硫酸法在490nm波长处测定吸光度。5)料液比对菌丝多糖提取率的影响:预处理后干菌丝过80目筛,准确称取4份样品,每份2.0g,分别以料液比(g/mL):1:10、1:20、1:30、1:40、1:50加入水,沸水浴回流提取1h后, 提取液用苯酚-硫酸法在490nm波长处测定吸光度。每组实验平行进行3次,用平均值作为最后结果。
1.3.1.4 正交试验
在单因素试验基础上,以提取温度、粉碎粒度、提取时间和提取次数为考察因素,以多糖得率为评价指标,采用L9(34)正交表设计正交试验。每组实验平行进行3次,用平均值作为最后结果。
随着社会的发展,我国的环保意识不断增强,很多地区的林业建设慢慢成为重要的生产活动,笔者结合从业经验,围绕生态林业建设中林业技术推广存在的问题,阐述了新时期林业技术推广的有效方式,以期为业内人士提供参考。
1.3.2 拟康氏木霉多糖得率的测定
1.3.2.1 拟康氏木霉多糖的提取与精制
预处理后的干菌丝经最佳提取工艺提取后,所得多糖溶液浓缩至原体积的1/3后加入3倍体积的85%乙醇溶液,4℃静置过夜,离心。沉淀加蒸馏水溶解后,用Sevag法联合酶法脱蛋白,旋转蒸发仪挥干溶剂。加蒸馏水溶解,过D101大孔树脂,透析后冻干,得精制拟康氏木霉菌丝多糖粉末。
1.3.2.2 多糖含量的测定及得率的计算
换算因子的计算:准确称取干燥至恒质量的精制多糖粉末10.0mg,置100mL容量瓶中,加蒸馏水溶解并稀释至刻度,摇匀。从中精确吸取1mL,用苯酚-硫酸法测490nm波长处吸光度(A),求出多糖供试液中相当的葡萄糖质量浓度(ρ),按式(1)计算得换算因子。

式中:m为精制多糖质量mg;ρ为多糖稀释液葡萄糖质量浓度(mg/mL);D为多糖的稀释因素。
多糖含量测定:正交试验结果以多糖含量表示(%),多糖得率按式(2)计算。

式中:ρ为多糖稀释液中葡萄糖质量浓度/(mg/mL);D为多糖的稀释因素;f为换算因子;m为实验样品的质量/mg。
2 结果与分析
2.1 葡萄糖标准曲线
葡萄糖标准曲线回归方程为:Y = 0.004X + 0.0051,r= 0.9963。
2.2 拟康氏木霉多糖提取单因素试验结果
2.2.1 提取时间对提取率的影响
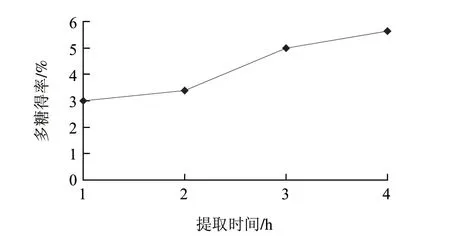
图 1 提取时间对提取率的影响Fig.1 Effect of extraction time on the yield of polysaccharides
粉碎粒度为20目、料液比1:100、沸水浴条件下考察提取时间对提取率的影响。由图1可知,随着提取时间的延长,多糖得率呈上升趋势,可以得出提取时间越长多糖得率越高,4h为最佳提取时间。
2.2.2 温度对提取率的影响
粉碎粒度80目、料液比1:100、提取时间1h条件下,考察不同温度对提取率的影响。从图2可知,多糖得率随温度升高而升高。100℃为最佳提取温度。

图 2 温度对提取率的影响Fig.2 Effect of temperature on the yield of polysaccharides
2.2.3 粉碎度对提取率的影响
料液比1:100、沸水浴回流提取1h条件下,考察不同粉碎度对提取率的影响。从图3可知,粉碎粒径大于80目时,粉碎度增加,多糖得率增加显著,达到80目进入平台期,粉碎粒度提高,提取率基本无变化,所以80目和120目均可作为为最佳粉碎粒度。

图 3 粉碎度对提取率的影响Fig.3 Effect of particle size on the yield of polysaccharides
2.2.4 提取次数对提取率的影响
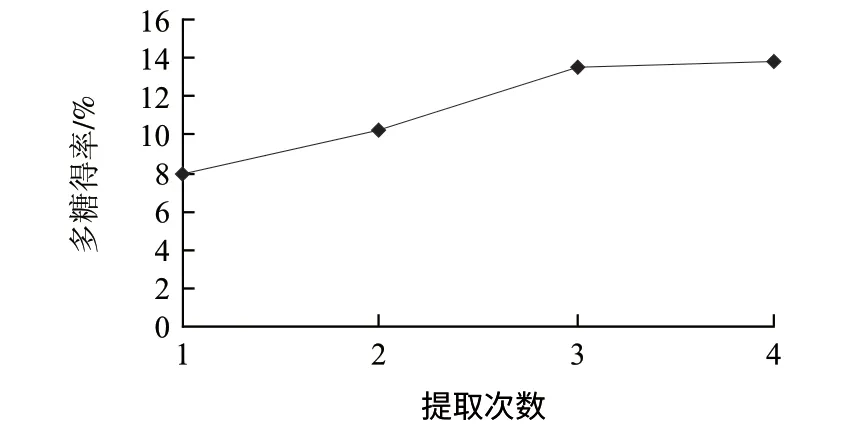
图 4 提取次数对提取率的影响Fig.4 Effect of extracting times on the yield of polysaccharides
粉碎粒度80目、料液比1:100、沸水浴,每次1h,考察不同提取次数对提取率的影响,结果如图4所示。随着提取次数的增加,提取率增高,但超过3次后增加不明显,所以3次为最佳提取次数。
2.2.5 料液比对提取率的影响
粉碎粒度80目,沸水浴回流提取1h,考察不同料液比对提取率的影响,结果如图5所示。1:30前随着料液比的增加多糖得率增加,但料液比超过1:30后反而有所下降,所以最佳料液比为1:30。

图 5 料液比对提取率的影响Fig.5 Effects of solid-liquid ratio on the yield of polysaccharides
2.3 拟康氏木霉多糖提取正交试验结果
选取提取时间、温度、粉碎粒度、提取次数4个因素进行四因素三水平正交试验,以拟康氏木霉多糖含量为考察指标,试验设计及结果见表1。

表1 正交试验设计及结果Table 1 Experimental design and results of orthogonal array design

表2 正交试验方差分析Table 2 Analysis of variance for the orthogonal array design
由表1分析可得,4个因素对拟康氏木霉多糖提取影响的顺序:提取温度>提取次数>提取时间>粉碎粒度。方差分析见表2。B因素(温度)P<0.05,有显著差异。说明在所设的不同温度下,其提取效果有显著性差异。其他因素各水平间的差异不显著。从正交试验结果可以看出,拟康氏木霉多糖提取率最高的提取条件是A1B3C3D3,即提取时间2h、提取温度100℃、粉碎粒度120目、提取3次,该最佳工艺提取3批[15],测定拟康氏木霉多糖得率(11.09±0.13)%,3次结果差异较小,说明该工艺稳定可行。
3 结 论
本实验通过单因素及正交试验得出拟康氏木霉菌丝多糖的最佳提取工艺为:料液比1:30、提取时间2h、提取温度(沸水)100℃、提取粒度120目、提取3次。对提取率的影响提取温度>提取次数>提取时间>粉碎粒度。虽然单因素中最佳提取时间为4h,但提取时间的延长意味着能耗的增加,结合正交试验结果,选择2h为最佳提取时间。
[1] 王志, 陈雄, 王实玉, 等. 拟康氏木霉和白腐菌混菌发酵处理稻草秸秆的研究[J]. 可再生能源, 2009, 27(2): 36-39.
[2] 韩峰, 孙彩云, 宋桂经, 等. 拟康氏木霉(Trichoderma pseudokoningii)UV III产纤维素酶液体发酵研究[J]. 工业微生物, 2002, 32(1): 28-31.
[3] 何圣红, 秦国正, 陈靠山. 从拟康氏木霉中提取壳聚糖的初步研究[J]. 天然产物研究与开发, 2009, 21(3): 502-505.
[4] 郝林华, 牛德庆, 陈靠山, 等. 拟康氏木霉液态发酵条件的研究[J]. 菌物学报, 2005, 24(2): 235-244.
[5] 郭敏, 柳春燕, 陈靠山. 拟康氏木霉胞壁多糖对黄瓜抗病性的诱导作用[J]. 天然产物研究与开发, 2009, 21(5): 748-751.
[6] 魏广金, 石磊, 张鹏英, 等. 拟康氏木霉胞外多糖对黄瓜内源水杨酸的诱导作用[J]. 曲阜师范大学学报: 自然科学版, 2009, 35(2): 94-97.
[7] 郭敏, 石磊, 陈靠山. 拟康氏木霉胞外多糖对番茄灰霉病的诱抗作用及对几种防御酶活性的影响[J]. 曲阜师范大学学报: 自然科学版, 2005, 31(2): 99-102.
[8] 柳春燕, 郭敏, 林学政. 拟康氏木霉和枯草芽孢杆菌对黄瓜枯萎病的协同防治作用[J]. 中国生物防治, 2005, 21(3): 206- 208.
[9] 石磊. 拟康氏木霉产胞外多糖的分离纯化及组成初步研究[J]. 曲阜师范大学学报: 自然科学版, 2009, 35(3): 73-76.
[10] HUANG Taotao, LIN Jun, CAO Jianfeng, et al. An exopolysaccharide from Trichodermap seudokoningii and its apoptotic activity on human leukemia K562 cells[J]. Carbohydrate Polymers, 2012, 89(2): 701-708.
[11] 孔梦丽. 拟康氏木霉胞外多糖对小鼠的免疫增强活性研究[D]. 济南: 山东大学, 2011.
[12] 王黎明, 夏文水. 水法提取茶多糖工艺条件优化[J]. 食品科学, 2005, 26(5): 171-174.
[13] 王鸿, 邓泽元, 刘蓉, 等. 响应曲面法优化山蕗菜根多糖的提取工艺[J]. 食品科学, 2010, 31(2): 46-50.
[14] 董艳红, 李姝婧, 郑惠华, 等. 响应曲面优化超声波提取灵芝多糖工艺研究[J]. 食品科学, 2009, 30(16): 98-101.
[15] 王凌云, 丁晨旭, 王洪伦, 等. 唐古特白刺果实多糖的提取工艺研究[J]. 食品科学, 2008, 29(3): 233-236.
[16] 黄璞, 谢明勇, 聂少平, 等. 响应曲面法优化微波辅助提取黑灵芝孢子多糖工艺研究[J]. 食品科学, 2007, 28(10): 200-203.
[17] 吴琼, 代永刚, 邹险峰, 等. 正交试验优化微波辅助提取人参根茎和人参须多糖[J]. 食品科学, 2012, 33(24): 156-159.
[18] 岳金玫, 蒲彪, 周月霞, 等. 响应面法优化块菌多糖的酶法辅助提取工艺[J]. 食品科学, 2013, 34(2): 119-124.
[19] 陈艳伟, 王承明. 响应面法优化菜籽饼粕多糖水酶法提取工艺[J]. 食品科学, 2012, 33(22): 44-47.
[20] 王文平, 郭祀远, 李琳, 等. 苯酚-硫酸法测定野木瓜中多糖含量的研究[J]. 食品科学, 2007, 28(4): 276-279.
[21] 张惟杰. 复合多糖生化研究技术[M]. 2版. 杭州: 浙江大学出版社, 1999: 11-12; 329-337.
[22] 谢建华, 谢明勇, 聂少平, 等. 青钱柳多糖提取工艺的研究[J]. 食品科学, 2007, 28(10): 188-191.

