茶叶提取物对采后桃果苯丙氨酸解氨酶、多酚氧化酶、过氧化物酶活性的诱导
张绍珊,陈娇娇,杨晓萍,*
(1.园艺植物生物学教育部重点实验室,华中农业大学园林学院,湖北 武汉 430070;2.浙江省松阳县茶叶市场茶叶检测中心,浙江 松阳 323400)
植物对机械损伤或病原菌浸染有着天然防御反应,遭受侵害时体内通常会发生一系列生理生化反应来增加自身的抵御能力,其中诱导相关抗性酶活性发挥了重要作用[1]。酚氧化酶(PPO)、过氧化物酶(POD)和苯丙氨酸解氨酶(PAL)是植物体内重要的抗性酶,受伤或感病后植物PPO、POD和PAL等活性增强,与植物抗性的获得呈现明显的相关性[2-3]。因此,诱导植物PPO、POD和PAL等抗性酶活性被认为是发掘植物内在抗性机制以抵御病原菌浸染、机械损伤的重要对策。
目前,有关生防菌[4]、化学物质[5-6]、紫外线[7]等诱导植物感病过程中抗性酶活性增强的研究较多,有关植物提取物诱导植物感病过程抗性酶活性报道较少,仅Latha等[8]研究报道磨盘草等20种植物提取物通过诱导番茄叶POD、PPO、PAL活性的增强来防御番茄早疫病;Kagale等[9]研究报道夹竹桃等16种植物提取物通过增强小麦叶片POD、PAL活性来防御小麦纹枯病菌的侵染;杨书珍等[10]研究报道蜂胶提取物通过诱导柑橘果皮中PAL、POD、PPO等活性的增强来防御柑橘青霉病等,而有关植物提取物诱导采后果品机械损伤或感病过程中抗性酶活性防御病原菌浸染的相关研究还未见报道。
茶是国际健康饮品,茶叶及其所含功能成分有明显抑菌能力[11-12],可用于新鲜果品的防腐保鲜[13],但其防腐保鲜机理研究还十分缺乏,更未见茶及其提取物诱导采后果品抗性酶活性的报道。本实验以曙光油桃为试材,以桃灰霉病菌为供试菌,研究茶提取液对机械损伤或接种灰霉病菌桃果PPO、POD和PAL活性的诱导,为探明茶提取液防腐保鲜机理提供理论依据。
1 材料与方法
1.1 材料与仪器
病原菌:实验所用病菌为灰霉病菌(B o t r y t i s cinerea),分离于自然发病的桃果实,经分离、纯化、形态分析及显微观察证实。将其接种于马铃薯葡萄糖琼脂培养基(PDA)上,28℃恒温培养3d,沿生长均匀、旺盛的菌落边缘用直径为5mm的打孔器打取菌饼,按10块/100mL接种于马铃薯葡萄糖液体培养基(PD)中,在28℃、200r/min条件下振荡培养4d,用匀浆机(12000r/min)匀浆30s,制成菌丝悬浮液备用。
果实:供试果实为曙光油桃(Prunus persica var. nectarina),采自华中农业大学果树标本园,选择外观整齐、成熟度八成熟、无病虫害和机械损伤的果实,用2%次氯酸钠浸泡3min后用自来水冲洗,自然晾干后备用。
茶叶提取物为本实验室自制。以绿茶为原料,经60%乙醇提取、过滤,大孔吸附树脂吸附、70%乙醇洗脱,收集洗脱液,回收乙醇,将浓缩样品以水稀释成茶叶提取液(茶多酚含量为1.1%)。
ScTRSum 53型紫外-可见分光光度计 上海棱光技术有限公司;TDL-5-A型高速离心机 北京医用离心机厂。
1.2 方法
1.2.1 茶叶提取物对采后桃果实酶活性的诱导
用接种针在果实最大直径处垂直刺4mm(深)×5mm(宽)的伤口,伤口晾干后分别接种无菌蒸馏水和6.0g/L茶叶提取液50μL,1.5h后分别再接种病菌悬浮液25μL。实验处理如下:P1:果实打孔+接种处理液;P2:果实打孔+接种处理液+接种B. cinerea;CK1:果实不打孔;CK2:果实打孔;CK3:果实打孔+接种B. cinerea。果实晾干后贮藏于25℃,并保持90%左右的相对湿度。每处理50个果实,各处理重复3次,分别于0、24、48、72、96h取样测定酶活性,每次测定的样品取自10个果实的病健交界处(病斑与完好组织的交接部位)果肉。
1.2.2 PAL酶液制备与活性测定
5g果肉中加入0.5g聚乙烯吡咯烷酮(PVP),再加入0.1mol/L的硼酸缓冲液20mL(pH8.8,含有10mmol/L巯基乙醇,50mmol/L EDTA-Na2),冰浴匀浆,12000r/min、4℃离心20min,上清液用于酶活测定。PAL活性测定参照Assis等[14]的方法加以改进,在290nm波长处测定吸光度(A290nm)的变化,每小时每克鲜质量(FW)的A290nm改变0.01定义为一个酶活力单位U,用U/(g·h)表示。
1.2.3 PPO、POD酶液制备与活性测定
10g果肉中加入0.5g PVP,再加入20mL 0.2mol/L磷酸缓冲液(pH6.4),冰浴匀浆,12000r/min 4℃离心20min,上清液用于酶活力测定。PPO活性测定参照Tian等[15]方法加以改进,在410nm波长处测定OD值的变化;POD活性测定参照田世平等[16]方法加以改进,在470nm波长处测定A470nm值的变化。PPO、POD活性均以每分钟每克鲜质量(FW)的A470nm改变0.01定义为一个酶活力单位U,用U/(g·min)表示。
1.2.4 茶叶提取物对采后桃果实灰霉腐病的防止效果
桃果实按照上述方法进行处理后贮藏于25℃,分别于24、48、72、96h统计果实发病率和腐烂程度。每处理20个果实,重复3次。
1.3 数据处理与分析
实验结果采用SPSS软件中One-way ANOVA进行统计分析,Duncan氏多重比较进行差异显著性检验,结果以“±s”表示,P<0.05,表示差异显著。
2 结果与分析
2.1 茶叶提取液对采后桃果PAL活性的影响
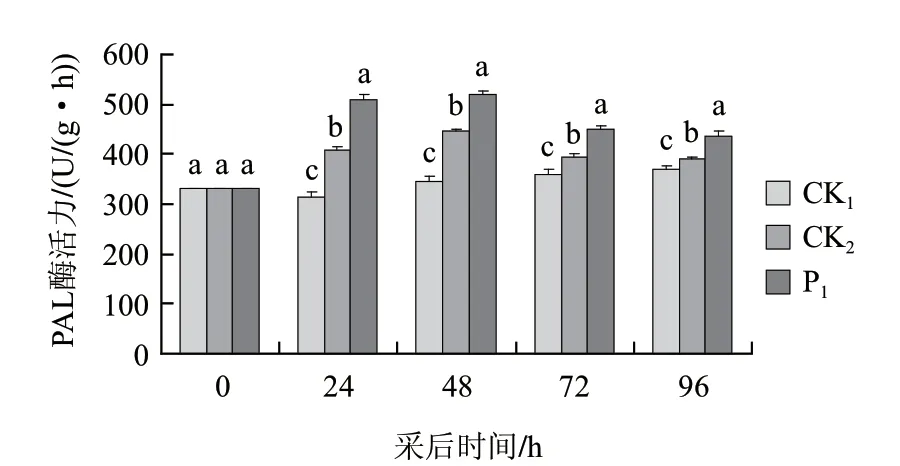
图 1 茶叶提取液对打孔桃果PAL活性的影响Fig.1 Effect of tea extract on PAL activity of punched peach fruit
由图1可知,桃果采后24h PAL活性略有降低,随后随放置时间的延长,PAL活性呈缓慢增加趋势;打孔处理能明显诱导桃果PAL活性的增强,且随放置时间的延长,PAL活性呈先升后降趋势;打孔+茶叶提取液处理组PAL活性变化趋势与打孔处理组相似,但与打孔处理组相比PAL活性明显增强,说明茶叶提取液处理能明显诱导打孔桃果PAL活性增强。
2.2 茶叶提取液与灰霉病菌联合处理对采后桃果PAL活性的影响
由图2可知,桃果打孔+接种B. cinerea后PAL活性的变化趋势与打孔处理相似,均呈先升后降趋势,但在整个观察过程中打孔+接种B. cinerea组桃果PAL活性均高于打孔处理组,打孔+接种病菌后24h与打孔处理组相比差异达显著性水平,且打孔+接种B. cinerea诱导PAL活性增强速度明显快于打孔处理,接种后24h PAL活性就达到峰值,而打孔处理后48h PAL活性才达到峰值,这些研究结果表明接种病菌能迅速诱导PAL活性增强。
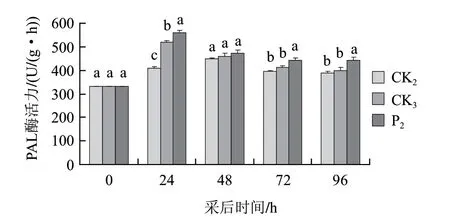
图 2 茶叶提取液与灰霉病菌联合处理对打孔桃果PAL活性的影响Fig.2 Effect of tea extract and B. cinerea on PAL activity of punched peach fruit
打孔+接种病菌+茶叶提取液处理组PAL活性变化趋势与打孔+接种病菌处理组一致,但茶叶提取液处理能进一步诱导PAL活性的增强,与打孔处理组、打孔+接种病菌处理组相比差异均达显著性水平(除接种后48h外)。
2.3 茶叶提取液对采后桃果PPO活性的影响

图 3 茶叶提取液对打孔桃果PPO活性的变化Fig.3 Effect of tea extract on PPO activity of punched peach fruit
由图3可知,桃果采后随放置时间的延长,不打孔处理组、打孔处理组及打孔+茶叶提取液处理组PPO活性均呈先升后降的趋势。打孔处理能明显诱导PPO活性的增强,打孔后72h内 PPO活性与不打孔处理组相比差异均达显著性水平;茶叶提取液处理能进一步诱导打孔桃果PPO活性增强,在整个观察过程中与打孔处理组相比差异均达显著性水平,说明茶叶提取液处理能明显诱导打孔桃果PPO活性增强。
2.4 茶叶提取液与灰霉病菌联合处理对采后桃果PPO活性的影响
由图4可知,桃果打孔+接种B. cinerea、打孔+接种B. cinerea+茶叶提取液处理后PPO活性变化趋势与打孔处理一致,均随处理时间的延长先上升,48h后达到峰值,随后又急剧下降。桃果接种病菌后能诱导PPO活性增强,但仅接种24h后与打孔处理组相比差异达显著水平;茶叶提取液处理能进一步诱导接种病菌组桃果PPO活性增强,与打孔处理相比,接种24、72、96h差异达显著水平,与打孔+接种B. cinerea组相比,接种72、96h差异也达显著水平。
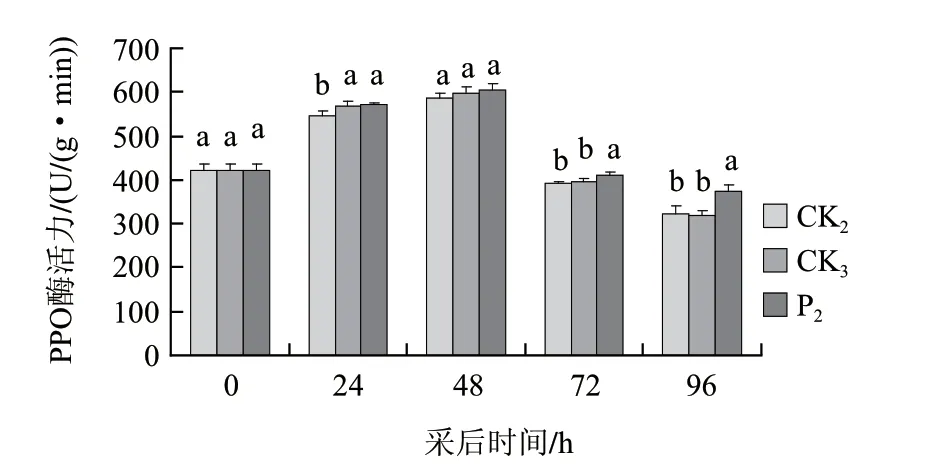
图 4 茶叶提取液与灰霉病菌联合处理对打孔桃果PPO活性的变化Fig.4 Effect of tea extract and B. cinerea on PPO activity of punched peach fruit
2.5 茶叶提取液处理对采后桃果POD活性的影响
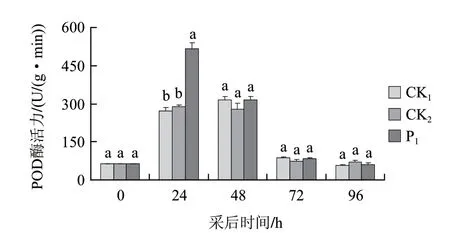
图 5 茶叶提取液对打孔桃果POD活性的变化Fig.5 Effect of tea extract on POD activity of punched peach fruit
由图5可知,桃果采后随放置时间的延长POD活性呈先升后降的趋势,48h达到峰值。打孔处理对桃果POD活性没有明显影响,而打孔+茶叶提取液处理初期能显著诱导POD活性上升,处理后24h POD活性与不打孔处理组、打孔处理组相比差异达显著水平,随后POD活性下降,与不打孔处理组、打孔处理组相比差异不显著。
2.6 茶叶提取液与灰霉病菌联合处理对采后桃果POD活性的影响
由图6可知,桃果打孔+接种B. cinerea及打孔+接种B. cinerea+茶叶提取液后POD活性变化趋势与打孔处理一致,均呈先升后降的趋势。打孔+接种B. cinerea处理前期诱导POD活性急剧增强,处理24、48h后POD活性显著高于打孔处理组,随后迅速下降,POD活性显著低于打孔处理组。茶叶提取液处理前期对接种病菌桃果POD活性无明显影响,在处理后期可一定程度抑制接种病菌桃果POD活性降低,处理72、96h后POD活性显著高于接种病菌组。
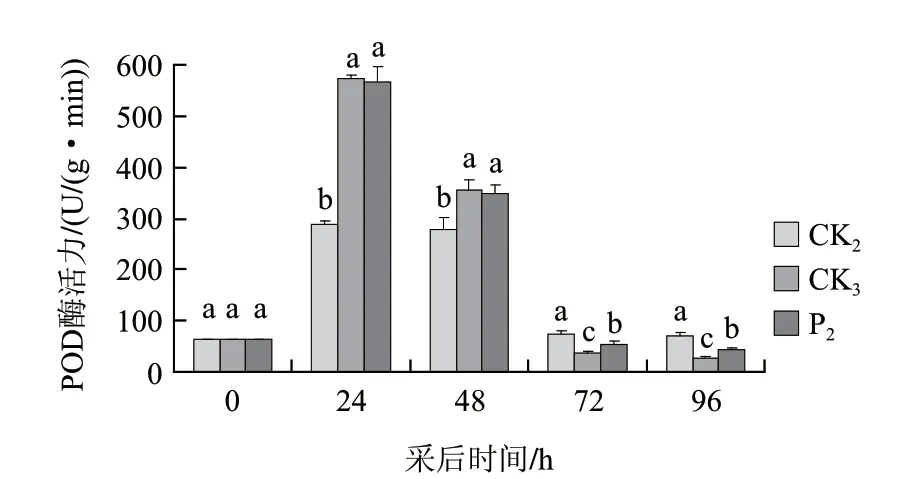
图 6 茶叶提取液与灰霉病菌联合处理对打孔桃果POD活性的变化Fig.6 Effect of tea extract and B. cinerea on POD activity of punched peach fruit
2.7 茶叶提取物对采后桃果灰霉病的防止效果
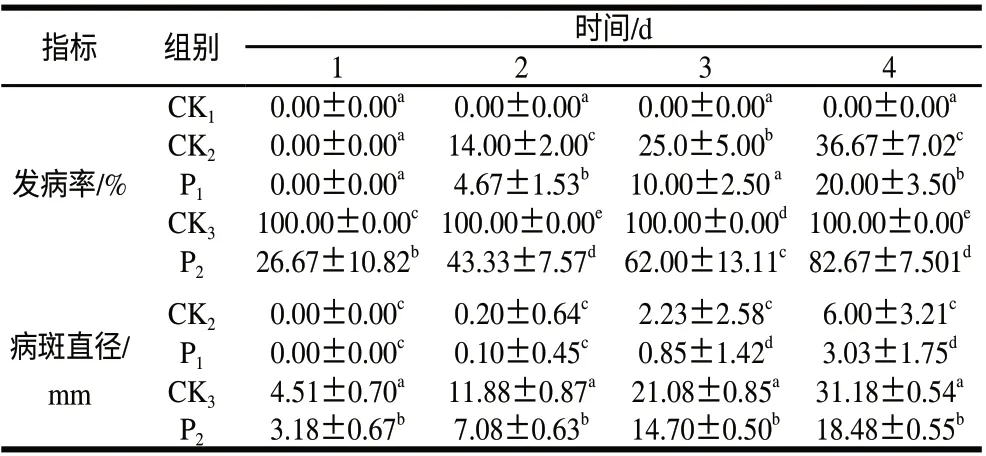
表 1 茶叶提取物对采后桃果灰霉腐病的防止效果Table 1 Effect of tea extract against Botrytis cinerea of postharvest peach fruit
虽然没打孔组桃果经4d贮藏后均没有发病,但打孔组桃果第2天开始感病,且与没打孔组桃果相比差异达显著水平;打孔+接种病菌组桃果第1天开始感病,且感病率高达100%,与打孔组桃果相比差异达极显著水平,说明该桃果感病性较强。茶叶提取物处理不仅能显著减少打孔组桃果发病率与病斑直径(P<0.05),也能显著减少打孔+接种病菌组桃果发病率与病斑直径(P<0.05),表明茶叶提取物能有效提高桃果抗病性,这与茶叶提取物能诱导桃果抗性酶活性一致。
3 讨 论
植物诱导抗性是植物受到外界物理、化学或者生物等因素侵袭时所产生的一种获得性抗性,使植物获得抵御病害的能力,从而杜绝或减少化学药品的使用。植物抗性的诱导主要表现为木质素的产生、植保素的合成与积累、抗性酶活性增强及抗性蛋白的产生,其中植物在抵御机械损伤或病原微生物侵染过程中,PAL、PPO、POD等抗性酶发挥了重要作用。PAL是苯丙烷类物质代谢途径的的第一关键酶,与木质素、植保素及酚类化合物等抗性物质的形成密切相关[17]。PPO是引起果实褐变的主要因素[18],但在植物抗病反应中也发挥着重要作用。PPO通过催化木质素及酚类氧化产物的形成,构成保护性屏蔽而使细胞免受病菌的侵害,也可通过醌类化合物的形成直接发挥抗病作用[19]。POD在植物抵抗病原菌中也发挥重要作用,主要在木质素生物合成的最后一步反应过程中催化H2O2分解而发挥作用[20]。
本实验结果表明,桃果机械损伤后PAL、PPO活性显著增强,机械损伤后桃果接种灰霉病菌不仅会进一步诱导PAL、PPO活性增强,还能诱导POD活性增强,接种病菌后24h桃果PAL、PPO、POD活性与没打孔组、打孔组桃果相比差异均达显著水平。茶叶提取液处理不仅能诱导机械损伤组桃果PAL、PPO、POD活性增加,与打孔组相比,处理后24h差异均达显著水平,也能诱导接种病原菌组桃果PAL、PPO活性增强。这些研究结果表明在抵御机械损伤或接种病原菌引起的桃果感病过程中PAL、PPO、POD发挥了重要作用。桃果在机械损伤或接种病原菌后PAL、PPO、POD活性增加过程中,桃果开始感病,但茶叶提取液处理能减缓机械损伤桃果的发病率及发病程度,也能明显减少病原菌侵染桃果病斑直径,说明茶叶提取液发挥防腐保鲜效果是通过诱导桃果PAL、PPO、POD活性增强而实现的。
[1] 田世平, 产祝龙. 诱导抗性在果蔬采后病害防治中的研究与应用[J]. 植物病理学报, 2004, 34(5): 385-394.
[2] AHIGOY P, FELIX G, METRAUXJ P, et al. Resistance to disease in the hybrid Nicotiana glutinosa × Nicotiana debneyi is associated with high constitutive levels of β-1,3-glucanase, chitinase, peroxidase and polyphenoloxidase[J]. Physiological and Molecular Plant Pathology, 1992, 41: 11-21.
[3] RASMUSSEN J B, HAMMERSCHMIDT R, ZOOK M N. Systemic induction of salicylic acid accumulation in cucumber after inoculation with Pseudomonas syringae pv syringae[J]. Plant Physiology, 1991, 97: 1342-1347.
[4] 秦国政, 田世平, 刘海波, 等. 拮抗菌与病原菌处理对采后桃果实多酚氧化酶、过氧化物酶及苯丙氨酸解氨酶的诱导[J]. 中国农业科学, 2003, 36(1): 89-93.
[5] 张宗申, 彭新湘, 姜子德, 等. 非生物诱抗剂草酸对黄瓜叶片中过氧化物酶的系统诱导作用[J]. 植物病理学报, 1998, 28(2): 145-150.
[6] LIN W L, HU X Y, ZHANG W Q, et al. Hydrogen peroxide mediates defence responses induced by chitosans of different molecular weights in rice[J]. Journal of Plant Physiology, 2005, 162: 937-944.
[7] 荣瑞芬, 郭堃, 李京霞, 等. UV-C处理采后桃防御酶活性与贮藏效果研究[J]. 食品科学, 2007, 28(8): 505-509.
[8] LATHA P, ANAND T, RAGUPATHI N, et al. Antimicrobial activity of plant extracts and induction of systemic resistance in tomato plants by mixtures of PGPR strains and Zimmu leaf extract against Alternaria solani[J]. Biological Control, 2009, 50: 85-93.
[9] KAGALE S, MARIMUTHU T, THAYUMANAVAN B, et al. Antimicrobial activity and induction of systemic resistance in rice by leaf extract of Datura metel against Rhizoctonia solani and Xanthomonas oryzae pv. Oryzae[J]. Physiological and Molecular Plant Pathology, 2004, 65: 91-100.
[10] 杨书珍, 彭丽桃, 潘思轶, 等. 蜂胶提取物处理对柑橘诱导抗病性的影响[J]. 食品科学, 2010, 31(8): 275-279.
[11] ALMAJANO M P, CARBO R, JIMENEZ J A L, et al. Antioxidant and antimicrobial activities of tea infusions[J]. Food Chemistry, 2008, 108: 55-63.
[12] 胡永金, 乔金玲, 葛长荣. 普洱茶与绿茶提取物体外抑菌效应的研究[J]. 食品科学, 2009, 30(13): 56 -59.
[13] CHEN J J, ZHANG S S, YANG X P. Control of brown rot on nectarines by tea polyphenol combined with tea saponin[J]. Crop Protection, 2013, 45: 29-35.
[14] ASSIS J S, MALDONADO R, MUNOZ T, et al. Effect of high carbon dioxide concentration on PAL activity and phenolic contents in ripening cherimoya fruit[J]. Postharvest Biotechnology, 2001, 23: 33-39.
[15] TIAN S P, XU Y, JIANG A L, et al. Physiological and quality responses of longan fruit to high O2or high CO2atmospheres in storage[J]. Postharvest Biology and Technology, 2002, 24: 335-340.
[16] 田世平, 徐勇, 姜爱丽, 等. 冬雪蜜桃在气调冷藏期间品质及相关酶活性的变化[J]. 中国农业科学, 2001, 34(6): 656-661.
[17] PELLEGRINI L, ROHFRITSCH O, FRITIG B, et al. Phenylalanine am monia-lyase in tobacco[J]. Plant Physiology, 1994, 106: 877-886.
[18] SIDDIQ M, CASH J N, SINHA N K, et al. Characterization and inhibition of polyphenol oxidase from pears (Pyrus communis L. cv. Bosc and Red)[J]. Journal of Food Biochemistry, 1994, 17: 327-337.
[19] SCHNEIDER S, ULLRICH W. Differential induction of resistance and enhanced enzyme activities in cucumber and tobacco caused by treatment with various abiotic and biotic inducers[J]. Physiological and Molecular Plant Pathology, 1994, 45: 291-304.
[20] ABELES F B, BILES C L. Characterization of peroxidases in lignifying peach fruit endocarp[J]. Plant Physiology, 1991, 95: 269-273.

