地衣芽孢杆菌W10菌液和抗菌蛋白对桃果实贮藏保鲜效果的影响
贺惠文,孙黎平
(扬州大学广陵学院,江苏 扬州 225009)
桃(Amygdalus persica)果作为一种日常水果年产量较高,但在其采收后的贮藏和运输过程中经常会有烂果损失。引起桃果腐烂的原因是各种病原菌通过伤口或皮孔侵入,病果还会进一步感染周围健康桃果造成更大经济损失[1]。目前,生产上桃果保鲜处理主要依赖于化学手段,而生物手段以其高效、安全的特点也受到广泛关注[2]。与化学防治相比,生物防治在保证果实品质同时,无化学药剂残留,更符合当代绿色环保的消费理念[3]。
地衣芽孢杆菌(Bacillus licheniformis)W10菌株对桃褐腐病、桃枝枯病等多种植物致病菌均有抑制作用,其生防作用机理主要是具有抗菌蛋白活性[4]。为了探讨地衣芽孢杆菌W10菌液及抗菌蛋白对贮藏期桃果的保鲜作用,本文测定不同处理桃果贮藏期的色泽、硬度、可溶性固形物含量、失重率、腐烂率等指标,为地衣芽孢杆菌W10生防菌在桃果采后保鲜中的应用奠定基础[5]。
1 材料与方法
1.1 材料
地衣芽孢杆菌W10菌株从番茄根际土壤中分离获得,由扬州大学园艺与植物保护学院植物病理组实验室提供[6]。
桃果品种为‘沪油018’,成熟度为底色转白、50%表皮着红色时采收,由上海农业科学院林木果树研究所提供[7]。
1.2 方法
采摘后桃果分为4组,每组30个,分别用菌液(1010cfu·mL-1)、抗菌蛋白(3.0 mg·mL-1)、多菌灵(1000 μg·mL-1)以及无菌水(对照)浸泡 5 min 后晾干,于25 ℃、相对湿度70%~75%环境中贮藏。
1.2.1 菌液制备
地衣芽孢杆菌W10菌株用固体牛肉膏蛋白胨培养基(NA)活化后,接种于NA培养液中,经28 ℃、180 r·min-1摇床培养48 h得菌液。用平板计数法测量菌液浓度为1010cfu·mL-1[8]。
1.2.2 抗菌蛋白制备
菌液离心后,取上清液用0.45 μm细菌滤器过滤得培养滤液;滤液加硫酸铵达30%饱和度后静置12 h使蛋白析出。离心收集粗蛋白,用Tris-HCl缓冲液悬浮并反复透析6次,经0.22 μm细菌滤器过滤得到分子量为46 kDa抗菌蛋白[9]。为保证抗菌蛋白活性稳定,所有操作均在4 ℃下进行[10]。用紫外吸收法测量抗菌蛋白浓度。按表1配制不同浓度蛋白溶液,分别测定 OD280值,绘制标准曲线列出方程。测定抗菌蛋白 OD280值,根据牛血清蛋白的标准曲线方程计算抗菌蛋白浓度为4.444 mg·mL-1,稀释成 3.0 mg·mL-1备用[11]。

表1 标准蛋白质浓度Table 1 Standard protein concention
1.3 桃果保鲜指标测定
1.3.1 色泽
随机取10个桃果,用WSC-80C色差计(北光世纪仪器)测量桃果缝合线左右赤道部位色差L*值[12],每个桃果重复三次,取平均值。
1.3.2 硬度
随机取10个桃果,去除桃果缝合线左右赤道部位果皮后,用GY-1果实硬度计(德国Bareiss)测量桃果硬度[13],每个桃果重复三次,取平均值。
1.3.3 可溶性固形物含量
随机取10个桃果,取桃果缝合线左右赤道部位果肉,去皮榨汁,用ATAGO折射仪(日本爱拓)测定桃果可溶性固形物含量[14],每个桃果重复三次,取平均值。
1.3.4 失重率
随机取10个桃果,记录桃果原始重量,处理后每隔2 d称重计算桃果失重率,每个桃果重复三次,取平均值。
1.3.5 腐烂率
随机取10个桃果,处理后每隔2 d记录桃果腐烂个数,计算桃果腐烂率,每个桃果重复三次,取平均值。
1.4 数据处理
采用Microsoft Office Excel软件进行数据统计并制图,误差线表示数据标准误,采用Student t-test进行差异比较并计算P值。
2 结果与分析
2.1 桃果色泽变化
色差L*值反映从黑到白的光泽明亮度,采后不同处理的桃果色泽变化如图 1[15]。在贮藏期内,经地衣芽孢杆菌W10菌液、抗菌蛋白和多菌灵处理后的桃果色差L*值呈先上升后平稳变化趋势,而对照组桃果色差L*值在贮藏3 d后显著下降。说明采后处理可较好保持贮藏期桃果原有色泽。贮藏11 d后,经地衣芽孢杆菌 W10抗菌蛋白处理桃果色差 L*值为63.37,显著高于对照组(56.12),说明地衣芽孢杆菌W10抗菌蛋白处理可提高贮藏期桃果果面亮度。
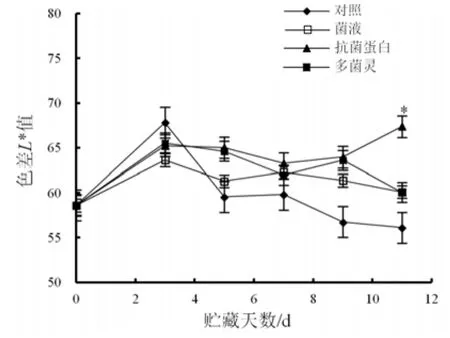
图1 不同处理后桃果色泽变化Fig.1 Changes of chromatic aberration of peach under different treatments
2.2 桃果硬度变化
硬度是影响桃果口感的重要因素,采后不同处理对桃果硬度影响如图 2。随着贮藏天数增加,桃果硬度显著下降,说明桃果采后有一个自然软化过程。贮藏5 d后,经地衣芽孢杆菌W10菌液、抗菌蛋白处理的桃果硬度分别为 2.049 kg·cm-2和1.917 kg·cm-2,显著高于对照组(1.166 kg·cm-2)以及多菌灵处理(0.681 kg·cm-2)(P<0.05),但地衣芽孢杆菌 W10菌液和抗菌蛋白处理桃果硬度差异不显著(P>0.05)。贮藏至11 d,采后处理桃果硬度与对照组无差异。因此,桃果采后经地衣芽孢杆菌W10菌液和抗菌蛋白处理前期可延缓果肉硬度变化。
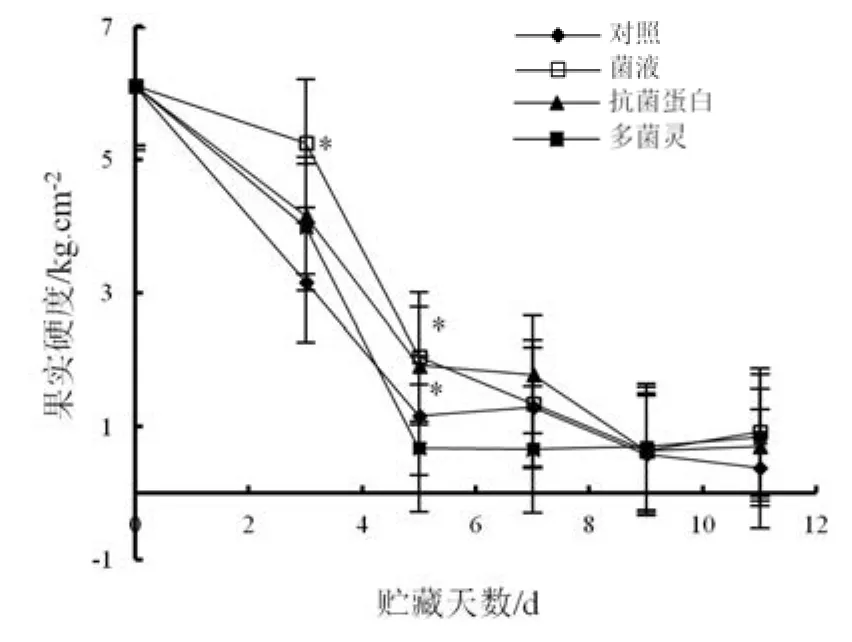
图2 不同处理后果实硬度变化Fig.2 Changes of firmness of peach under different treatments
2.3 桃果可溶性固形物含量变化
采后不同处理对桃果可溶性固形物含量影响如图 3。贮藏期内,桃果可溶性固形物含量变化呈平稳上升趋势。贮藏 11 d后,经地衣芽孢杆菌 W10菌液和抗菌蛋白处理桃果可溶性性固形物含量分别为11.43%和11.13%,二者之间差异不显著,但皆显著高于对照组(10.14%)及多菌灵处理桃果(10.11%)。说明地衣芽孢杆菌W10菌液和抗菌蛋白处理采后桃果可在一定程度上增加桃果可溶性固形物含量[16]。

图3 不同处理后桃果可溶性固形物含量变化Fig.3 Changes of soluble solid content of peach under different treatments
2.4 桃果失重率变化
采后不同处理对桃果失重率变化影响如图4所示。贮藏至11 d,经地衣芽孢杆菌W10菌液和抗菌蛋白处理的桃果失重率分别为13.89%和14.43%,显著(P<0.05)低于对照组(19.79%)和经多菌灵处理桃果(17.46%)。说明采后桃果经地衣芽孢杆菌W10菌液和抗菌蛋白处理可有效抑制桃果实采后失重,且抑制作用优于经多菌灵处理组。
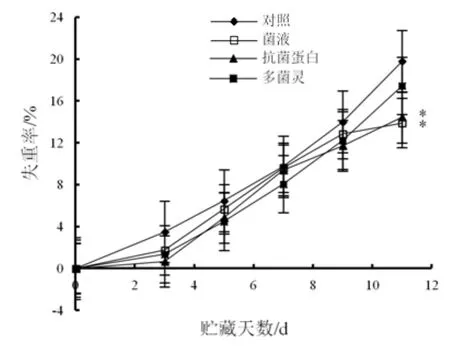
图4 不同处理后桃果失重率变化Fig.4 Changes of weight loss of peach under different treatments
2.5 桃果腐烂率变化
采后不同处理对桃果腐烂率变化影响如图5所示。贮藏期桃果均有不同程度腐烂,贮藏至11 d,经地衣芽孢杆菌W10菌液和抗菌蛋白处理的桃果实腐烂率分别为20.00%和23.33%,都显著(P<0.05)低于对照组(31.67%)。进一步比较发现,地衣芽孢杆菌W10菌液处理的桃果实腐烂率(20.00%)与多菌灵处理的桃果腐烂率(16.67%)差异不显著(P>0.05)。由此说明,地衣芽孢杆菌W10菌液和抗菌蛋白处理均可抑制贮藏期桃果腐烂。
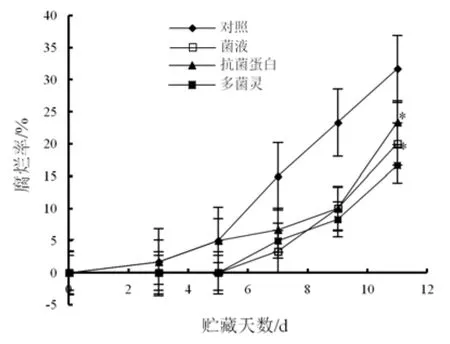
图5 不同处理后桃果腐烂率变化Fig.5 Changes of rotting rate of peach under different treatments
3 讨论
芽孢杆菌作为生防细菌具有繁殖速度快,营养要求简单,易于在植物体表繁殖等优点。目前,在采后桃果保鲜研究应用中主要涉及枯草芽孢杆菌(Bacillus subtilis)和解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。枯草芽孢杆菌 CPA-8能有效防治桃褐腐病,其产生的脂肽类抗菌物质Fengycin具有重要的防腐作用[17]。解淀粉芽孢杆菌C06对采后桃褐腐病防效高达 78%,可将桃果的货架期从 3 d延长至 7 d,其产生的抗菌物质为脂肽类化合物Fengycin和Bacillomycin D[18]。地衣芽孢杆菌W10是本实验室从植物根际土壤中分离筛选出来的一株高效生防菌,具有广谱抗菌性,对桃褐腐病、桃枝枯病均具有抑菌效果。相比于脂肽类抗菌物质,本研究首次明确地衣芽孢杆菌代谢产生的抗菌蛋白在桃果保鲜中的作用,为该类抗菌蛋白的应用奠定基础。
影响采后桃果贮藏期品质的不仅是外观色泽变化,还包括果实硬度、可溶性固形物含量等多项内在指标[19]。与对照组相比,经地衣芽孢杆菌W10菌液及抗菌蛋白处理后桃果色泽、果实硬度和可溶性固形物含量均有所提高,且对贮藏期桃果采后失重有所抑制,说明用地衣芽孢杆菌W10菌液和抗菌蛋白处理采后桃果对保持其原有品质具积极作用[20]。贮藏期间桃果腐烂率较高,经地衣芽孢杆菌W10菌液和抗菌蛋白处理可显著降低果实腐烂率[21]。贮藏至11 d时,经地衣芽孢杆菌W10菌液处理桃果腐烂率降低至20%,与化学药剂多菌灵防腐效果差异不显著。说明地衣芽孢杆菌W10可达到与化学药剂相当的防腐效果,且其保鲜效果优于化学药剂。经质谱分析发现,地衣芽孢杆菌W10抗菌蛋白的有效抑菌成分是分子量为48794.16 Da的丝氨酸蛋白酶,具有水溶特性[22]。经地衣芽孢杆菌W10菌液和抗菌蛋白处理后的桃果用清水冲洗即无残留,保证了桃果食用的安全性。地衣芽孢杆菌W10抗菌蛋白无色无味,不影响果实风味,作为原材料在生物保鲜剂领域具有广阔的市场应用前景[23]。

