射频磁控溅射法制备钛基HA 涂层的结构与生物活性
王国卿,张乃生
(1.东北大学 生命科学与健康学院,沈阳 110004;2.吉林大学 动物医学学院,长春 130062)
钛(Ti)因具有低密度、高强度、耐腐蚀等优点,广泛应用于生物材料领域,但其性质与骨组织相差很大,不能与骨组织发生化学键性结合[1]。因此,需要对Ti进行表面改性,以增强其骨引导功能。羟基磷灰石(Hydroxyapatite,HA)与人骨无机成分相似,可与细胞表面的生物大分子以氢键结合,是公认的具有良好生物相容性和成骨活性的陶瓷材料[2],在医用金属材料表面改性方面应用较多。Ti 基HA 涂层生物材料可将Ti的高力学强度和HA的优良生物学性能相结合,在修复骨缺损中前景广阔[3]。
制备HA 涂层的常用方法有溶胶–凝胶法[4]、等离子喷涂法[5]、电泳沉积法[6]、微弧氧化法[7]等。高温下制备的HA 涂层存在微裂纹及CaO和α-磷酸钙[8],涂层溶解率高,在机体内稳定性差;低温生成的HA 涂层结合强度低,植入后存在涂层过早剥离的风险。解决基体向涂层过渡的界面问题和获得理想薄膜晶态是制备HA 涂层的关键。射频磁控溅射法是制备金属基陶瓷涂层的成熟技术,具有基体温升低、沉积快、涂层成分均匀、结合强度高等优点[9]。目前以该技术制备金属-HA 涂层生物材料的报道较少[10],且相关研究均缺乏生物材料在机体内的生物学行为的反馈信息。
细胞实验和体内植入实验是评价生物材料的常用方法,前者可以分析生物材料对细胞生物学行为的影响,对材料筛选具有重要意义;而机体环境及其与材料表面的相互作用过程十分复杂,因此生物材料在机体内的生物学行为是准确评价生物材料生物相容性的关键[11]。基于对相容条件及有效表征的控制,更好地优化射频磁控溅射工艺,制备高质量HA 涂层是当前的研究热点。
为此,本文作者采用射频磁控溅射法制备Ti 基HA 涂层生物材料,研究射频磁控溅射沉积HA 涂层工艺、以及涂层的化学组成、微观形貌与界面结合状态,以植入机体反馈评价生物材料的生物活性,探讨射频磁控溅射法制备HA 涂层在骨修复中应用的可能性。
1 实验
1.1 材料
实验基体为医用TA2 纯Ti 片,尺寸为10 mm×10 mm×2 mm。Ti 片表面用A12O3喷砂处理,经30%HNO3酸洗30 min,然后在丙酮和无水乙醇溶液中超声清洗各10 min,最后用去离子水漂洗、烘干。将平均粒径20 nm的HA 粉体(南京埃普瑞纳米材料有限公司生产)与聚乙烯醇和水按10:1:1的质量比混匀,于70 MPa 压力下压成直径 60 mm、厚度30 mm的靶材,于真空炉中1100℃下烧结2 h,升温速率3℃/min。
1.2 Ti 基HA 涂层制备
采用JPG560CI型超高真空多靶磁控溅射仪制备Ti 基HA 涂层。前期探索最适宜条件为:背底真空度5×10−4Pa,高纯Ar 工作气压0.3 Pa,溅射功率290 W,靶–基间距50 mm,溅射时间1.5~6 h。将制得的Ti 基HA 涂层材料在空气条件下以6℃/min的升温速率升至600℃,保温2 h后随炉冷却至室温。
1.3 测试与表征
采用JSM-7500FA 扫描电镜(JEOL Ltd 生产)观察涂层的表面形貌;利用XRD 分析涂层的相组成;用傅里叶变换红外光谱仪(FT-IR)分析化学组成;采用维氏纳米硬度计(CSEM Instruments)以纳米压痕法测试涂层的硬度,压头前端半径20μm,运动速度7 mm/min、加载速率2 N/min,最大载荷2 N。参照ASTM C-633,利用Instnon 1185 万能材料试验机测试基体和涂层的界面结合强度[10]。
1.4 Ti 基HA 涂层材料的细胞相容性
按照李晓峰等[12]的方法分离鉴定大鼠成骨细胞,将第3 代细胞制成1×105/mL的细胞悬液。按上述方法制备直径15 mm、厚2 mm的Ti 基HA 涂层试样,经60Co 辐射灭菌后置于24 孔培养板内,按1 mL/孔接种细胞于试样表面,补足含10%胎牛血清的DMEM培养液,于37℃、5% CO2培养箱中培养,对照组的孔内不加任何材料。一部分于1 h后终止培养,用PBS漂洗3 次,加入2.5%戊二醛固定,用扫描电镜观察细胞态;其余部分用于四氮噻唑盐(MTT)比色法检测材料细胞毒性:分别于2、5、8、11 天后取出培养板,加MTT 溶液20μL/孔,37℃下孵育4 h,弃上清,加入DMSO 220μL/孔,振荡10 min 使结晶充分溶解。从每孔中取200μL 液体到96 孔板内,用酶标仪490 nm测定各孔的吸光值(optical density,OD),以时间为横坐标,OD为纵坐标绘制细胞生长曲线,根据细胞生长情况判断Ti 基HA 涂层试样的细胞毒性。
1.5 Ti 基HA 涂层在动物体内的生物学行为
以10 只1.5~3 岁、体质量8~11 kg的杂种犬为实验犬,肌注隆鹏麻醉,按照常规手术方法分离桡骨中段,制成10 mm×10 mm 尺寸的骨缺损,植入并固定Ti 基HA 涂层试样,闭合创口,精心护理。术后4 周、12 周,将植入材料连同周围新生骨组织取出,种植体骨结合界面进行组织学切片,观察骨组织生成的特征,检测涂层的结合强度。
2 结果与讨论
2.1 HA 涂层形貌
图1所示为HA 涂层表面和截面的SEM 形貌。由图可见HA 涂层表面均匀,致密;检测区域未见缺 损、裂缝和断面;涂层表面凹凸不平,基本形状为岛屿样圆顶形颗粒,这种结构大幅度增加了涂层的表面积。涂层与Ti 基体界面结合紧密,无气孔和裂纹,基体与涂层界面处形成良好的机械咬合。在本实验条件下,涂层生成速率为0.54μm/h,随溅射时间延长涂层厚度增加,获得厚度(0.520±0.025)~(2.560±0.037)μm的涂层。不同厚度涂层的粗糙度如图2所示,可见随涂层厚度增加,涂层粗糙度Ra与Rz均略有增加。粗糙的表面有利于细胞的吸附、铺展,为新骨组织生长提供条件。

图1 HA 涂层表面(a)与截面(b)形貌Fig.1 The SEM photographs of HA coating
2.2 HA 涂层的XRD、IR 分析
图3和图4所示分别为HA 涂层的XRD谱和红外光谱。从图3可以看出:谱线中具有25.8°(002)、31.8°(211)、32.2°(112)HA 晶体特征峰,未见其它的钙磷化合物及CaO的衍射峰,涂层的平均晶粒尺寸为(40±2)nm。图4中除PO43−基团特征振动峰外,还可见3570.05 cm−1对应的OH−振动峰。因此,对射频磁控溅射法制备的HA 涂层在大气条件下进行600℃下2 h的后处理,不仅可提高涂层的晶化程度,还利于晶格中OH−的恢复和稳定存在,促使HA 晶体结构完整。涂层中HA 结晶程度较高时其抗溶解性好,因而具有良好的化学稳定性[13]。
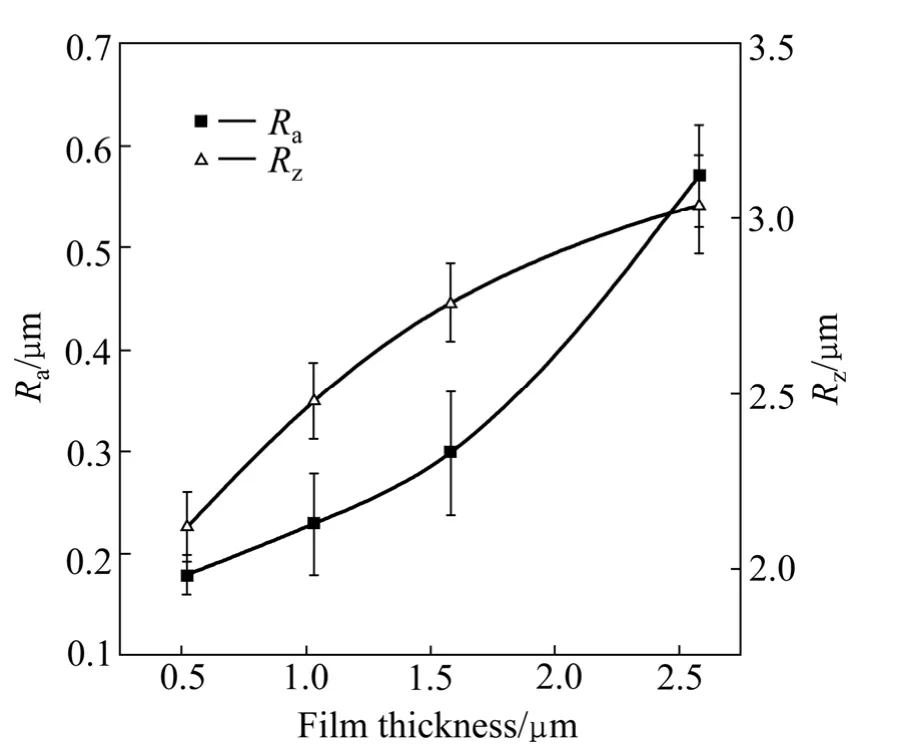
图2 涂层厚度与粗糙度的关系Fig.2 The relationships between roughness and thickness of HA coatings
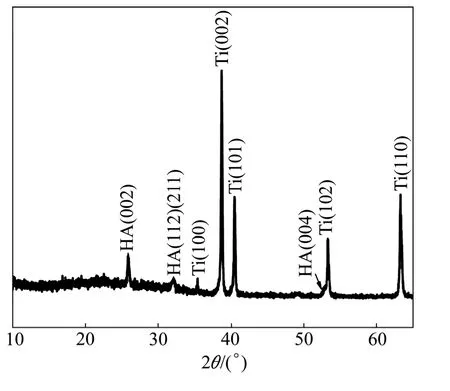
图3 HA 涂层的XRD谱Fig.3 XRD pattern of HA coating
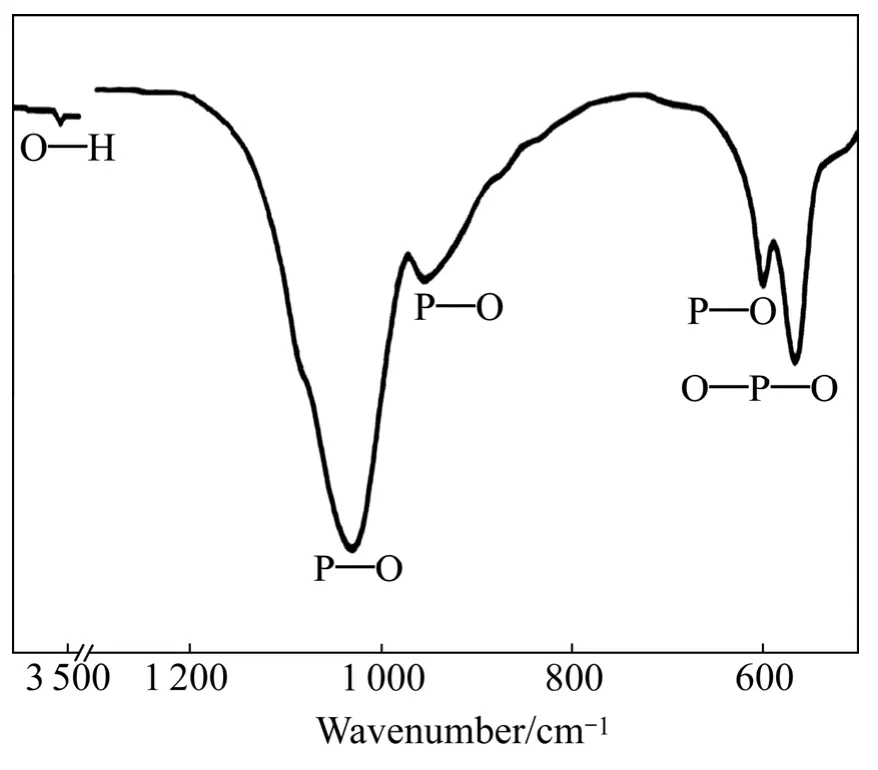
图4 HA 涂层的红外光谱Fig.4 IR analysis result of HA coating
2.3 HA 涂层的力学性能
纳米压痕法可测量材料的弹性模量和纳米硬度等力学性能。Oliver和Pharr[14]完善了深度测量压入法的测试原理,对于Berkovich 压头,涂层的纳米硬度(H)和弹性模量(E)可由下列公式联立求得:
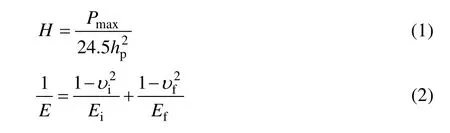
式中:Pmax为最大载荷;hp为压入深度;υi和Ei分别为压头的泊松比和弹性模量;υf和Ef分别为涂层的泊松比和弹性模量。
图5所示为不同厚度的HA 涂层的力学性能。可见厚度为1.0~1.6μm的涂层力学性能最好,其纳米硬度高于11 GPa,弹性模量高于136 GPa。

图5 HA 涂层的纳米硬度和弹性模量随涂层厚度的变化关系Fig.5 Nanohardness (H)and elastic modulus (E)of HA coatings as a function of the coating thickness
2.4 细胞相容性
图6所示为HA 涂层表面成骨细胞的SEM 形貌。成骨细胞在HA 涂层表面粘附并伸展生长,在涂层凹陷处(见图6(a)),成骨细胞呈圆形或椭圆形吸附于凹陷处,细长伪足伸向外侧;在相对平坦的涂层表面,细胞拉长,伪足吸附于涂层表面或深入涂层间隙(如图6(b)所示)。细胞伪足是细胞铺展和迁移等行为的基础[15],伪足形成说明涂层可为骨细胞的伸展生长提供必要的外部环境,利于新骨生成。
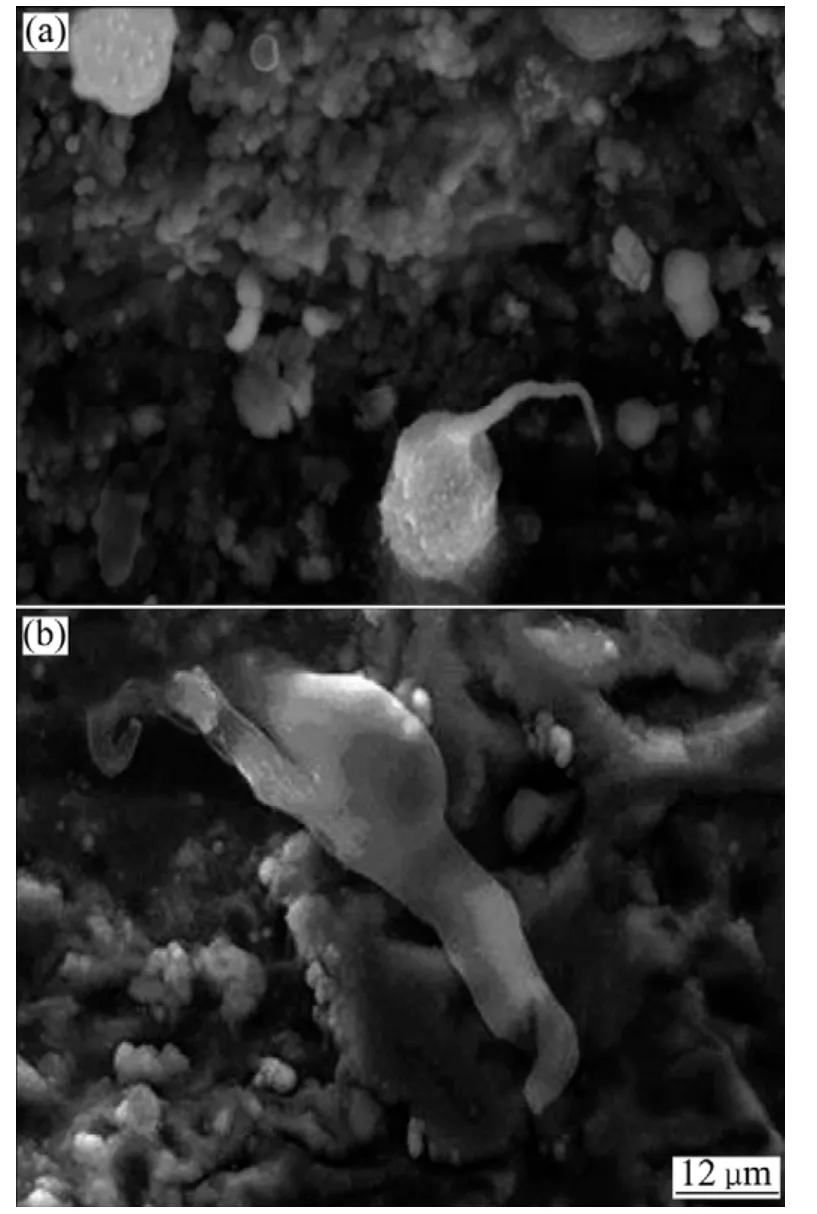
图6 HA 涂层表面成骨细胞的SEM 形貌Fig.6 The SEM photographs of osteoblasts on the surface of HA coating
图7所示为HA涂层材料对成骨细胞增殖的影响。细胞毒性实验结果显示,实验组和对照组中成骨细胞增殖随时间延长呈上升趋势,5、8、11 天后实验组的成骨细胞增殖显著优于对照组(P<0.05),说明HA的细胞相容性优于聚苯乙烯材质的细胞培养板。新生鼠成骨细胞部分保留了胚胎细胞分化表型,在骨组织工程研究中应用较多[16]。成骨细胞可分泌骨基质并使之矿化,成骨细胞本身被包围在矿化的骨基质中,形成骨细胞。可见成骨细胞在生物材料上是否有增殖活力,是影响骨整合的重要因素。本实验证实HA 涂层材料对成骨细胞没有细胞毒性,但机体内环境十分复杂,还须用体内实验来进一步验证。
2.5 植入实验
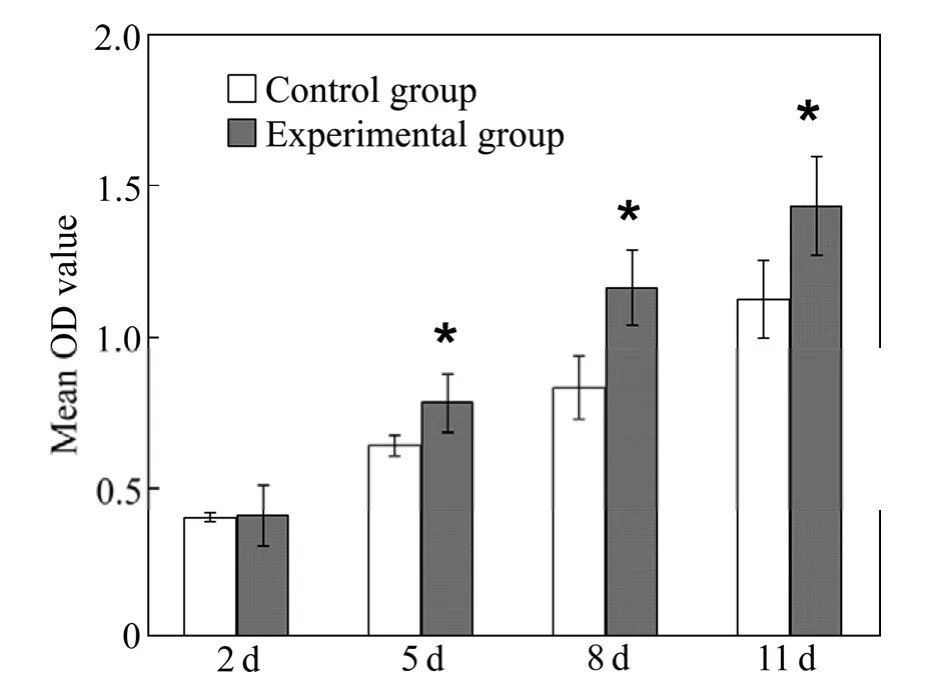
图7 HA 涂层材料对成骨细胞增殖的影响Fig.7 Effect of HA coating material on osteoblast proliferation (P<0.05)

图8 植入HA 涂层材料的组织学特征Fig.8 Histologic features of material surface implanted in HA/CS coating (Hematoxylin-eosin staining)
图8所示为HA 涂层材料植入犬体内4 周和12周后的组织学特征。可见HA 涂层材料植入4 周后,表面被新生的结缔组织覆盖,其颜色、结构与正常骨无明显差异,可见微血管形成,未见炎性细胞浸润。植入12 周后,在骨小梁中可见破骨细胞。破骨细胞与成骨细胞相互依赖、相互制约,共同完成骨的代谢活动。种植体表面出现破骨细胞,以形成利于成骨细胞骨生成活动的微环境[17];此外,破骨细胞介导植入体周围发生骨吸收,对于骨重建具有不可替代的作用,直接影响种植体成功或失败[18−19]。本研究采用的1.6μm 厚HA 涂层与Ti 基体的结合强度在植入前为(41.2±2.4)MPa,植入12 周后为(40.7±1.8)MPa,二者差异不大,说明HA 涂层在机体内有较好的稳定性。以射频磁控溅射法制备的HA 涂层与Ti 基体的结合强度高于等离子喷涂、电泳沉积等方法,能够满足植入需要。
3 结论
1)射频磁控溅射法制备的钛基HA生物涂层为粗糙的岛屿状结构,HA 平均粒径为(40±2)nm,对涂层进行600℃下2 h的后处理有利于HA中OH−恢复,并提高HA的结晶度。
2)厚度1.0~1.6μm的HA 涂层力学性能最好,其纳米硬度高于11 GPa,弹性模量高于136 GPa。
3)HA 涂层具有良好的细胞相容性,成骨细胞可粘附于HA 涂层表面,形成伪足铺展生长,促进细胞的增殖。
4)体内植入4 周后,材料表面被新生的结缔组织覆盖,血管形成;植入12 周后,骨小梁形成,其内部可见破骨细胞。植入前与植入12 周后相比,涂层与基底结合强度无显著变化。
[1]HACKING S A,TANZER M,HARVEY E J,et al.Relative contributions of chemistry and topography to the osseointegration of hydroxyapatite coatings [J].Clinical Orthopaedics and Related Research,2002,405(1):24−38.
[2]KALITA S J,BHARDWAJ A,BHATT H A.Nanocrystalline calcium phosphate ceramics in biomedical engineering [J].Materials Science Engineering:C,2007,27:441−449.
[3]SATO M,ASLANI A,SAMBITO MA,et al.Nanocrystalline hydroxyapatite/titania coatings on titanium improves osteoblast adhesion [J].Journal of Biomedical Materials Research Part A,2008,84(1):265−272.
[4]HADDOW D B,JAMES P F,VAN NOORT R.Characterization of sol-gel surfaces for biomedical applications [J].Journal of Materials Science:Materials in Medicine,1996,7(5):255−260.
[5]CHOU B Y,CHANG E.Plasma-sprayed hydroxyapatite coating on titanium alloy with ZrO2second phase and ZrO2intermediate layer [J].Surface and Coatings Technology,2002,153(1):84−92.
[6]MA J,LIANG C H,KONG L B,et al.Colloidal characterization and electrophoretic deposition of hydroxyapatite on titanium substrate [J].Journal of Materials Science:Materials in Medicine,2003,14(46):797−801.
[7]SCHRECKENBACH J P,MARX G,SCHLOTTING F,et al.Characterization of anodic spark-converted titanium surfaces for biomedical applications [J].Journal of Materials Science:Materials in Medicine,1999,10(8):453−457.
[8]YANG CY,WANG BC,CHANG E,et al.The influences of plasma spraying parameters on the characteristics of hydroxyapatite coatings:A quantitative study [J].Journal of Materials Science:Materials in Medicine,1995,6(5):249−257.
[9]陈民芳,刘技文,王玉红,等.射频磁控溅射TiO2/HA 复合生物膜的制备与表征[J].复合材料学报,2003,20(6):52−56.CHEN Min-fang,LIU Ji-wen,WANG Yu-hong,et al.Preparation and characterization of TiO2/HA bio-composite film by RF magnetron sputtering [J].Acta Materiae Compositae Sinica,2003,20(6):52−56.
[10]张 钊,赵玉涛,林东洋,等.射频磁控溅射技术制备羟基磷灰石生物涂层及其微结构[J].硅酸盐学报,2004,32(7):849−853.ZHANG Zhao,ZHAO Yu-tao,LIN Dong-yang,et al.Preparation and microstructure of hydroxy-apatite coatings deposited by radio frequency magnetron sputtering [J].Journal of the Chinese Ceramic Society,2004,32(7):849−853.
[11]KOTZAR G,FREAS M,ABEL P,et al.Evaluation of MEMS materials of construction for implantable medical devices [J].Biomaterials,2002,23:2737−2750.
[12]李晓峰,赵劲民,苏 伟,等.大鼠成骨细胞的原代培养和鉴定[J].中国组织工程研究与临床康复,2011,15(6):990−994.LI Xiao-feng,ZHAO Jin-min,SU Wei,et al.Primary culture and identification of rat osteoblasts [J].Journal of Clinical Rehabilitative Tissue Engineering Research,2011,15(6):990−994.
[13]TRANQUILLI P L,MEROLLI A,PALMACCI O,et al.Evaluation of different preparations of plasma-spray hydroxyapatite coating on titanium alloy and duplex stainless steel in the rabbit [J].Journal of Materials Science:Materials in Medicine,1994,5(6/7):345−349.
[14]OLIVER W C,PHARR G M.An improved technique for determining hardness and elastic-modulus using load and displacement sensing indentation experiments [J].Journal of Materials Research,1992,7(6):1564−1583.
[15]李建军,赵亚薄.细胞铺展动力学的研究进展[J].力学学报,2012,44(5):807−823.LI Jian-jun,ZHAO Ya-pu.Research progress on kinetics of cell spreading [J].Chinese Journal of Theoretical and Applied Mechanics,2012,44(5):807−823.
[16]GARCIA T,ROMAN-ROMAN S,JACKSON A,et al.Behavior of osteoblast,adipocyte,and myoblast markers in genome-wide expression analysis of mouse calvaria primary osteoblasts in vitro [J].Bone,2002,31(1):205− 211.
[17]KAWAHARA H,NAKAKIRA S,ITO M,et al.Electron microscopic investigation on the osteogenesis at titanium implant marrow interface under masticatory loading [J].Journal of Materials Science:Materials in Medicine,2006,17(8):717−726.
[18]MINKIN C,MARINHO V C.Role of the osteoclast at the bone-implant interface [J].Advances Dental Research,1999,13(1):49−56.
[19]MARTIN T J,SIMS NA.Osteoclast-derived activity in the coupling of bone formation to resorption [J].Trends in Molecular Medicine,2005,11(2):76−81.

