川楝素诱导K562细胞自噬性死亡的实验研究
王 进,卢忠心,何於娟
(1武汉市中心医院,武汉430014;2重庆医科大学临床检验诊断学教育部重点实验室)
川楝素是从楝科植物川楝子和苦楝皮中提取出的一种四环三萜类化合物,近年研究发现,川楝素具有抑制肿瘤细胞增殖的作用[1]。本实验室既往研究表明,川楝素在体外能有效诱导人白血病K562细胞和肝癌细胞凋亡[2,3];但对川楝素诱导人慢性髓系白血病K562细胞发生自噬的研究鲜有报道。自噬性细胞死亡[4]是凋亡以外的另一种程序性细胞死亡形式,即Ⅱ型程序性细胞死亡,自噬活性的变化与恶性肿瘤的发生、发展有关。2010年1月~2012年8月,我们对川楝素诱导K562细胞发生自噬的现象进行观察,并初步探讨川楝素诱导K562细胞自噬性死亡的作用及其机制。
1 材料与方法
1.1 材料 人慢性髓系白血病K562细胞株(中国科学院上海细胞生物学研究所);川楝素(纯度≥95%,上海卓康生物有限公司);RPMI-1640培养基(美国Gibco公司);胎牛血清(杭州四季青生物制品研究所);噻唑蓝(MTT)、3-MA(Sigma公司);即用型SABC免疫组化试剂盒、兔抗人Beclin1、微管相关蛋白1轻链3(LC3)-ⅡIgG多克隆抗体、盐酸二氨基联苯胺(DAB)显色试剂(武汉博士德生物工程有限公司)。
1.2 实验方法
1.2.1 细胞培养 人慢性髓系白血病K562细胞常规培养于含10%胎牛血清的RPMI-1640培养液(含青霉素100 U/mL、链霉素 100 μg/mL)中,置于37℃、相对湿度95%、5%CO2培养箱中培养,每2~3天传代1次,取对数生长期细胞进行实验,购买回来的细胞株在用于本实验时,最多传代15代以内。
1.2.2 MTT法检测细胞的增殖情况 将对数生长期的K562细胞配制成浓度为5×104/mL的细胞悬液,接种于96孔板,每孔加100 μL,加入不同浓度川楝素(终浓度分别为 10、30、50、70 nmol/L)。每组设5个平行孔,常规培养24、48、72、96 h后,每孔加入20 μL MTT溶液(5 mg/mL),置于温箱中孵育4 h后离心,小心移除上层液体,再加入150 μL DMSO充分溶解孔内紫色结晶。用酶标仪测定不同作用时间下细胞的吸光度(A492),实验重复5次,计算细胞增殖抑制率,并按中效方程计算IC50。细胞增殖抑制率=(1-A药物/A对照)×100%。IC50=e{lg最大剂量-[lg(最大剂量/相邻剂量)][阳性反应率之和-(3-最大阳性反应率-最小阳性反应率)/4]}。
1.2.3 光镜观察细胞的形态 离心收集经10、30、50 nmol/L川楝素作用72 h后的细胞,用PBS洗涤,涂片机甩片,瑞氏染色,光学显微镜下观察细胞形态变化。
1.2.4 透射电镜观察K562细胞超微结构改变设阴性对照组、川楝素组(30、50 nmol/L),川楝素作用72 h后,收集各组细胞,用 PBS洗涤,弃上清,2.5%戊二醛前固定,1%锇酸后固定,乙醇丙酮逐级脱水,环氧树脂包埋,超薄切片,醋酸双氧铀和枸橼酸铅双重染色后,透射电子显微镜下观察并成像。
1.2.5 免疫细胞化学法检测Beclin1、LC3-Ⅱ蛋白的表达 30、50 nmol/L川楝素分别处理K562细胞72 h,离心,PBS冲洗,配制成1×106/mL单细胞悬液,甩片,4%多聚甲醛固定,3%H2O2溶液中室温下浸泡15 min,滴加封闭血清,37℃孵育20 min,甩去多余液体,滴加相应一抗(1∶100),同时用PBS代替一抗作阴性对照,4℃过夜,按照SABC免疫组化染色试剂盒说明书操作,DAB显色,苏木精复染,脱水、透明、封固,显微镜下观察,以胞质和(或)胞膜有棕黄色颗粒为阳性。光镜下以放大400倍数选取一定视野摄像,将图片输入计算机,应用图像分析软件进行图像分析,Beclin1、LC3-Ⅱ染色的强弱代表组织中特定蛋白表达水平的高低。
1.3 统计学方法 采用SPSS13.0统计软件,数据用¯x±s表示,组间比较采用t检验。以P≤0.05为差异具有统计学意义。
2 结果
2.1 川楝素对K562细胞的增殖抑制作用 10、30、50、70 nmol/L川楝素分别作用 K562细胞后,K562细胞增殖被明显抑制。随着川楝素作用时间的延长,抑制作用逐渐增强,呈明显的剂量和时间依赖性,IC50(72 h)为50 nmol/L(图1)。
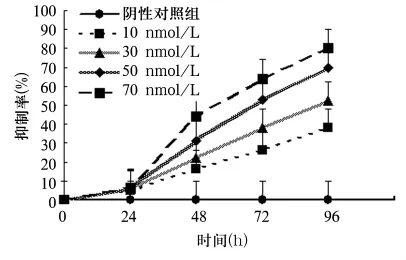
图1 川楝素对K562细胞增殖的影响
2.2 K562细胞形态学观察结果 阴性对照组K562细胞大小不一,呈圆形或椭圆形,染色质疏松,核仁清楚,胞质多见瘤状突起,K562细胞随着川楝素作用浓度的增大,细胞数量逐渐减少,形态发生明显变化,细胞质出现大量大小不等的空泡,50 nmol/L川楝素组K562细胞胞质内空泡尤为明显(图2)。2.3 川楝素对K562细胞超微结构的影响 阴性对照组K562细胞可见细胞器、细胞核和染色体形态分布正常(图3A),30 nmol/L川楝素组可见K562细胞核周围的胞质内形成大量的空泡,空泡内含有细胞质和线粒体等细胞器(图3D),50 nmol/L川楝素组胞质中可见自噬体,与溶酶体融合形成自噬溶酶体(图3E、F),随着川楝素作用浓度的增加,胞质内自噬泡数量明显增加,此超微结构明显区别于凋亡及死亡细胞,是较为典型的自噬性细胞死亡形态。

图2 K562细胞形态学变化(×600)
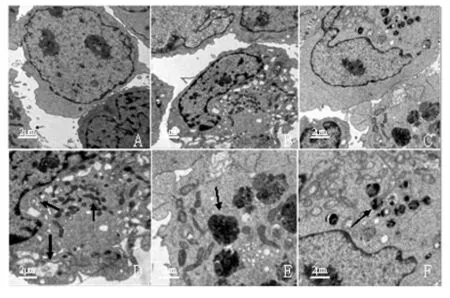
图3 透射电镜观察K562细胞超微结构
2.4 川楝素对K562细胞Beclin1、LC3-Ⅱ表达的影响 Beclin1、LC3-Ⅱ蛋白染色呈棕黄色颗粒,主要定位于细胞质,免疫细胞化学法检测显示,30、50 nmol/L川楝素处理 K562细胞 72 h后,Beclin1、LC3-Ⅱ蛋白表达较阴性对照组增强(图4)。
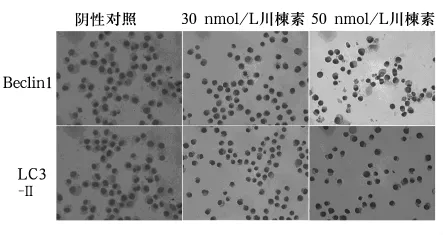
图4 K562细胞Beclin1、LC3-Ⅱ蛋白的表达(×400)
3 讨论
自噬是一个发生在真核细胞中由细胞初级溶酶体处理内源性底物的重要生理过程,生命体借此维持蛋白代谢平衡及细胞内环境的稳定[5]。近年来,自噬与肿瘤之间的关系成为了研究焦点[6]。大量研究显示,在一定条件下自噬对肿瘤细胞生长起到保护作用,而在某种情况下过度表达的自噬又会引发Ⅱ型程序性细胞死亡,即非凋亡形式的程序性细胞死亡[7]。川楝素是一种来源于天然植物的小分子化合物,具有广泛的抗癌效应[8,9],但机制尚不清楚。本研究以人慢性髓系白血病K562细胞为体外实验模型,观察川楝素作用后细胞形态学改变。倒置显微镜观察结果显示,胞质内可见大量大小不等空泡,随着川楝素浓度的增加,空泡逐渐增多。至目前为止,透射显微镜下超微结构的形态学检测被认为是检测自噬体的金标准。本文电镜结果显示,川楝素干扰的K562细胞内可见大量自噬体和自噬溶酶体,自噬活性的增高使细胞内大部分的胞质和细胞器被破坏,最终导致细胞死亡,因此形态学上证实川楝素诱导K562细胞自噬性死亡。
自噬的整个过程受基因调控,LC3和Beclin1基因均是参与自噬体形成的重要基因。LC3有LC3-Ⅰ和LC3-Ⅱ两种存在形式,LC3前体形成后,首先加工成胞质可溶性形式LC3-Ⅰ,并暴露出其羧基末端的甘氨酸残基;然后LC3-Ⅰ被Atg7活化、转移,并被修饰成膜结合形式LC3-Ⅱ,LC3-Ⅱ定位于自噬体膜上,是自噬体的标志分子,LC3-Ⅱ的含量与自噬体数量的多少呈正比[10]。Beclin1也称BECN1基因,是酵母ATG6的同系物,参与自噬调控的重要基因,其表达强度与自噬活性密切相关[11]。本研究发现,川楝素处理后,随着作用浓度的增加,LC3-Ⅱ和Beclin1蛋白表达逐渐增强,进一步说明川楝素诱导K562细胞自噬性死亡的作用机制可能与LC3-Ⅱ和Beclin1蛋白有关,从而激活自噬途径。目前,自噬性细胞死亡是许多抗肿瘤药物的作用机制之一,靶向自噬途径有可能成为治疗肿瘤的新方法[12,13]。前期实验证实,川楝素能诱导K562细胞发生凋亡,其自噬与凋亡的关系有待进一步的研究,为川楝素的开发提供有利的理论依据。
[1]Li M,Shi Y.Toosendanin interferes with pore formation of botulinum toxin type A in PC12 cell membrane[J].Acta Pharmacol Sin,2006,27(1):66-70.
[2]王进,刘小玲,王鹏.川楝素对K562细胞增殖和凋亡作用的影响[J].第四军医大学学报,2009,30(22):1572-1576.
[3]王鹏,王进,姜惠.川楝素通过线粒体途径诱导人肝癌细胞凋亡[J].中国中西医结合杂志,2011,31(2):232-236.
[4]Glick D,Barth S,Macleod KF.Autophagy as a target for cancer therapy:new developments[J].Cancer Manag Res,2012,4:357-365.
[5]Danielle G,Sandra B,Kay F,et al.Autophagy:cellular and molecular mechanisms[J].J Pathol,2010,221(1):3-12.
[6]Townsend KN,Hughson LR,Schlie K,et al.Autophagy inhibition in cancer therapy:metabolic considerations for antitumor immunity[J].Immunol Rev,2012,249(1):176-194.
[7]Kessel DH,Price M,Reiners JJ Jr,et al.ATG7 deficiency suppresses apoptosis and cell death induced by lysosomal photodamage[J].Autophagy,2012,8(9):1333-1341.
[8]施玉梁,王文萍.驱蛔中药的活性成分川楝素的生物效应[J].生理学报,2006,58(5):97-406.
[9]He Y,Wang J,Liu X,et al.Toosendanin inhibits hepatocellular carcinoma cells by inducing mitochondria-dependent apoptosis[J].Planta Med,2010,76(13):1447-1453.
[10]Chen G,Ke Z,Xu M,et al.Autophagy is a protective response to ethanol neurotoxicity[J].Autophagy,2012,8(11):145-157.
[11]Chang SH,Minai-Tehrani A,Shin JY,et al.Beclin1-induced autophagy abrogates radioresistance of lung cancer cells by suppressing osteopontin[J].J Radiat Res,2012,53(3):422-432.
[12] Dimitrakis P,Romay-Ogando MI,Timolati F,et al.Effects of doxorubicin cancer therapy on autophagy and the ubiquitin-proteasome system in long-term cultured adult rat cardiomyocytes[J].Cell Tissue Res,2012,350(2):361-372.
[13]龙璐璐,许文林,沈慧玲.YB-1抑制三氧化二砷诱导的胃癌细胞自噬机制[J].山东医药,2012,52(13):4-6.

