体外循环前空氧混合通气对紫绀型先天性心脏病患儿术后肺功能的影响
(江西省儿童医院,南昌330006)
肺损伤是心脏直视手术后常见的并发症,体外循环(CPB)导致的肺缺血—再灌注损伤和CPB触发的全身炎症是主要原因之一[1]。紫绀型先天性心脏病患儿手术后更容易出现。麻醉中在气管插管后常常采用纯氧通气,以便尽可能地提高机体的氧分压,逆转全身的缺氧状态,但忽然增加的氧分压会对机体造成氧自由基介导的再氧合损伤[2],从而加重肺缺血—再灌注损伤。本研究探讨了CPB前空氧混合通气对紫绀型先心病患儿肺功能的影响。现报告如下。
1 资料与方法
1.1 临床资料 2010年10月~2011年6月在我院进行手术治疗的紫绀型先天性心脏病患儿40例。入选标准:术前肺部无炎症;无贫血或输血,术前未用过激素、维生素C、维生素E及钙离子通道阻滞剂;非急诊手术;临床症状稳定,无缺氧发作;术前非呼吸机支持的患儿。将患儿随机分为P、M组各20例,P 组男15 例、女 5 例,年龄(7.8 ±3.0)个月,体质量(7.6 ±1.8)kg。术前 PO2(42.6.±11.7)mm-Hg,CPB 时间(105.4 ±25.8)min,主动脉阻断时间(48.9±9.8)min;法洛四联征11例,右室双出口3例,完全性肺静脉异位引流6例。M组男16例、女4 例,年龄(8.4 ±2.9)个月,体质量(7.4 ±1.7)kg,术前 PO2(45.6 ±9.4)mmHg,CPB 时间(107.5 ±28.9)min,主动脉阻断时间(49.6 ±10.4)min;法洛四联征16例,完全性肺静脉异位引流3例,肺动脉瓣闭锁1例。两组在年龄、体质量、术前PO2、CPB时间及主动脉阻断时间方面均无统计学差异(P均>0.05)。
1.2 方法
1.2.1 麻醉及治疗方法 所有患儿采取气管插管全麻。入室后予以咪唑安定0.1 mg/kg,舒芬太尼2 μg/kg,维库溴胺0.1 mg/kg静脉诱导后行气管插管,成功后接Drager麻醉机进行机械通气,容量控制模式,术中潮气量10 mL/kg,呼吸频率25~35次/min。P组从诱导到 CPB开始前吸入氧浓度(FIO2)为100%,M组FIO2则控制在40%。术中静脉泵入舒芬太尼1.5~2.5 μg/(kg·h),维库溴铵80μg/(kg·h),必要时吸入七氟醚维持麻醉。体外转流均采用膜肺,中度低温(25~28℃),小剂量预充,预充静脉液胶体主要由浓缩红细胞及白蛋白组成,预冲液采用21%氧气氧合循环,PO2100~150 mmHg,CPB 5~10 min后改为30% ~60%氧气进行CPB,灌注流量全量约150~180 mL/(kg·min);CPB后平行循环阶段使用常规超滤以及停CPB后使用改良超滤。腔静脉开放后两组患儿恢复通气,采用相同呼吸参数和FIO2,直至拔管。
1.2.2 检测方法 分别在诱导前(T1),CPB前(T2),CPB后2 h(T3)、6 h(T4)记录各项呼吸指标即FIO2、气道峰压等,测动脉血气;并根据公式计算出氧合指数(OI=PaO2/FIO2)、呼吸指数(RI=A-aDO2/PaO2),肺泡—动脉血氧分压差(A-aDO2)=(PB-PH2O)×FiO2-PaCO2/R -PaO2,PaO2为动脉血氧分压,PB为大气压,PH2O为37℃水蒸气压,PaCO2为肺二氧化碳分压,R为呼吸商;同时经中心静脉抽血进行离心(1 500 r/min),血清置于-20℃低温冰箱保存,采用化学法测定各时点的丙二醛(MDA)和过氧化物歧化酶(SOD)(试剂为南京建成生物制品研究所提供)。同时记录两组患儿术后机械通气时间、重症监护时间、术后住院时间及死亡例数等临床指标。
1.2.3 统计学方法 采用 SPSS18.0统计软件,计量资料以±s表示,组间均数比较采用重复测量方差检验,组内均数比较采用配对样本t检验。P≤0.05为差异有统计学意义。
2 结果
2.1 两组临床指标比较 两组患儿术后机械通气时间、重症监护时间、术后住院时间及死亡例数无统计学差异(P均>0.05)。见表1。
表1 两组临床指标比较(±s)
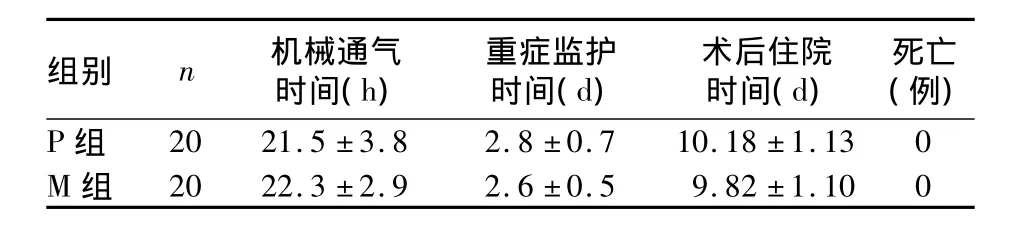
表1 两组临床指标比较(±s)
组别 n 机械通气时间(h)重症监护时间(d)术后住院时间(d)死亡(例)P组20 21.5 ±3.8 2.8 ±0.7 10.18 ±1.13 0 M组20 22.3 ±2.9 2.6 ±0.5 9.82 ±1.10 0
2.2 两组肺功能指标及MDA、SOD比较 见表2。两组患儿在T1时点各项肺功能指标比较无统计学差异(P均>0.05),但在T2、T3、T4时点P组气道峰压、RI较M组高,OI低于M组(P均<0.05)。T1时点两组MDA、SOD比较无统计学差异(P均>0.05),而在T3、T4时点两组血浆SOD活性均下降,MDA产生增加;且P组在T2时的SOD活性较T1也下降,MDA产生增加(P 均 <0.05);T2、T3、T4 时,与M 组比较,P组的MDA高、SOD低(P均<0.05)。
表2 两组肺功能指标、MDA、SOD比较(±s)
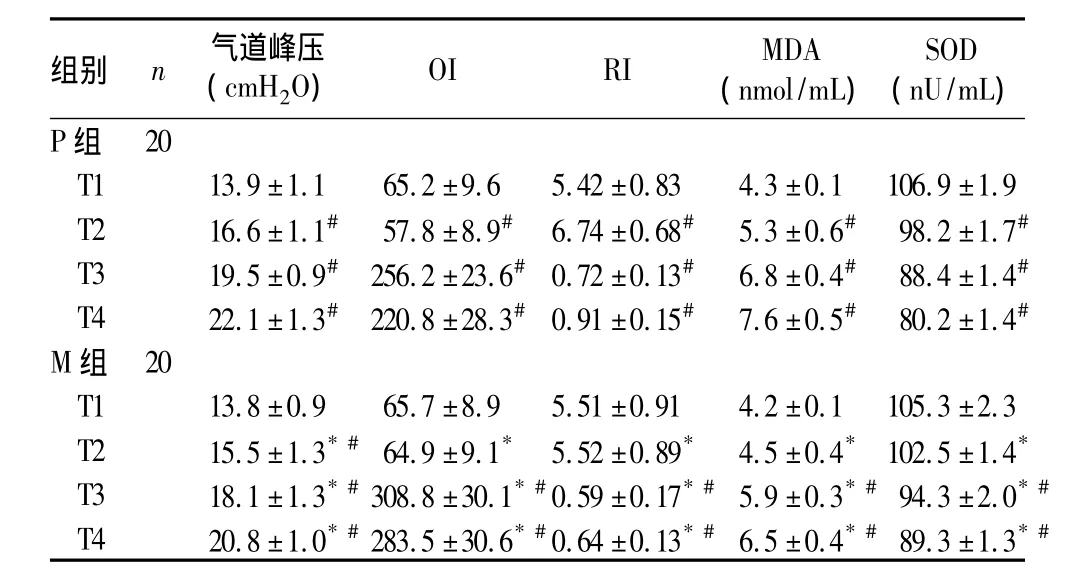
表2 两组肺功能指标、MDA、SOD比较(±s)
注:与P 组同时间比较,*P <0.05;与同组 T1比较,#P <0.05
组别 n 气道峰压(cmH2O) OI RI MDA(nmol/mL)SOD(nU/mL)P组20 T1 13.9 ±1.1 65.2 ±9.6 5.42 ±0.83 4.3 ±0.1 106.9 ±1.9 T2 16.6 ±1.1# 57.8 ±8.9# 6.74 ±0.68# 5.3 ±0.6# 98.2 ±1.7#T3 19.5 ±0.9# 256.2 ±23.6# 0.72 ±0.13# 6.8 ±0.4# 88.4 ±1.4#T4 22.1 ±1.3# 220.8 ±28.3# 0.91 ±0.15# 7.6 ±0.5# 80.2 ±1.4#M组 20 T1 13.8 ±0.9 65.7 ±8.9 5.51 ±0.91 4.2 ±0.1 105.3 ±2.3 T2 15.5 ±1.3*#64.9 ±9.1* 5.52 ±0.89* 4.5 ±0.4* 102.5 ±1.4*T3 18.1 ±1.3*#308.8 ±30.1*#0.59 ±0.17*#5.9 ±0.3*#94.3 ±2.0*#T4 20.8 ±1.0*#283.5 ±30.6*#0.64 ±0.13*#6.5 ±0.4*#89.3 ±1.3*#
3 讨论
紫绀型先天性心脏病患儿心脏直视手术后肺损伤是一个非常重要的临床问题,临床表现各异。其原因是多方面的,目前认为主要与以下因素有关:①CPB时肺无血流或低灌注造成肺缺血损伤及缺血后的再灌注损伤[3];②全身炎症反应导致的损伤[4]。
介导缺血再灌注损伤和全身炎症反应的重要因子是氧自由基。氧自由基可以通过以下机制参与肺损伤:①氧自由基作用于花生四烯酸,产生多种趋化因子,导致单核多形核白细胞激活,并在肺内聚集,释放许多弹性蛋白水解酶,加重肺损伤[5]。②氧自由基可促进花生四烯酸转变为前列腺素G2,激活前列腺素的合成途径,抑制前列环索生成,加速血栓素A2(TXA2)生成。大量的TXA2引起强烈的血小板聚集作用,造成肺微血管微血栓的形成;它还可通过收缩肺血管引起肺动脉高压,增加肺微血管的通透性,促进液体外渗,影响肺换气[6]。③氧自由基可通过对生物膜的多不饱和脂肪酸的氧化作用,破坏细胞膜及细胞器膜,使肺泡上皮和毛细血管内皮通透性增加,引起渗透性肺水肿[7]。
大量研究发现,氧自由基的产生与机体通气时的氧浓度有关。紫绀型先天性心脏病患儿在术中更易遭受氧自由基的损伤,因为紫绀型先天性心脏病患儿术前均存在不同程度的慢性缺氧,降低了机体抗氧化的储备能力和内源性超氧化物歧化物、过氧化物歧化物及谷胱甘肽的水平[8],使得机体对缺氧复氧更敏感。在术中如果氧浓度较高,机体暴露在突然升高的氧张力下,会激活白细胞,尤其是中性粒细胞,导致在抗氧化能力有限的机体中产生大量的氧自由基。而缺氧的组织又无法将其及时清除,从而造成了氧自由基介导的肺损伤,而且氧自由基的产生和肺损伤的程度和患儿自身的氧分压和再给氧后的氧分压差呈正比。
MDA是脂质过氧化的分解产物,血中MDA含量的变化反映了组织中氧自由基含量的变化[9];SOD可介导机体内源性抗氧化机制,是机体清除自由基的主要酶,SOD活性高低间接反映组织清除自由基的能力;所以通过测定MDA和SOD可以反映机体氧自由基的产生情况。RI和OI是准确反映肺功能状态的重要指标,主要受通气/血流比、肺弥散功能及通气状况的影响,其变化与肺功能的状态明显相关。
本研究中,麻醉前患者无输血和贫血,术前未用过激素、维生素C、维生素E及钙离子通道阻滞剂,排除了药物对氧自由基的影响。肺功能的各项指标显示,P组较 M组在T2、T3、T4时的气道峰压、OI低,RI增高,即P组肺损伤较M组严重;而SOD的消耗及MDA的产生P组较M组增多,即氧自由基的产生较多。这就说明P组因为通气时氧浓度较高,增加了机体与诱导前的氧分压差,导致机体产生了更多的氧自由基,从而加重了脏器的再灌注损伤和全身炎症反应,加重了肺损伤。因此,对紫绀型先天性心脏病患儿在CPB前通过吸入空氧混合气体降低FIO2,可以缩小机体与术前的氧分压差[9],减少氧自由基的产生,有利于术后肺功能的恢复。但两组患儿术后的临床指标比较差异无统计学意义,原因可能是患儿术中的肺损伤是多因素所致的,必须综合多种措施才可以使临床指标产生差异。
综上所述,紫绀型先天性心脏病患儿CPB前空氧混合通气可以减轻术后的肺损伤。
[1]Banz Y,Rieben R,Zobrist C,et al.Addition of dextran sulfate to blood cardioplegia attenuates reperfusion injury in a porcinemodel of cardiopulmonary bypass[J].Eur J Cardiothorac Surg,2008,34(3):653-660.
[2]Allen BS.The reoxygenation injury:is it clinically important[J].J Thorac Cardiovasc Surg,2002,124(1):16-19.
[3]Ranucci M,Balduini A,Ditta A,etal.A systematic review of biocompatible cardiopulmonary bypass circuits and clinical outcome[J].Ann Thorac Surg,2009,87(4):1311-1319.
[4]Apostolakis EE,Koletsis EN,Baikoussis NG,et al.Strategies to prevent intraoperative lung injury during cardiopulmonary bypass[J].JCardiothorac Surg,2010,5:1.
[5]Ware LB,Koyama T,Billheimer DD,et al.Prognostic and pathogenetic value of combining clinical and biochemical indices in patients with acute lung injury[J].Chest,2010,137(2):288-296.
[6]Friedman M,Wang SY,Sellke FW,et al.Pulmonary injury after total or partial cardiopulmonary bypass with thromboxane synthesis inhibition[J].Ann Thorac Surg,1995,59(3):598-603.
[7]Pizov R,Weiss YG,Oppenheim-Eden A,et al.High oxygen concentration exacerbates cardiopulmonary bypass-induced lung injury[J].JCardiothorac Vasc Anesth,2000,14(5):519-523.
[8]晏馥霞,李立环.小儿心脏麻醉学[M].4版.北京:人民卫生出版社,2008:215.
[9]杨辉剑,连环,田相亭,等.血浆丙二醛和高敏C-反应蛋白与急性心肌梗死的相关性研究[J].现代医院,2011,11(7):35-37.
[10]章征兵,明腾,谢维炎,等.体外循环前空氧混合通气在紫绀型先天性心脏病患儿术中应用的意义[J].实用医学杂志,2012,28(9):1475.

