血液透析联合血液灌流治疗慢性肾衰竭高磷血症的临床研究
井国兰
(泰山医学院附属泰山医院,山东泰安 271000)
近年研究证实,血磷升高是维持性血液透析患 者的独立死亡危险因素[1]。目前高磷血症的主要治疗措施有低磷摄入、充分透析、使用磷结合剂以及必要时采用甲状旁腺切除加自体移植术。但这几种方法作用有限[2]。我院采用血液透析联合血液灌流的血液净化方式控制血磷水平,疗效满意,现报道如下。
1 资料与方法
1.1 临床资料选择2009年1月~2013年1月在我院门诊维持性血液透析治疗的尿毒症患者90例,规律透析1年以上。男56例,女34例;平均年龄(46±27)岁;入选患者血磷水平均高于1.85 mmol/L,血磷水平为(2.4±0.5)mmol/L。伴有明显全身瘙痒及骨痛症状。原发病为慢性肾小球肾炎33例,糖尿病肾病17例;高血压肾病19例;痛风性肾病7例;狼疮性肾病7例,多囊肾7例。90例患者分为血液透析加血液灌流(HD+HP)组45例,单纯血液透析组(HD)45例,2组患者治疗前3个月均未服用磷结合剂。两组患者的年龄、性别、基础疾病、透析时间比较,差异均无统计学意义,具有可比性。
1.2 方法
两组患者均接受基础治疗,包括低磷饮食,服用碳酸钙及应用促红细胞生成素及降压治疗。所有病人均建立动静脉内瘘或颈内静脉置管作为血管通路。使用碳酸氢盐透析粉,透析液含钙量(1.5±0.2)mmol/L。HD+HP组治疗程序:使用 Fresenius4008s血液透析机,F6空心纤维透析器,有效膜面积1.3 m2。选用HA130型一次性使用树脂灌流器,将灌流器串联在透析器之前,采用透析器与HA型树脂灌流器串联作透析-灌流治疗。血流速度(180~200)mL/min,肝素首剂量0.5 mg/kg静注,维持剂量5 mg/h。先血液灌流、透析2h后取下灌流器,再继续血透2 h,总共治疗时间为4 h。每周血透3次,联用血液灌流1次。治疗3个月,治疗前后测 BUN,Scr,K+,Na+,CL-,Ca2+,P3+,iPTH。观察治疗后的食欲、皮肤瘙痒、骨痛症状的改善情况。单纯HD组的条件及检测指标同HD+HP组,采用每周3次血液透析加灌流。
1.3 统计学方法
2 结果
HD+HP组和HD组经治疗3个月后,与高磷血症有关的相关症状,食欲改善36例(80%)和15例(33%),全身皮肤瘙痒消失或减轻29例(63%)和6例(13%),骨痛消失或减轻分别为23例(51%)和9例(20%),HD+HP组临床症状较HD组改善明显。从表2可以看出,两组患者治疗后BUN、Scr较治疗前均明显下降,差异有统计学意义(P<0.05),但下降幅度无显著性差异(P>0.05)。HD+HP组血磷,iPTH明显下降,差异有统计学意义(P<0.05)。血钙无明显升高。HD组血磷iPTH无明显下降(P>0.05),血钙升高,差异有统计学意义(P<0.05)。
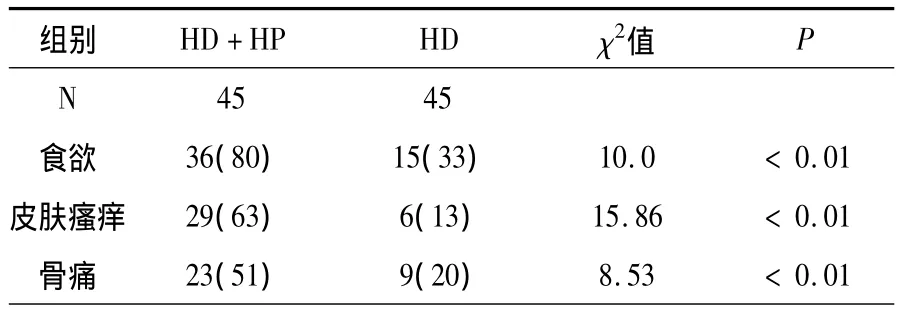
表1 两组临床表现改善情况比较
表2 两组患者治疗前后的肾功能及生化指标比较(±s)
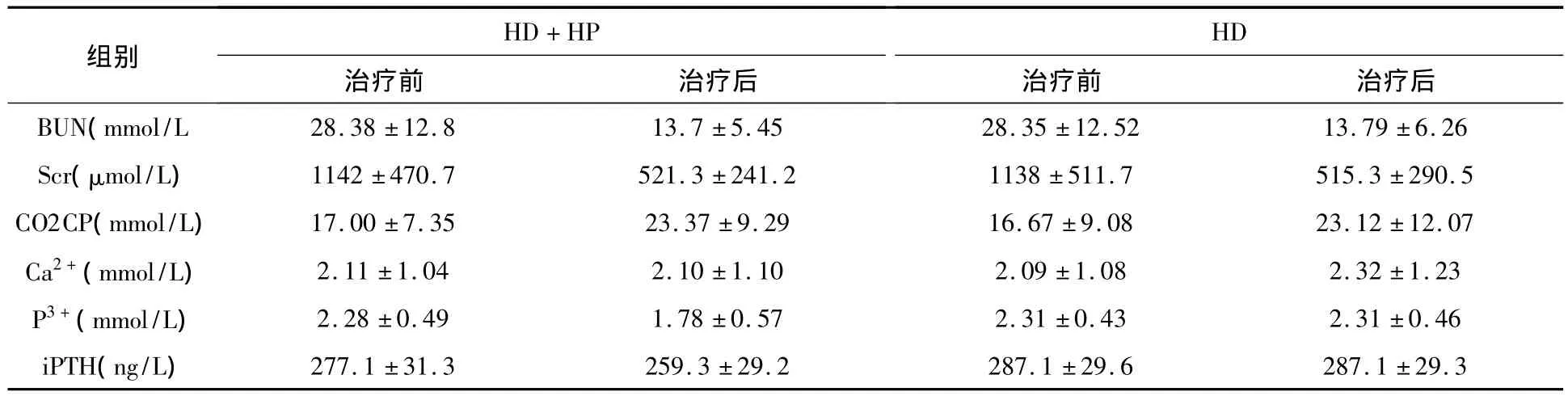
表2 两组患者治疗前后的肾功能及生化指标比较(±s)
HD+HP HD 79±6.26 Scr(μmol/L) 1142±470.7 521.3±241.2 1138±511.7 515.3±290.5 CO2CP(mmol/L) 17.00±7.35 23.37±9.29 16.67±9.08 23.12±12.07 Ca2+(mmol/L) 2.11±1.04 2.10±1.10 2.09±1.08 2.32±1.23 P3+(mmol/L) 2.28±0.49 1.78±0.57 2.31±0.43 2.31±0.46 iPTH(ng/L) 277.1±31.3 259.3±29.2 287.1±29.6 287.1±29.3治疗前 治疗后BUN(mmol/L 28.38±12.8 13.7±5.45 28.35±12.52 13.组别 治疗前 治疗后
3 讨论
慢性肾脏病(CKD)持续性血液透析患者常伴有高磷血症[3]。高血磷可刺激甲状旁腺分泌甲状旁腺激素,刺激甲状旁腺细胞增生,引起继发性甲状旁腺功能亢进,导致维生素D代谢障碍、肾性骨营养不良、加重肾性贫血等。近年更有研究发现高血磷使钙磷乘积增高,增加转移性钙化的发生,钙磷可沉积在心血管、肾等软组织,诱发冠状动脉、颈动脉及心脏瓣膜钙化等病变,成为终末期肾病患者心血管疾病发生率及死亡率增高的重要因素[4]。血磷每上升 0.32 mmol/L,相对死亡危险性增加6%[4]。所以,控制慢性肾衰竭患者高磷血症,是降低其死亡率的关键。然而,如何控制高磷血症仍然是一个难题。根据KDIGO(肾脏病改善全球预后)指南要求,CKD3-5期患者血磷应尽可能控制在正常范围。基础治疗包括:1) 通过饮食控制磷的摄入量是最基本的措施。每天控制在800~1000 mg,以减少肠道磷的吸收,但透析患者的蛋白质消耗过多,对蛋白质需求相对增加,严格饮食控制,会造成营养不良,通过限制磷的摄入量控制高血磷的效果有限[5]。2) 使用磷结合剂是目前临床上最主要的方法。含钙结合剂如碳酸钙可作为一线磷结合剂使用,但结合1 mmol/L磷需要2.02 mmol/L碳酸钙,剂量较大,约1/3患者可发生高钙血症。长期高钙血症会增加血管钙化几率,直接导致CKD患者病残率、死亡率增高,且不能使高磷血症得到理想长期控制[7]。3) 血液透析对磷的清除很有限。由于进入体内的磷对绝大多数存在于人体细胞内,磷从细胞内向细胞外转移慢,每次血液透析仅能清除800 mg磷。无论使用高通量透析膜还是低通透量透析膜,对血磷的清除没有明显差异[6]。每周3次,每次4 h的普通血液透析对血磷的清除不充分,延长透析或增加透析频率可增加血磷的清除,但患者很难接受长时间的透析。血液透析只允许分子量为1.5万以下的小分子和部分中分子通过,如尿素氮和肌酐、尿酸等。高通量透析器增加了中、大分子物质清除,但蛋白结合毒素清除率仍很低。而血液灌流器对中、大分子毒素及蛋白结合毒素清除作用明显,如β2微球蛋白、甲状旁腺素等这些多肽类中分子物质或细胞因子。本组资料表明,HD+HP组对尿素氮、肌酐清除与HD组比较无显著差异,对甲状旁腺素、血磷清除较HD组有显著差异,且全身瘙痒、骨痛症状改善较明显,说明HD+HP治疗慢性肾衰竭高磷血症患者有明显效果,且血钙不升高。其机制可能与HP吸附FGF-23,降低iPTH,降低血磷有关[8]。利用血液透析清除小分子毒素和水分,调节电解质和酸碱平衡,血液灌流吸附较大分子毒素和蛋白结合毒素的原理,我们采用血液透析和血液灌流两种血液净化方式结合,治疗高磷血症患者疗效满意,达到了预防患者近期和远期并发症,延长生命,提高生活质量的目的,值得临床推广使用。
[1] 韦苏宁.在血液透析中采用低分子肝素对慢性肾衰竭伴高磷血症患者磷代谢的影响[J].新医学,2007,38(2):87-88.
[2] 苗华,潘明明.慢性肾衰竭高磷血症研究及治疗进展[J].中国血液净化,2007,6(9):500-501.
[3] 卜磊,赵学智.慢性肾脏病高磷血症所致并发症的机制及防治进展[J].中华肾脏病杂志2010,26(4):316-317.
[4] Block GA,Port FK.Re-evaluation of risks associaed with hyperphosphafemia and hyperparathyroidism in dialysis patients:recommendations for a change in inanayement[J].Am Kidney Dis,2000,35:1226-1237.
[5] 杨国刚.慢性肾功能衰竭患者高磷血症研究及治疗进展[J].吉林医药学院学报,2010,31(2):102-103.
[6] Cannata-Andia JB,Rodriguez-Garcfa M.Hyperpho sphatamia as a cardiovas cular risk facfor-how to manage the problem[J].Nephrol Dialtransplant,2002,17(Suppl):16-19.
[7] 王世相,血液透析患者高磷血症的治疗进展[J].中国血液净化,2003,2(2):93.
[8] 宦红娣,张景仁.血液灌流对维持性血液透析患者高磷血症的影响[J].诊断学理论与实践,2011,10(3):221-222.

