自噬相关基因Beclin1和PTEN在子宫腺肌病中的表达及意义
杜 超
(1.泰山医学院,山东泰安 271012;2滕州市人民医院妇产科,山东滕州 277500)
子宫腺肌病(adenomyosis,AM)是指具有生长功能的子宫内膜腺体和间质向子宫肌层进行性浸润,并在其中弥漫性生长。虽属良性病变,却具有类似恶性肿瘤的种植、浸润及远处转移的生物学行为[1]。是妇科常见病之一,其典型的临床表现是月经失调、进行性痛经及不孕,严重影响女性患者的生活质量。目前子宫腺肌病的病因和发病机制尚不明确。近年来从程序性细胞死亡着手来研究该病已成国内外研究热点之一。
正常细胞处于增殖和死亡的平衡状态,一旦这种平衡状态被打破,将会引起细胞的无限制增殖,也就是永生现象。是肿瘤细胞常见的生长方式。程序性细胞死亡(Programmed Cell Death,PCD)是有机体在漫长的进化过程中发展起来的自杀机制,在清除无用的多余的或癌变的细胞,维持机体内环境稳态方面发挥着重要的作用。主要有两种形式:一种是凋亡(Apoptosis),另一种是自噬(Autophagy)。两者均是受相关基因控制的死亡程序。近年来从凋亡角度研究子宫腺肌病表明了子宫腺肌病的发生受到一些凋亡基因的调控。自噬不同于凋亡,是细胞在能量缺乏的状态下,通过降解细胞内多余或无效的成分获得营养而存活。两者在维持细胞内稳态方面共同起作用。细胞自噬相关基因Beclin1是真核生物参与细胞自噬的特异性基因,被称为与自噬有关的抑癌基因。Beclin1蛋白是自噬与凋亡重要的汇合点。Beclin1不仅能促进自噬,还能促进凋亡。PTEN是一种生长控制基因,属于抑癌基因的一种。也是继p53后发现的人类肿瘤中最常发生突变的抑癌基因。有报道表明,PTEN和多种恶性肿瘤的发生发展有着密切的联系,它通过多种方式(如表达缺失、基因突变等)参与恶性肿瘤的发生发展及预后。其突变发生率在子宫内膜癌最高[2]。
我们采用免疫组织化学方法检测子宫腺肌病患者在位内膜、异位内膜与正常子宫内膜、Beclin1、PTEN表达情况,以探讨Beclin1、PTEN在子宫腺肌病发生、发展中的作用以及相互间的关系。
1 材料与方法
1.1 研究对象
收集泰山医学院附属医院2011年12月至2012年12月因子宫腺肌病且排除内膜其他病变,行手术治疗的患者30例为实验组,取其30例患者在位及异位子宫内膜组织作为实验标本。其中子宫腺肌病在位子宫内膜增生期16例,分泌期14例;异位子宫内膜增生期17例,分泌期13例;并以同期因子宫肌瘤行手术治疗(术后经病理检查证实为子宫肌瘤)而切除的正常内膜32例作为对照组,其中子宫内膜增生期6例,分泌期14例。年龄分布在38~54岁,平均年龄(45.1±4.2)岁。所有患者月经周期大致规律。以上患者术前三个月内均未使用激素类避孕药具。排除合并其他神经系统疾病、内分泌疾病、免疫性疾病、肿瘤性疾病的患者。以上组织标本经4%甲醛固定,均制作成石蜡块。
1.2 免疫组化检测试剂与方法
兔抗人Beclin1单克隆抗体、兔抗人PTEN单克隆抗体(购自Cell Signaling公司),链霉素抗生物素蛋白-过氧化物酶(SP)试剂盒、DAB试剂盒(购自北京中杉金桥生物技术有限公司)。标本常规石蜡包埋,5μm连续切片,每例组织石蜡切片共4张,1张用于HE染色核实病理诊断,余3张行免疫组化染色。采用Power Vision法,用PBS液替代一抗作阴性对照,用已知人类子宫内膜癌组织标本作阳性对照。实验步骤严格按试剂盒说明书进行。
1.3 结果判断
切片均采用盲法由2位病理科医生独立阅片,Beclin1、PTEN染色阳性物质均呈棕黄色,主要表达于子宫内膜腺上皮和间质细胞的胞浆中。先在低倍镜观察整张切片,选择染色满意处随机观察10个高倍视野,每个视野计数100个细胞,根据阳性细胞比例和染色深度进行综合评定,染色强度分为:不染色(0);淡黄色(1);黄色(2)及棕黄色(3)。阳性百分数<5%(0分)、阳性百分数6% ~25%(l分)、阳性百分数26% ~50%(2分)、阳性百分数51% ~75%(3分)、阳性百分数>75%(4分)。依据总积分来判断免疫组化表达情况,总积分二阳性细胞比例评分+染色深度评分:0分为阴性(-);1~2分为弱阳性(+);3~4分为阳性(++);5~6分为强阳性(+++)。并将总评分≤2分划分为阴性,>2分划分为阳性。
1.4 统计学处理
采用SPSS13.0软件对实验数据进行分析。Beclin1和PTEN在子宫腺肌病异位病灶、在位内膜和正常子宫内膜阳性表达的比较采用χ2检验,两两比较用Bonferroni法校正。同一类型不同分期表达的比较采用Fisher’s检验。相关性分析采用Spearman等级相关。P<0.05为差异有统计学意义。
2 结果
2.1 Beclin1蛋白在异位、在位和正常子宫内膜的不同细胞中的表达:Beclin1蛋白在子宫内膜腺上皮细胞和间质细胞的胞浆中表达为主。在正常内膜、在位内膜、异位内膜中的阳性表达率分别为84.38%、50.00%、16.67%,呈逐渐下降趋势。经两两比较显示:在位内膜中Beclin1的阳性表达率低于正常内膜,差异有统计学意义(P<0.0167);异位内膜中Beclin1的表达低于在位内膜,两组间比较差异有统计学意义(P<0.0167);见表1。

表1 Beclin1蛋白在异位、在位和正常子宫内膜中的表达
Beclin1蛋白在正常子宫内膜增生期阳性表达率高于分泌期,且两者间差异有统计学意义(P<0.01)。Beclin1蛋白在在位内膜、异位内膜增生期与分泌期表达无统计学意义(P>0.05);见表2。
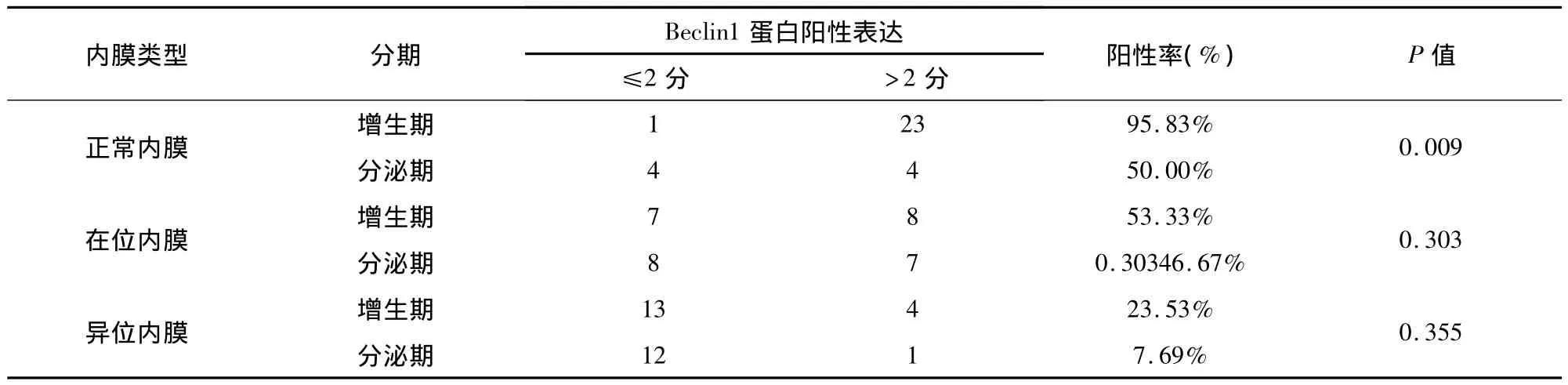
表2 Beclin1蛋白在实验组及对照组增生期及分泌期表达
2.2 PTEN蛋白在异位、在位和正常子宫内膜中的表达:PTEN在子宫内膜腺上皮细胞浆中表达为主。在正常内膜、在位内膜、异位内膜中的阳性表达率分别为84.38%,56.67%,26.67%,呈逐渐下降趋势,差异有统计学意义,见表3。经两两比较:PTEN蛋白在正常子宫内膜腺上皮细胞中表达高于异位内膜和在位内膜腺上皮细胞中表达(P<0.0167)。

表3 PTEN蛋白在异位、在位和正常子宫内膜中的表达
PTEN在正常子宫内膜增生期阳性表达低于分泌期,两者间差异无统计学意义(P>0.05)。PTEN在在位内膜、异位内膜增生期阳性表达率低于分泌期,两者间表达差异有统计学意义(P<0.05);见表4。
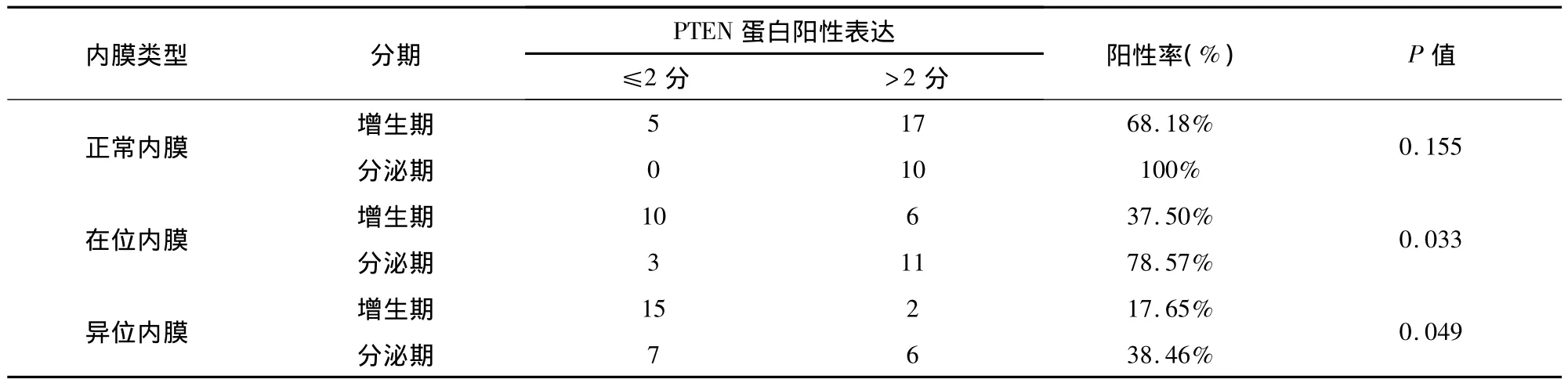
表4 PTEN蛋白在实验组及对照组增生期及分泌期表达
2.3 Beclin1和PTEN蛋白表达的相关性:将子宫腺肌病组织中Beclin1和PTEN表达按得分等级进行相关分析,rs=0.633,P=0.000,二者的表达呈正相关。
3 讨论
子宫腺肌病是妇科最常见的良性病,多发生于30~50岁的经产妇,发病率为8.8% ~31.0%[3]。近几年发病率有上升趋势,其典型的临床表现是月经失调、进行性痛经及不孕,严重影响女性患者的生活质量。Beclin1位于人类染色体17q21上,大约有150kb。Beclin1通过调节自噬活性而对肿瘤发生、发展起着重要作用。王赞宏等将自噬基因Beclin1真核表达质粒pcDNA3.1(+)-Beclin1经脂质体包裹后转染人宫颈癌HeLa细胞,发现pcDNA3.1(+)-Beclin1能使HeLa中Beclin1mRNA及蛋白表达增加(P<0.05),并显著抑制HeLa细胞的生长[4],提示自噬基因Beclinl与宫颈癌的发生、发展有关,可有效调控肿细胞周期,抑制宫颈癌细胞的恶性增殖,提高肿瘤细胞的自噬能力。据报道75%卵巢癌、50%乳腺癌以及40%前列腺癌中存在Beclin1基因的缺失性突变[5]。本研究发现Beclin1在正常子宫内膜中的表达率为81.25%,显著高于子宫腺肌病异位内膜组(16.67%),提示Beclin1蛋白表达缺失可能是子宫腺肌病发生的早期分子条件。从正常子宫内膜、在位内膜到异位内膜,Beclin1蛋白表达逐渐下降,说明Beclin1在子宫腺肌病的发生、发展中可能起着一定的作用。
PTEN基因是位于染色体10号q23.3区,它包含9个外显子和8个内含子,全长200kb。其特点是迄今发现的唯一具有脂质磷酸酶和蛋白磷酸酶双重磷酸酶活性的抑癌基因。该基因功能的缺失,被证明与多种恶性肿瘤的发生和进展有关系[6]。许多不同类型的肿瘤组织和肿瘤细胞系中都发现有PTEN突变。近年来,PTEN被提高到子宫内膜的“管家基因”的高度[7],在许多子宫内膜相关性疾病中PTEN的表达改变都具有特殊意义。PTEN基因是一种磷酸酶通过降低PI3K激酶的浓度,提高自体吞噬活性[8]。研究表明PTEN通过抑制TOR途径发挥促自噬的作用,PTEN的缺失表达也可能通过自噬活性的降低发挥肿瘤抑制的功能[9]。我们的结果显示PTEN蛋白表达从正常子宫内膜(84.38)、在位内膜(56.67%)到异位内膜(26.67%)逐渐下降,PTEN蛋白在这些内膜组织中表达的差异提示它可能在子宫腺肌病的发生过程中起了一定的作用。
迄今的研究表明Beclin1与PTEN可能共同参与调节自噬活性从而在子宫腺肌病的发生、发展中发挥作用。近年来子宫腺肌病的发病机制已有多方面研究,至今未能起决定性作用的因素还未确定。随着对分子生物学和程序性细胞死亡理论的进一步研究,子宫腺肌病与程序性细胞死亡的关系日益受到重视,尤其是对子宫内膜细胞自发性凋亡的研究。子宫腺肌病在位子宫内膜腺上皮细胞凋亡减弱及增殖能力增强可能导致子宫内膜组织内环境稳定的破坏,进一步削弱子宫内膜基底层的防御功能,致使过度增殖的子宫内膜组织突破薄弱的子宫内膜基底层向子宫肌层侵入并继续生长,因此,子宫内膜细胞凋亡、增殖失衡可能是子宫腺肌病的发病机理之一。抑制自噬可促进细胞的增殖、生长,自噬发挥抑制异常细胞增殖和抑癌作用[10,11]。磷酸肌醇-3-激酶(PI3K/AKT(PKB))途径是自噬调控的通路之一。I型与 III型 PI3K参与调控了细胞自噬过程。而PTEN通过负调节I型PI3K的活性从而诱导自噬;Ⅲ型PI3K是自噬空泡形成和空泡传送到溶酶体所必需的,Beclin1主要通过与Ⅲ型PI3K形成复合体来调节其他的Apg蛋白定位到自噬前体结构中,从而调节自噬活性[12]。因此,Beclin1与PTEN这两种肿瘤抑制因子可能分别在自噬体形成和信号调控水平对自噬进行调控[13]。本研究的结果发现从正常子宫内膜、在位内膜到异位内膜,Beclin1、PTEN蛋白的表达均逐渐下降,两者具有很好的相关性,提示Beclin1、PTEN可能相互作用共同参与了子宫腺肌病的发生、发展。总之,深入研究Beclin1、PTEN与自噬活性、子宫腺肌病的关系,对阐明子宫内膜癌的发生、发展机制并最终开发新的治疗手段提供理论依据。
[1] Cheng xin,WANG Hong yan,ZHOU Xiao.an You An in vestigation of the potential maling ant Characteristics of endometriosis[J].Chinese Journal of Clinical Oncology,2005,2(6):861-865.
[2] Maehama T,Dixon J E.The tumor suppressor,PTEN/MMACl,dephosphorytates the lipid second messager phosphatidylionosito 3,4,5-trisphosphate[J].J Biol chem,1998,273(22):13375-13378.
[3] MyersMP,Stolarov JP,Eng C,et al.PTEN the tumor suppressor from human chromosome 10q23,is a dual-specificity phosphatase[J].ProcNatlA cad SciUSA,1997,94(17):9052-9057.
[4] 王赞宏,段振玲,李莉.自噬基因 Beclin1抑制宫颈癌 HeLa细胞裸鼠移植瘤生长的研究[J].现代妇产科进展,2011,20(5):361-364.
[5] Aita V M,Liang X H,Murty V V,et al.Cloning and genomic organization of Beclin1,a candidate tumor suppressor gene on chromosome 17q21[J].Genomic,1999,59(1):59-65.
[6] 王索云,潘峻.PTEN基因对多发性骨髓瘤细胞增殖!凋亡和侵袭力的影响及其机制的研究:[博士学位论文].河北:河北医科大学,2010.
[7] Tang JM,He QY,Guo R X,et al.Phosphorylated Akt over-expression and loss of PTEN expression in non-small cell lung cancer confers poor prognosis[J].Lung Cancer,2006,51(2):181-191.
[8] YangZ,Klionsky DJ.An overview of the molecular mechanism of autoPhagy[J],CurrToP Microbial Immunol,2009,335:l-32.
[9] Li J,Yen C,LiawD,etal.PTEN,a Putative Protein tyrosine PhosPhatase gene mutated in Human brain,breast,and prostate cancer[J].Science,1997,275(5308):1943-1947.
[10] Ogier-Denis E,Codogno P.Autophagy:a barrier or an adaptive response to cancer[J].Biochim Biophys Acta,2003,1603(2):113-128.
[11] Gozuacik D,Kimchi A.Autophagy as a cell death and tumor suppressor mechanism[J].Oncogene,2004,23(16):2891-2906.
[12] Edinger A L,Thompson C B.Defective autophagy leads to cancer[J].Cancer Cell,2003,4(6):422-424.
[13] OGIER—DENISE,CODOGNO P.AutoPhagy:a barrier or an adaptive response to cancer.[J],Bioehim BioPhysAeta,2003,1603(2):113-128.

