SMARTer技术构建辣椒黄绿苗突变体叶片全长cDNA文库
马志虎, 孙国胜, 张昌伟, 杨玉霞, 潘跃平
(1.江苏丘陵地区镇江农业科学研究所,江苏 句容 212400;2.南京农业大学园艺学院,江苏 南京 210095)
叶色变异是植物中比较常见的突变类型,一般在苗期表达,但少数突变体直到生育后期才发生叶色突变[1-2]。作物叶色突变体不仅可以作为杂交育种中的形态学标记材料[3],还在光合作用机制、叶绿素生物合成途径、叶绿体的发育和遗传控制机理、以及分析鉴定功能基因等研究方面具有重要的利用价值[4-7]。芽黄(Yellow bud mutant)是指幼苗或者植株叶片在前期明显黄化,而后期叶绿素含量逐渐增加,以致黄化叶片完全变成绿色与正常绿色植株无异[8-9]。关于芽黄叶色标记的遗传规律及其实际应用,在番茄、棉花、向日葵、西瓜、黄瓜、玉米等作物上已有报道[1]。目前种子纯度鉴定以田间鉴定为主,缺乏快速有效的方法[10],芽黄突变体可在苗期作为标记性状剔除杂种,用于提高杂交种纯度,能够简化良种繁育[10]的步骤。
辣椒(Capsicum annuum L.)黄绿苗突变体(Mutant)属基因突变引起的芽黄突变体(Yellow bud mutant)类型,是马志虎等于1997年在由甘肃酒泉引进的辣椒品种96-140牛角辣椒中发现的叶色(幼嫩生长点为黄色)黄绿色隐性突变体材料[11]。利用该突变材料,先后选育辣椒新品种镇椒八号和辣椒黄绿苗胞质雄性不育系。本研究以辣椒黄绿苗突变体幼嫩叶片为材料,采用 Clontech公司的 In-Fusion®SMARTerTMDirectional cDNA Library Construction Kit试剂盒构建辣椒cDNA全长文库,为筛选辣椒叶色突变相关基因和探讨叶色突变分子机理奠定基础。
1 材料与方法
1.1 材料与试剂
以辣椒叶色黄绿色隐性突变体 YBM1106—2321作为试验材料(由镇江市农业科学研究所提供,辣椒黄绿苗突变体与本所辣椒材料H2321杂交转育而成,具有幼嫩生长点为黄色,新生平展叶片快速转绿特性的叶片黄绿色隐性突变体新材料)。In-Fusion®SMARTerTMDirectional cDNA Library Construction Kit和 AdvantageTM2 PCR Kit试剂盒购自Clontech公司,CTAB、琼脂糖以及其他常用试剂均购自Generay公司。
1.2 方法
1.2.1 改良CTAB法提取总RNA 采用王艳等[12]的改良CTAB法提取辣椒幼嫩真叶总RNA。
1.2.2 SMARTer技术构建全长cDNA文库 Firststrand cDNA和ds cDNA均采用LD-PCR技术,Firststrand cDNA反应体系如下。SMARTer cDNA合成:在 PCR 管中加入2.00 μl RNA,1.00 μl 3'In-Fusion SMARTer CDS Primer(12 μmol/L),1.50 μl ddH2O,混匀后72℃反应3 min,42℃反应2 min后,加入事先准备好的如下混合液:2.00 μl 5×First-strand buffer,0.25 μl DTT(100 mmol/L),1.00 μl dNTP mix(10 mmol/L),1.00 μl SMARTer V Oligonucleotide(12 μmol/L),0.25 μl RNase inhibitor,1.00 μl SMARTScribeTMreverse transcriptase(100 U),共计10.00 μl体系,涡旋混合后短暂离心,42℃保温90 min,然后68℃反应10 min,-20℃保存。
Ds cDNA反应体系:PCR管中加入2.00 μl Firststrand cDNA,80.00 μl ddH2O,10.00 μl 10 × Advantage 2 PCR buffer,2.00 μl 50 × dNTP mix(10 mmol/L),2.00 μl 5'PCR primer II A(12 μmol/L),2.00 μl 3'In-fusionSMARTerPCR primer(12 μmol/L),2.00 μl 50 ×Advantage 2 polymerase mix,反应体系为100.00 μl,2管。将反应物放入95℃预热的PCR仪里按如下参数反应:95℃ 1 min,95℃15 s,65℃30 s,68℃ 6 min。首先反应15个循环,将2个PCR管取出来放在4℃冰箱,其中一管取出25.00 μl,将25.00 μl放入PCR仪按照上述参数每反应3个循环取出5.00 μl,将反应 15、18、21、24、27 个循环的样品进行1.2%的琼脂糖凝胶电泳检测,确定最佳反应循环数。将剩余的170.00 μl样品平均分成两管,加入10.00 μl 1%的二甲苯青,-20℃保存。
Ds cDNA分级纯化:按照说明书要求,准备CHROMA SPIN+TE-1000柱和16个1.5ml离心管并做好标记,将柱子轻轻摇匀,把柱子下端掰掉,打开上面的盖子,让柱子里的缓冲液自然流出,流速40 ~60 s 1滴,1滴40.00 μl左右,若达不到上述要求则要重新装柱,直到满足条件。待储藏的缓冲液流尽以后,在柱子里加入700.00 μl柱缓冲液,待流干以后,将含有二甲苯青的ds cDNA加到柱子表面,静止片刻,用100.00 μl柱缓冲液洗含有cDNA的管子,等到液体自然流干以后,蓝色的二甲苯青会渗入柱子里面几毫米。向柱子里面加入600.00 μl柱缓冲液,开始收集流份,每个离心管1滴。每管取3.00 μl进行1.1%琼脂糖凝胶电泳,将最先出现条带的4~5部分合并。向合并的样品中加入1/10体积的醋酸钠(3 mol/L;pH 4.8),1.30 μl糖原,2.5倍体积-20℃预冷的95%乙醇,混匀后-20℃过夜,然后室温14 000 r/min离心20 min,去掉上清液后,加入600.00 μl 80%的乙醇,室温14 000 r/min离心5 min,去上清液,室温干燥10 min后用10.00 μl ddH2O溶解沉淀。
连接载体:连接反应按照说明书上的要求,共做3 个反应(表1),每个反应10.00 μl,50 ℃连接15 min后迅速置于冰上。每管反应液中加入90.00 μl TE和10.00 μl QuickClean松脂,涡旋1 min后离心一下,吸取上清液,加入1.20 μl糖原,混匀后加入280.00 μl 100%乙醇,前后摇晃混匀,-70℃沉淀过夜。然后15 000 r/min室温离心20 min,小心去除上层乙醇,室温干燥后,加入10.00 μl DEPC水溶解沉淀。

表1 cDNA与载体连接梯度体系Table 1 Reaction systems for ligating cDNA into vector
重组质粒的转化:在预冷的1 cm的电转杯中加入25.00 μl大肠杆菌感受态细胞 Electro-cells DH5α 和10.00 μl连接产物,1 500 V 电压下脉冲5.2 ms。电转产物子225 r/min、37℃培养1 h后取2.00 μl均匀涂抹到含有 100 μg/ml氨苄青霉素、1 mmol/L IPTG、75 μg/ml X-Gal的 LB 培养基上,37℃培养过夜,剩余的转化产物4℃下保存。
文库质量的检测:从培养过夜的平板中挑取24个白斑单克隆,分别培养在含有100 μg/ml氨苄青霉素的液体LB培养基中,37℃、225 r/min培养4 h,取菌液进行PCR检测。体系如下:14.40 μl ddH2O,0.40 μl Forward screening primer(10 μmol/L),0.40 μl Reverse screening primer(10 μmol/L),1.60 μl dNTP(10 mmol/L),2.00 μl 10 × PCR buffer,1.00 μl菌液,0.20 μl Taq 聚合酶,共 20.00 μl。反应条件为:94℃ 5 min,94℃ 30 s,55℃ 30 s,72℃ 2 min,共30个循环,72℃ 10 min,反应结束后取5.00 μl PCR产物进行1.2%琼脂糖凝胶电泳检测。
文库滴度的测定:取10.00 μl文库,加入1 ml LB培养基,取10.00 μl稀释100倍的文库,加入1 ml LB培养基。然后取10.00 μl稀释100倍的文库加入50.00 μl LB 培养基后涂板,取稀释 50.00 μl稀释10 000倍的文库涂板,培养过夜后计算文库滴度。
2 结果
2.1 辣椒叶片总RNA提取
提取RNA以后,进行1.2%琼脂糖凝胶电泳,结果(图1)显示:28S和18S条带亮度大约2∶1,说明RNA质量比较好。OD260/OD280值为1.98,说明RNA纯度较高,没有杂质污染,浓度为1 815.2 μg/ml,可以用于后续试验。
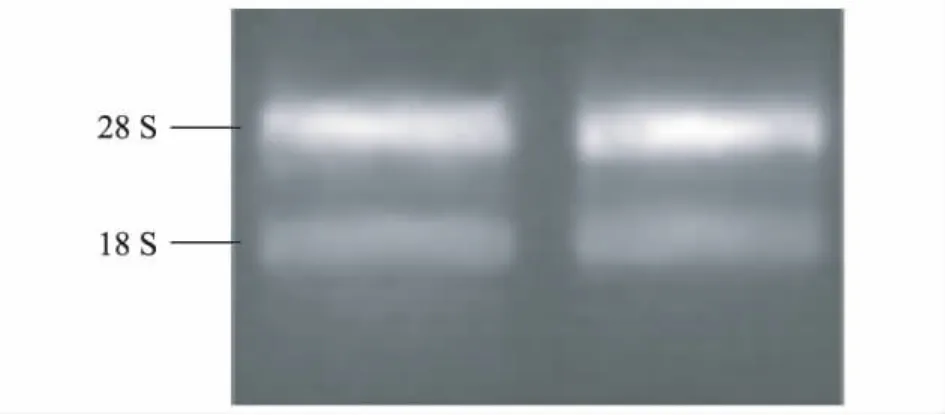
图1 辣椒叶片总RNA琼脂糖凝胶电泳图Fig.1 Agarose electrophoretogram of total RNA from the leaves of Capsicum annuum L.
2.2 辣椒叶片First-strand cDNA和ds cDNA合成
合成First-strand cDNA和 ds cDNA后,将15、18、21、24和27个循环后的ds cDNA进行1.2%琼脂糖凝胶电泳检测,结果(图2)显示:15、18个循环的条带亮度很低,21个循环的条带分布在2 000 bp左右,24和27个循环的产物片段过长,表明21个循环后的cDNA比较合适,符合文库构建要求。

图2 辣椒叶片双链cDNA琼脂糖凝胶电泳图Fig.2 Agarose electrophoretogram of double strand cDNA from the leaves of Capsicum annuum L.
2.3 辣椒叶片cDNA的分级纯化
过完柱子的cDNA进行1.1%琼脂糖凝胶电泳,结果(图3)显示:cDNA从第6管开始出现,故合并6~9个流份进行连接,将剩余的cDNA舍去。

图3 过完柱子的辣椒叶片cDNA琼脂糖凝胶电泳图Fig.3 Agarose electrophoretogram of double strand cDNA from the leaves of Capsicum annuum L.after size fractionation
2.4 辣椒cDNA文库质量鉴定
将3个连接反应的产物与载体连接后涂板,根据说明书要求测定各反应的滴度,结果显示,Ds cDNA反应体系的连接效果最好,滴度为1.76×106PFU/ml,cDNA 与载体比例为2.25∶1.00。挑取 24个单克隆进行PCR扩增后,结果(图4)显示:片段大小在500~2 000 bp之间,平均长度为1 170 bp,重组率为94%。
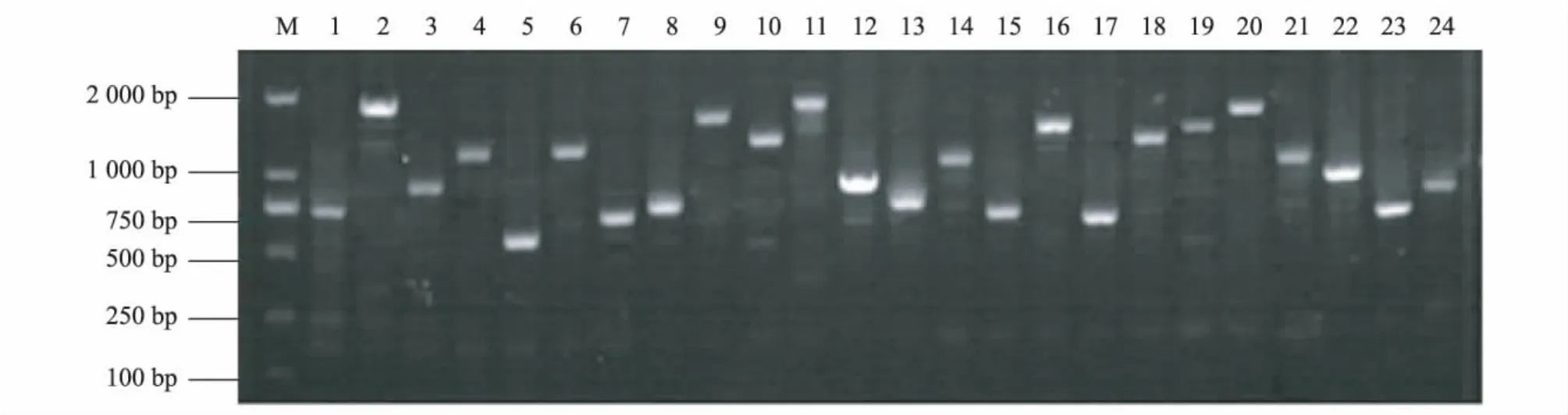
图4 辣椒叶片cDNA文库片段PCR检测Fig.4 PCR detection of cDNA library from the leaves of Capsicum annuum L.
3 讨论
Clontech公司的 SMART(Switching mechanism at 5'end of RNA template)技术是现在广泛应用的cDNA文库构建策略[13-14],本文应用最新的SMARTer技术进行cDNA文库构建,其优点是所需材料少,50 ng RNA就可以满足试验要求,方便快捷,效率高。SMARTer技术通过用SMARTer V Oligo对5'端加上特定的接头序列,引物在5'端与接头结合就能合成全长cDNA,大大提高了试验效率。此外,第一链和第二链cDNA合成都采用LD-PCR技术,起始RNA用量少,50 ng就能满足建库要求。本试验中,采用改良CTAB法提取RNA,克服辣椒叶片多糖、次生物质多[15]对RNA提取的影响,能够提取到高纯度、高完整性、高浓度的RNA,满足文库构建的要求。文库构建是在RNA水平上进行的,避免了纯化mRNA的步骤,能够避免纯化过程中RNA的降解以及mRNA的损耗,保证cDNA合成时能够获得全长cDNA。
SMARTer技术在cDNA与载体连接时,不需要进行酶切,可以直接与载体pSMART2IFD连接,避免在酶切回收时对cDNA的损失,大大提高了连接效率。设计3个连接反应,能够找到合适的片段与载体的比例。文库构建完成以后对文库质量的评估是通过文库滴度、插入片段的大小以及重组率来进行[16]。本试验构建的辣椒叶片cDNA文库的滴度为1.76 ×106PFU/ml,插入片段平均为1 170 bp,重组率94%,比较理想,能够满足后期试验对目的基因筛选的要求。
[1]何 冰,刘玲珑,张文伟,等.植物叶色突变体[J].植物生理学通讯,2006,42(1):1-9.
[2]李育红,王宝和,戴正元,等.水稻叶色突变体及其基因定位、克隆的研究进展[J].江苏农业科学,2011,39(2):34-39.
[3]ZHAO Y,WANG M L,ZHANG Y Z,et al.A chlorophyll-reduced seedling mutant in oilseed rape,Brassicanapus,for utilization in F1hybrid production[J].Plant Breed,2000,119(2):131-135.
[4]FAMBRINI M,CASTAGNA A,VECCHIA F D.Characterization of a pigment-deficient mutant of sunflower(Helianthus annuus L.)with abnormal chloroplast biogenesis,reduced PS II activity and low endogenous level of abscisic acid[J].Plant Sci,2004,167:79-89.
[5]HANSSON A,KANNANGARA C G,WETTSTEIN D,et al.Molecular basis for semidominance of missense mutations in the XANTHA-H(42-kDa)subunit of magnesium chelatase[J].Proc Natl Acad Sci USA,1999,96(4):1744-1749.
[6]LOPEZ-JUEZ E,JARVIS R P,TAKEUCHI A,et al.New Arabidopsis cue mutants suggest a close connection between plastid and phytochrome regulation of nuclear gene expression[J].Plant Physiol,1998,118:803-815.
[7]WU Z,ZHANG X,DIAO L,et al.A chlorophyll-deficient rice mutant with impaired chlorophyllide esterification in chlorophyll biosynthesis[J].Plant Physiol,2007,145:29-40.
[8]KILLOUGH D T,HORLACHER P N.The inheritance of virescent yellow and red plant colors in cotton[J].Genetics,1933,18:329-334.
[9]PALMER R G,MASCIA P N.Genetics and ultrastructure of a cytoplasmically inherited yellow mutant in soybeans[J].Genetics,1980,95:985-1000.
[10]马志虎,颜素芳,罗秀龙,等.辣椒黄绿苗突变体对良种繁育及纯度鉴定作用[J].北方园艺,2001,138(3):13-14.
[11]马志虎,颜素芳,胡志中,等.辣椒黄绿苗突变体生物学特性及生长动态研究[J].种子,2001(4):9-11.
[12]王 艳,孙国胜,王广东.花烛叶片总RNA提取方法的优化[J].基因组学与应用生物学,2011(30):1189-1193.
[13]ZHU Y Y,MACHLEDER E M,CHENCHIK A,et al.Reverse transcriptase template swtching:A SMART approach for full-length cDNA library construction [J].BioTechniques,2001,30(4):892-897.
[14]LU J P,LIU T B,YU X Y,et al.Representative appressorium stage cDNA library of magnaporthe grisea[J].Journal of Zhejiang University Science,2005,6(2):132-136.
[15]杨继涛,张素勤,耿广东,等.辣椒叶片总RNA提取与质量分析[J].西北农业学报,2009,18(6):217-220.
[16]SAMBROOK J,MANIATIS T,FRISTCH E F.Molecular cloning:A laboratorymanual[M].2nd.New York:Cold Spring Harbor Laboratory Press,1989.

