山猪3个候选基因的多态性与繁殖性状关联分析
徐小波, 陈 哲, 章熙霞, 袁咏刚, 王 秀, 邢光东, 方津津
(1.江苏省农业科学院畜牧研究所,江苏 南京 210014;2.南京市畜牧家禽科学研究所,江苏 南京 210036)
在养猪业中,繁殖性状具有重要经济价值,但繁殖性状的遗传力较低,传统的表型选择效果不理想,因此国内外学者纷纷转向寻找与繁殖性状关联的基因或者分子标记[1]。目前已经发现几十个猪繁殖相关数量性状位点(QTLs),如雌激素受体(ESR)基因[2]、催乳素受体(PRLR)基因[3]和促卵泡素 β 基因(FSHβ)[4]等,这些基因都不同程度地影响猪的产仔数、产活仔数以及初生质量等繁殖性状。
ESR、PRLR和 FSHβ基因在民猪、金华猪等地方猪种和长白、大白等国外猪种中都有报道,但尚未见在山猪中的报道。山猪是江苏省畜禽遗传资源保护品种,主要分布于宁镇扬等丘陵山区,具有瘦肉率高、肉质优良、产仔数多、体质好、抗病抗逆性强等优良特性。由于上世纪外来猪种的大力推广,山猪被人为弃养,目前纯种山猪数量较少,尽快挖掘山猪繁殖性状遗传优势并应用于育种工作,已经是迫在眉睫。本试验研究ESR、PRLR和FSHβ基因多态性对山猪繁殖性状的效应,以期为山猪的遗传资源保存和分子标记辅助选育提供依据。
1 材料与方法
1.1 试验猪群
试验猪为南京市畜牧家禽研究所试验猪场山猪育种核心群二胎以上经产母猪60头,所有种猪均有清晰的系谱和每窝产仔哺育记录,仔猪断奶时间为35 d。
1.2 试验方法
1.2.1 主要试剂 PCR扩增引物合成及DNA测序由英潍捷基(上海)贸易有限公司完成;DNA回收纯化试剂盒和小量质粒纯化试剂盒均购自天根生化科技有限公司;Premix Ex Taq聚合酶、pMD18-T Vector等均购自大连宝生物公司;限制性内切酶均购自北京NEB公司。
1.2.2 DNA提取 活体采样,用耳号钳取耳组织样约10 mg浸泡在装有70%乙醇的EP管内,-20℃冻存。采用苯酚法提取DNA。
1.2.3 引物设计 根据参考文献设计 ESR[5]、PRLR[6]和 FSHβ[4]基因多态位点引物(表 1)经去离子水溶解后,-20℃保存待用。
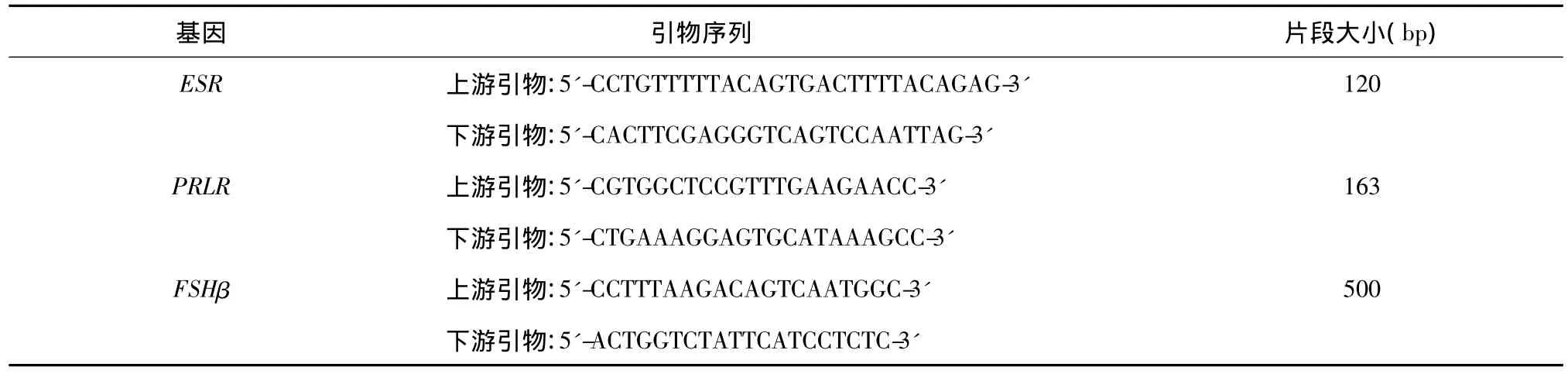
表1 候选基因引物序列Table 1 Primers designed for candidate genes
1.2.4 PCR扩增体系 PCR反应总体系25.0 μl,Premix Ex Taq 12.5 μl,上、下 游 引 物 (100 μmol/L)各 0.5 μl,模板 DNA 1.0 μl,加灭菌双蒸水至总反应体积25.0 μl。PCR扩增条件为:94℃预变性5 min;94℃变性 30 s,Tm复性30 s,72℃延伸30 s,35个循环;最后72℃延伸10 min。PCR产物经2%琼脂糖凝胶电泳检测后置于4℃保存。
1.2.5 酶切反应 除FSHβ基因扩增产物直接电泳外,ESR和PRLR基因扩增产物分别用PvuⅡ和AluⅠ限制性内切酶进行酶切。酶切反应体系:2.0 μl 10 ×NEB 缓冲液,0.2 μl 100 ×BSA,0.5 μl内切酶,PCR 产物 5.0 μl,加超纯水至 20.0 μl。酶切反应条件37℃,反应时间4~6 h。
1.3 统计分析
利用POPGENE1.32软件计算基因型和等位基因频率,并进行哈迪-温伯格平衡性检验。采用统计模型Y=μ+α+e分析基因型对性状的效应,其中Y为性状值,μ为总体平均数,α为基因型效应值,e为随机误差。
2 结果
2.1 ESR、PRLR和FSHβ基因在山猪中的基因型和等位基因频率
ESR基因PCR扩增产物片段长度120 bp,酶切后出现多态性(图1),出现120 bp条带的为AA型,出现65 bp和55 bp的为BB型,同时出现120 bp、65 bp和55 bp的为AB型。
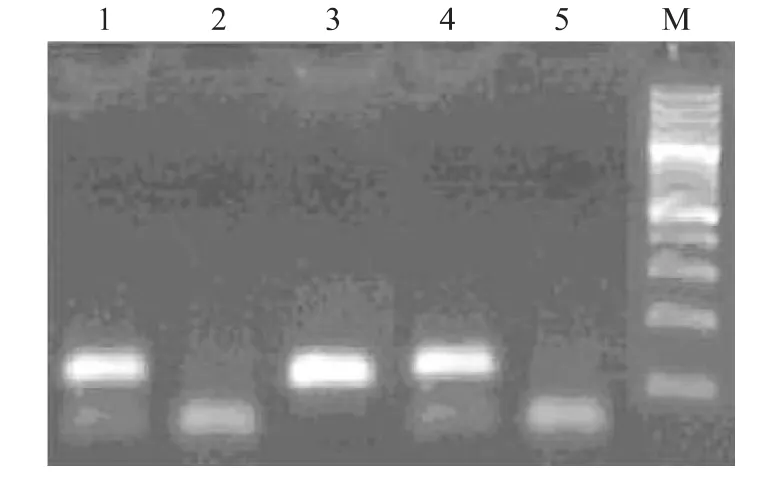
图1 山猪ESR基因PCR-RFLP检测Fig.1 PCR-RFLP of ESR gene in Shan pig
PRLR基因PCR产物长170 bp,AluⅠ酶切后出现多态性(图2),同时出现85 bp、59 bp和19 bp 3条条带的为AA型,出现104 bp和59 bp的为BB型,同时出现104 bp、85 bp、59 bp和19 bp 4条条带的为AB型。
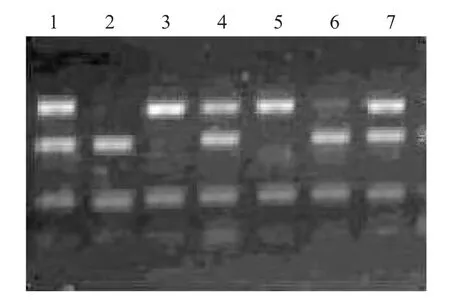
图2 山猪PRLR基因PCR-RFLP检测Fig.2 PCR-RFLP of PRLR gene in Shan pig
FSHβ基因是由于插入了一个长度为292 bp的逆转座子造成该基因位点的多态性,PCR产物只出现500 bp条带的为AA型,只出现220 bp的为BB型,同时出现500 bp和220 bp的AB型(图3)。
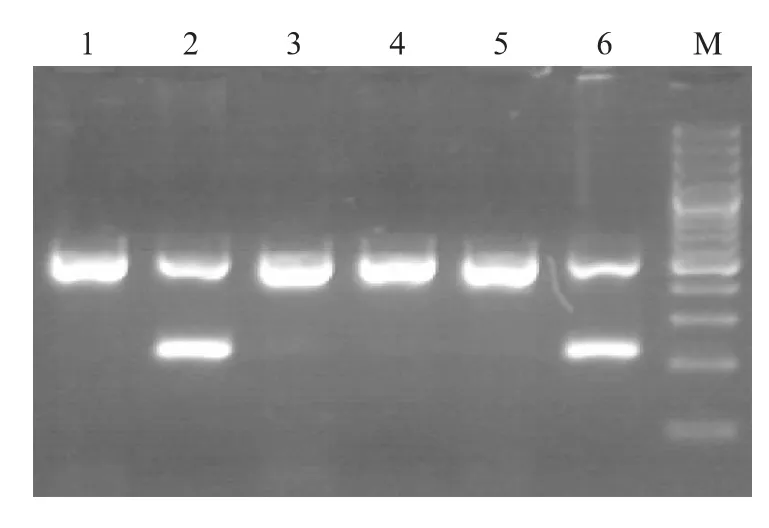
图3 山猪FSHβ基因PCR电泳检测Fig.3 PCR of FSHβ gene in Shan pig
山猪ESR、PRLR和FSHβ基因的基因型和基因频率分布见表2。经卡方测验,山猪群体内ESR各基因型分布不符合哈迪-温伯格平衡(P<0.05);PRLR各基因型的分布符合哈迪-温伯格平衡(P>0.05);FSHβ基因只发现AA型和AB型2种基因型,没发现BB型,其中AA基因型频率最高,为0.567,不符合哈迪-温伯格平衡(P<0.05)。ESR基因的A等位基因频率低于B等位基因频率,FSHβ和PRLR基因的A等位基因频率均高于B等位基因频率。
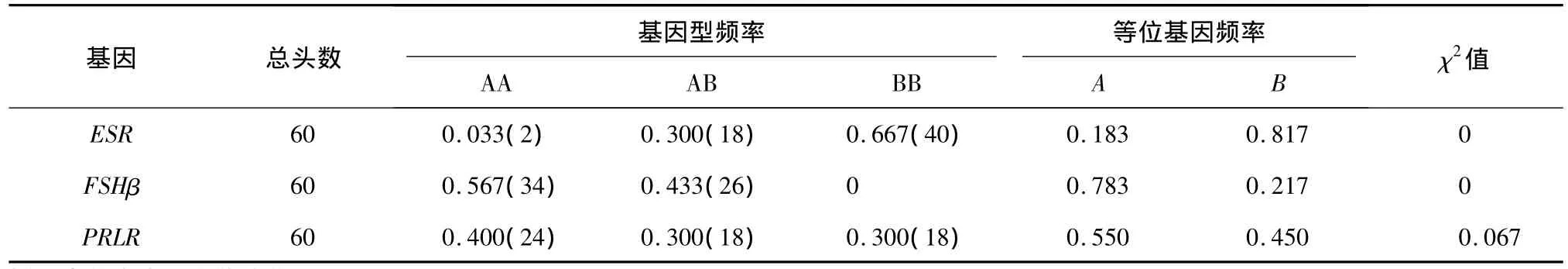
表2 ESR、PRLR和FSHβ基因的基因型频率和等位基因频率分布Table 2 Gene and genotype frequencies of ESR,PRLR and FSHβ genes in Shan pig
2.2 ESR、PRLR和FSHβ基因多态性与山猪产仔性能
分别统计ESR、PRLR和FSHβ基因各基因型头胎和二胎的总产仔数(TNB)和产活仔数(NBA)见表3。ESR基因BB型是产仔性能优势基因型,BB型个体的头胎及二胎的TNB和NBA均显著高于AB型(P<0.05)和AA型(P<0.01);AB型的头胎NBA显著高于 AA型(P<0.05),二胎的 TNB和NBA均显著高于AA型(P<0.01)。PRLR基因AA型为有利基因型,其效应为AA>AB>BB,AA型和AB型头胎和二胎的TNB和NBA均极显著高于BB型(P<0.01),AA型和AB型之间差异不显著(P>0.05)。FSHβ基因在山猪群体内只有AA型和AB型,AA型头胎TNB和NBA及二胎NBA均显著高于AB型(P<0.05),AA型二胎TNB极显著高于AB型(P<0.01)。
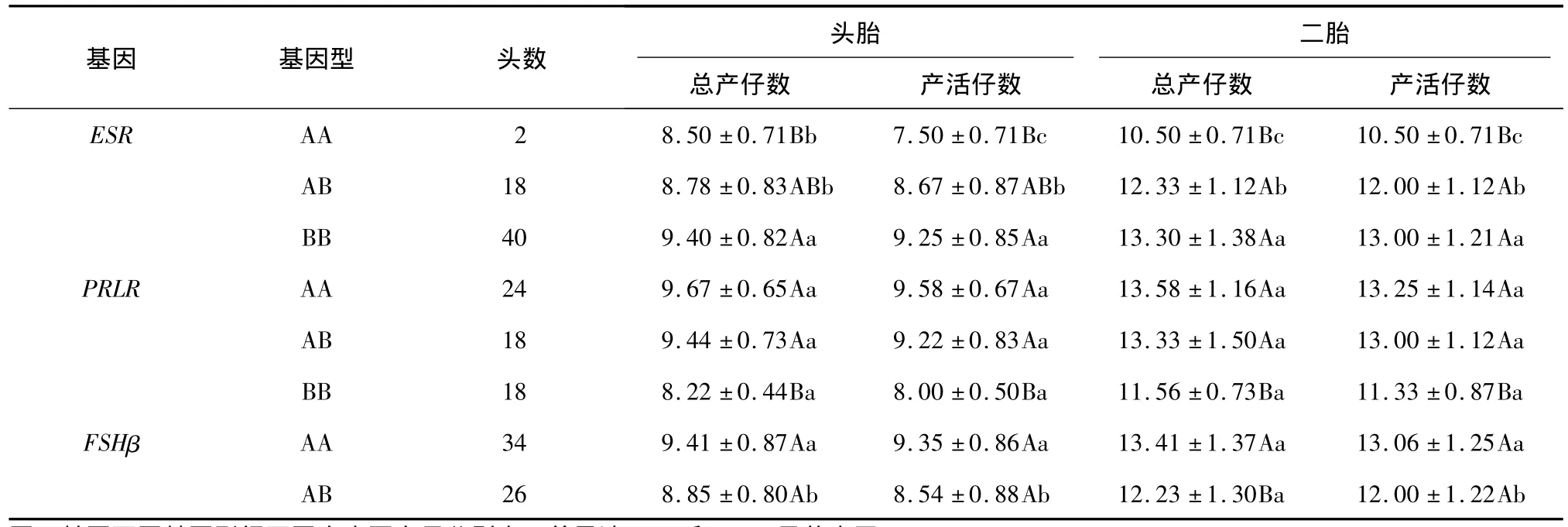
表3 ESR、PRLR和FSHβ基因不同基因型的总产仔数与产活仔数Table 3 Total number of born and number of born alive of pigs with different genotypes of ESR,PRLR and FSHβ genes
2.3 ESR、PRLR和FSHβ基因多态性与仔猪初生质量、断奶质量的关系
分别统计ESR、PRLR和FSHβ基因各基因型头胎和二胎产仔的初生质量(BW)和断奶质量(WW)见表4。可见,ESR基因AA型是仔猪体质量优势基因型,对BW性状,其效应排序为AA>BB>AB;对WW性状,其效应排序为AA>AB>BB;具体表现为AA型的头胎和二胎的BW均显著高于AB和BB型(P<0.05);AA型的头胎和二胎的WW显著高于BB型(P<0.05)。PRLR基因BB型为仔猪体重优势基因型,对BW和WW性状,其效应排序均为BB>AB>AA;其中BB型头胎和二胎仔猪的WW均显著高于 AA型(P<0.05),其余差异不显著(P>0.05)。FSHβ基因只有AA型和AB型,AB型头胎和二胎BW和WW均高于AA型(P>0.05)。
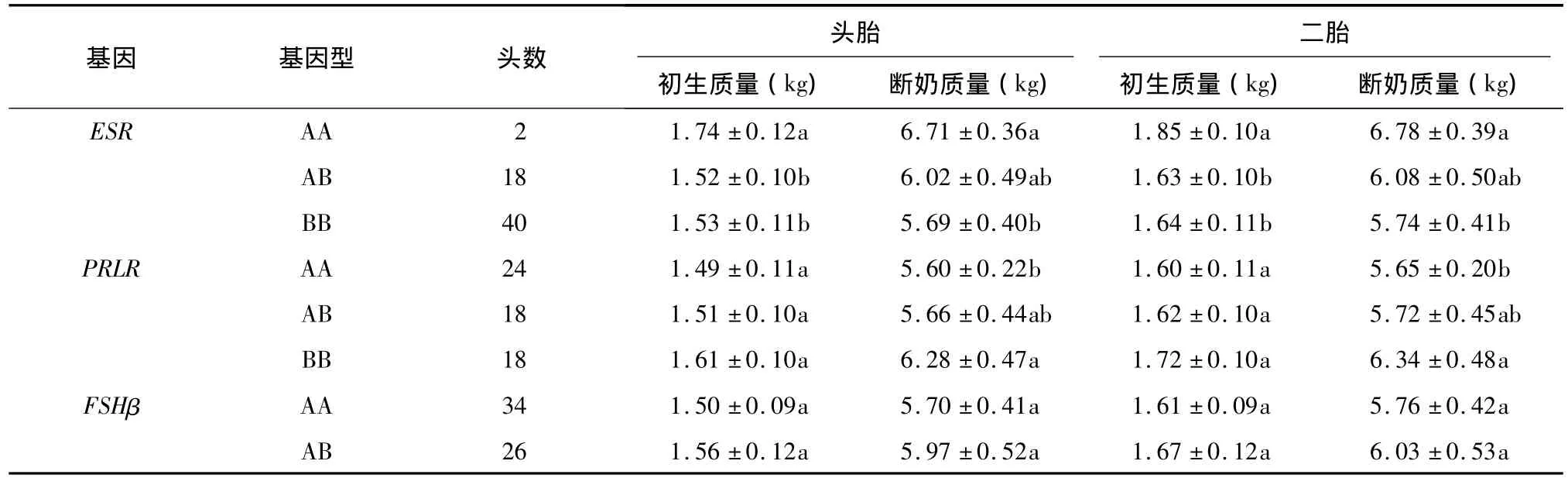
表4 ESR、PRLR和FSHβ基因不同基因型的初生质量和断奶质量Table 4 Birth weight and weaning weight of pigs with different genotypes of ESR,PRLR and FSHβ genes
3 讨论
3.1 各候选基因多态性及群体遗传分析
陈克飞等[7]研究发现ESR基因的B等位基因在国内猪种占优势(0.73),而国外猪种内A等位基因频率较高(0.66)。在山猪群体中,本研究得到与以往结论相同的结果。赵要风等[4]在二花脸和香猪内只发现了FSHβ基因的 A等位基因,徐宁迎等[8]在金华猪Ⅰ系内发现 B等位基因频率极低(0.012),在Ⅱ系和Ⅲ系内只发现A等位基因。本研究中未发现FSHβ基因的BB基因型,B等位基因频率为0.22。就PRLR基因而言,本研究所得结果与李婧等[9]的研究结果一致。群体的遗传平衡检测结果表明,山猪并未处于稳定遗传平衡状态。
3.2 各候选基因多态性与产仔数的相关性
ESR基因是较早发现的猪产仔数性状主效基因,许多研究认为每个B等位基因对产仔数的效应为0.3 ~1.5 头/胎[2,10-11]。对地方猪种姜曲猪、小梅山猪及二花脸猪的研究发现,ESR基因对总产仔数和产活仔数的效应均达到极显著水平,每个B等位基因对总产仔数和产活仔数的加性效应分别为1.52和 1.50头/胎[10]。本研究中,山猪群体 ESR基因BB型是优势基因型,B等位基因频率达到0.817,与大多数国内猪种的报道比较一致[7]。同时本研究发现ESR基因BB基因型个体头胎和二胎的总产仔数和活仔数均显著高于AA型个体(P<0.01)。推测山猪与其他地方猪种一样有较高的繁殖性能的潜力。
赵要风等[4]提出FSHβ是控制猪产仔性状主效基因,AA基因型是国内猪种的优势基因型,可以明显提高产仔数[4,9,12],但 Korwin-Kossakowska 等[13]报道中FSHβ基因的作用却是不显著的。本研究的山猪群体内,B等位基因频率很低,和其他国内地方猪种的基因分布趋势相近[11-12,14],但本研究发现 AA型的头胎和二胎的总产仔数和活仔数均略高于AB型,A等位基因是优势基因。由于本试验未发现BB型个体,可能由于山猪遗传资源严重流失导致,因此FSHβ基因对山猪繁殖性状的作用有待后期继续测定。
国内外不同学者对不同猪种的研究发现PRLR基因与产仔数、产活仔数显著相关,A等位基因能显著提高产仔数[15-16];另一部分研究者则认为BB基因型对猪产仔数更有利[6,17]。前人的研究成果说明PRLR多态性与繁殖性能存在相关性,但其在不同猪种中的多态性与繁殖性状的关系尚无定论。本研究与李婧等[11]的研究结果一致,PRLR基因的A等位基因为优势等位基因,AA基因型产仔数和产活仔数均显著高于BB基因型个体。
3.3 各候选基因多态性与初生质量、断奶质量的相关性
关于ESR、PRLR和FSHβ基因对仔猪初生质量和断奶质量的影响,目前还没有定论。部分研究认为ESR、PRLR和FSHβ基因对仔猪初生质量和断奶质量没有显著影响[18-19],但是胡雪松等[20]发现,PRLR基因对国内猪种和国外猪种初生质量作用显著不同。本研究中,PRLR基因对头胎和二胎仔猪的断奶质量效应显著,ESR基因对头胎、二胎的初生质量和断奶质量均有显著影响。谢保胜[21]的研究结果表明,金华猪的产仔数、产活仔数与初生质量呈现极显著负相关,本研究中,山猪的产仔数、产活仔数与初生质量的遗传关系也有相似趋势。这一结果为山猪的分子标记辅助选育过程提供了新的的依据和参考。
繁殖性状是个数量性状,受微效多基因调控,同时也受到胎次、管理、营养水平和饲养环境的影响。山猪遗传资源较为稀少,今后还应该通过扩大样本的数量做深入的研究,为遗传效应评价提供更有说服力的依据。因此,目前同时考虑几个繁殖性状基因的协同作用进行分子育种也许更为可取。
[1]颜 华,王立贤,王立刚,等.六个候选基因多态性与母猪繁殖性状关联分析[J].农业生物技术学报,2009,17(2):249-255.
[2]ROTHSCHILD M,JACOBSON C,VASKE D,et al.The estrogen receptor locus is associated with a major gene influencing litter size in pigs[J].PNAS USA,1996,93(1):201-205.
[3]VAN RENS B T,EVANS G J,VAN DER L T.Components of litter size in gilts with different prolactin receptor genotypes[J].Theriogenology,2003,59(3-4):915-926.
[4]赵要风,李 宁,肖 璐,等.猪FSHβ亚基基因结构区逆转座子插入突变及其与猪产仔数关系的研究[J].中国科学(C辑),1999,29(1):81-86.
[5]SHORT T H,ROTHSCHILD M F,SOUTHWOOD O I,et al.Effect of the estrogen receptor locus on reproduction and production traits in four commercial lines[J].J Anim Sci,1997,75(12):3138-3142.
[6]DROGEMULLER C,HAMANN H,DISTL O.Candidate gene markers for litter size in different German pig lines[J].J Anim Sci,2001,79(10):2565-2570.
[7]陈克飞,黄路生,李 宁,等.猪雌激素受体(ESR)基因对产仔数性状的影响[J].遗传学报,2000,27(10):853-857.
[8]徐宁迎,章胜乔,彭淑红.金华猪3个繁殖性状主基因的分布及其效应的研究[J].遗传学报,2003,30(12):1090-1096.
[9]李 婧,孟 和,李长龙,等.ESR和PRLR基因对民猪产仔数的影响[J].黑龙江畜牧兽医,2003(4):11-12.
[10]丁家桐,葛红山,姜勋平,等.猪雌激素受体基因与产仔数和乳头数的关系[J].南京农业大学学报,2002,25(2):79-81.
[11]李 婧,杨润清,孟 和,等.民猪产仔数性状四个候选基因效应分析[J].上海交通大学学报:农业科学版,2004,22(1):74-77.
[12]柳淑芳,杜立新,闫艳春.莱芜黑猪FSHβ亚基基因的多态性分析[J].山东农业大学学报,2002,33(4):403-408.
[13]KORWIN-KOSSAKOWSKA A,KAMYCZEK M,CIESLAK D,et al.Candidate gene markers for reproductive traits in polish 990 pig line[J].Journal of Animal and Genetics,2003,120(3):181-191.
[14]李国治,连林生,鲁绍雄,等.撒坝猪促卵泡素β亚基基因多态性及其与头胎产仔性能相关性研究[J].养猪,2005(2):22-23.
[15]VINCENT A L,TUGGLE C K,ROTHSCHILD M F,et al.The prolactin receptor gene is associated with increased litter size in pig[R].Armidale:Proceedings of the 6th World Congress on Genetics Applied to Livestock Production,1998.
[16]VAN RENS B T,VAN DER L T.Litter size and piglet traits of gilts with different prolactin receptor genotypes[J].Theriogenology,2002,57(2):883-893.
[17]孙延晓,曾勇庆,陈其美,等.八个猪种PRLR和RBP4基因PCR-RFLP检测及群体遗传特性研究[J].山东农业大学学报:自然科学版,2008,39(4):544-548.
[18]孙菊英,吕钢进,王友杉,等.嵊县花猪PRLR基因多态性与繁殖性状的相关分析[J].浙江畜牧兽医,2010(3):1-3.
[19]李千军,王立刚,穆淑琴,等.ESR、FSHβ及OPN基因多态性与母猪繁殖性状的关联分析[J].中国畜牧兽医,2010,37(10):139-143.
[20]胡雪松,王希彪.民猪、长白猪及其杂种母猪催乳素受体(PRLR)基因的NaeⅠ多态性与繁殖性状的相关分析[J].畜牧兽医学报,2006,37(11):1135-1140.
[21]谢保胜.应用约束性最大似然法(REML)估计金华猪繁殖性状和生长性状的遗传参数[D].杭州:浙江大学,2002.

