饲喂CYP6CM1和Coe1 RNAi双价转基因烟草对Q型烟粉虱抗药性的影响
常 蕾, 胡雪虹, 杨郁文, 陈天子, 邓惠清, 姜利农, 刘正銮, 张保龙,王荣富
(1.江苏省农业科学院,江苏省农业生物学重点实验室,江苏 南京 210014;2.安徽农业大学生命科学学院,安徽 合肥230061;3.江苏省太仓市棉花育种中心,江苏 太仓 215411)
烟粉虱(Bemisia tabaci)属半翅目(Hemiptera)粉虱科(Aleyrodidae)小粉虱属(Stenorrhyncha),是一个正在快速进化的复合种[1-4],主要危害茄科、葫芦科、豆科、菊科、十字花科、锦葵科等植物,其危害包括直接刺吸为害、传播植物病毒、引起植物生理混乱、分泌蜜露诱发真菌病害给作物生产造成巨大的经济损失[5-7]。近年来,Q型烟粉虱逐渐取代 B型烟粉虱成为危害中国农区的主要烟粉虱生物型[8-9]。mtDNA CO I基因序列检测表明,江苏地区烟粉虱种群生物型为Q型和B型,其中Q型烟粉虱占所测总样本的94.40%[10]。据报道Q型烟粉虱比B型烟粉虱具有更强的传毒能力且对许多化学农药产生更强的抗药性[11-13]。
现在防治烟粉虱的常规药剂主要包括有机磷类(辛硫磷、毒死蜱等)、氨基甲酸酯类(灭多威、丁硫克百威等)、新烟碱类(吡虫啉、啶虫脒、烯啶虫胺等)以及昆虫生长调节剂(噻嗪酮、蚊蝇醚)等杀虫剂[14-15]。对不同类型的杀虫剂,烟粉虱有着不同的抗药性分子机制,Nauen等的研究表明,Q型烟粉虱对烟碱类杀虫剂的抗药性与微粒体细胞色素P450多功能氧化酶有关[16]。吡虫啉是世界上使用面积最为广泛的氯化烟碱类杀虫剂,但随着烟碱类杀虫剂的推广应用,烟粉虱对它的抗药水平也在上升[17-19]。张善明等研究发现在抗有机磷的昆虫体内,羧酸酯酶、多功能氧化酶的活力增加,尤其是羧酸酯酶同工酶分析显示有高活性的酶带出现[20]。Alon等[21]研究发现用有机磷处理具有抗药性的B型烟粉虱成虫,其体内Coe1基因表达量升高到处理前的4倍。
2009年,Bautista等给小菜蛾幼虫喂食细胞色素P450酶基因CYP6BG1 dsRNA 1 d后,处理组幼虫体内 CYP6BG1比对照组降低了97.7%~98.5%,对达氯菊酯杀虫剂的抗性下降了48.5% ~61.4%[22]。Mao等将基于棉铃虫中肠高度表达的CYP6AE14基因设计的dsRNAs转入三生烟和拟南芥中,用转基因植物叶片喂食棉铃虫幼虫后发现棉铃虫CYP6AE14转录水平明显下降,并且棉铃虫对棉酚的敏感性增强[23]。Small等研究发现稻褐飞虱(Nilaparvata lungens)对有机磷杀虫剂产生抗性的原因与羧酸酯酶的活性升高有关,且在抗性品系Sritankan中分离出编码羧酸酯酶的cDNA N1-EST1[24]。以上研究结果表明,昆虫P450酶系和羧酸酯酶参与杀虫剂的代谢作用,导致大多数昆虫产生抗药性,通过RNAi沉默昆虫P450基因和羧酸酯酶基因可有效提高使用杀虫剂的防治效果。
本研究拟用Q型烟粉虱细胞色素P450基因CYP6CM1和羧酸酯酶基因Coe1构建RNAi载体转化烟草,研究取食转基因烟草的烟粉虱对烟碱类杀虫剂阿维·吡虫啉和有机磷杀虫剂辛硫磷的敏感性。
1 材料与方法
1.1 材料
试验烟粉虱采集自江苏省农业科学院温室内的棉花植株,通过mtDNA CO I基因序列鉴定属Q生物型[25-26]。含有FAD2内含子的载体Hurricane由澳大利亚CSIRO Plant Industry柳青惠赠。普通烟草(Nicotiana benthamiana)、植物表达载体pBI121和农杆菌LBA4404由本实验室保存。
限制性内切酶购自Fermentas公司;T4连接酶、Taq DNA聚合酶、RNA提取试剂盒和M-MLV反转录酶购自大连宝生物公司;头孢霉素(Cef)、卡那霉素(Kan)、利福平(Rif)、DNA凝胶回收试剂盒和大肠杆菌JM109购自上海生工生物工程有限公司;pGEM-T Easy载体购自Promega公司;质粒提取试剂盒购自Axygen公司;引物由上海生工生物工程有限公司合成。
烟碱类杀虫剂阿维·吡虫啉(0.1%+1.7%)可湿性粉剂(江苏省苏科农化有限责任公司产品),用无菌水稀释至1 g/L;辛硫磷40%乳油(连云港立本农药化工有限公司产品),用无菌水稀释1 000倍。防治烟粉虱的药剂采用生产厂家推荐浓度。
1.2 CYP6CM1和Coe1为靶基因的RNAi载体构建
以TaKaRa RNAiso Reagent(TaKaRa公司)提取烟粉虱 RNA,用 TaKaRa M-MLV reverse transcriptase(TaKaRa公司)合成cDNA第一链,用引物F1/R1和F2/R2(表1)分别扩增 CYP6CM1基因和Coe1基因,制备dsRNA植物表达载体的正义链和反义链。PCR反应条件:94℃预变性3 min;94 ℃变性30 s,57 ℃ 退火30 s,72 ℃ 延伸60 s,35个循环;72℃继续延伸10 min。PCR产物用1.0%的琼脂糖凝胶电泳分离,用Axygen DNA gel extraction kit(Axygen公司产品)回收纯化目的片段混合物作为模板,用引物F1和R2进行PCR扩增,PCR产物(916 bp)凝胶回收纯化获得嵌合基因。将纯化的嵌合基因与pGEM-T easy vector(Promega公司产品)连接,并用热激法将克隆载体导入大肠杆菌JM109(上海生工生物工程有限公司产品),挑取阳性克隆提取质粒F1/R2-T(Axygen公司产品)。

表1 本研究PCR所用引物Table 1 PCR primers used in this study
利用BamHⅠ-F3/HindⅢ-R3扩增F1/R2-T质粒并回收纯化PCR产物,用BamHⅠ和HindⅢ酶切PCR产物和中间载体Hurricane,将所获质粒命名为Hurricane-T。
利用SacⅠ-F4/XhoⅠ-R4 PCR扩增F1/R2-T载体质粒,回收纯化PCR产物(919 bp),以XhoⅠ和SacⅠ酶切PCR产物和Hurricane-T,酶切产物用T4-DNA酶连接并转化,所获阳性克隆命名为Hurricane-RNAi。
用BamHⅠ和SacⅠ酶切植物表达载体pBI121(Clontech 公司产品)和 Hurricane-RNAi,酶切产物用T4-DNA连接酶(TaKaRa公司产品)连接,所获阳性克隆经双酶切验证是否获得植物表达的RNAi载体。
1.3 农杆菌介导转化烟草
采用冻融法将RNAi植物表达载体导入农杆菌LBA4404感受态细胞中,取健康烟草叶片置于大培养皿,依次经75%乙醇浸泡灭菌1 min,0.1%升汞浸泡灭菌8 min,灭菌水冲洗5次并以灭菌滤纸吸去烟叶表面水后,用刀片切成0.5 cm×0.5 cm小块。用预先培养好的农杆菌侵染烟草叶盘5 min,灭菌吸水纸吸干表面菌液后转移到共培养基(MS培养基+0.1 mg/L NAA+1 mg/L 6-BA+3%蔗糖+2.5 g/L植物凝胶,pH 5.8),21℃暗培养2 d,将叶盘转移到选择培养基(MS培养基 +0.1 mg/L NAA+1 mg/L 6-BA+3%蔗糖+2.5 g/L植物凝胶+500 mg/L头孢霉素 +100 mg/L卡那霉素,pH 5.8),28~30℃、16 h光照/8 h黑暗下培养,每15 d更换1次选择培养基。小苗分化后,将其转移到生根培养基(1/2 MS培养基+0.1 mg/L NAA+250 mg/L头孢霉素)。生根后将卡那霉素抗性苗移栽到土壤。
1.4 转基因烟草PCR检测
利用CTAB法提取再生烟草植株叶片DNA,用特异引物Carb-Mono-409F/FAD-intron 96R进行PCR检测RNAi载体中的内含子部分序列,目的片段大小为600 bp左右,以非转基因烟草为对照。PCR扩增程序如下:95℃预变性5 min;94℃变性30 s,56 ℃退火 30 s,72 ℃延伸 50 s,30 个循环;72℃延伸5 min。
1.5 饲喂转基因烟草对烟粉虱抗药性效果检测
1.5.1 饲喂转基因烟草的烟粉虱体内CYP6CM1和Coe1表达水平检测 将2个T1代转基因烟草株系和1个非转基因普通烟草株系独立置于3个隔离防虫箱内,每防虫箱各含10株烟草,并释放烟粉虱成虫取食,5 d后各收集烟粉虱30头,以RNA提取试剂盒(PROMAGE公司产品)提取烟粉虱RNA,用反转录酶(大连宝生物公司产品)反转录合成cDNA第一链,荧光定量PCR检测烟粉虱CYP6CM1基因(引物F5/R5)和Coe1基因(引物F6/R6)表达水平,以烟粉虱actin基因(引物Bemi-ActinQF和BemiActinQR)为内参。荧光定量PCR仪为 qTOWER 2.0/2.2(德国 Analytik jena公司产品),PCR反应程序:94℃预变性3 min;94℃变性30 s,57 ℃ 退火40 s,72 ℃延伸60 s,35 个循环;72℃继续延伸10 min。
1.5.2 饲喂转基因烟草的烟粉虱对杀虫剂的敏感性检测
1.5.2.1 琼脂保湿浸叶法 按照何鑫等[27]的方法制备琼脂培养基,摘取防虫网箱中转双基因烟草株系H1、H2和野生型普通烟草叶片,以打孔器打成直径38 mm的叶盘,置于1 g/L阿维·吡虫啉和稀释1 000倍辛硫磷药液中浸渍20 s,室内阴干后,将烟草叶盘正面向下平放于凝固的琼脂培养基表面,捕捉防虫箱中取食烟草5 d的烟粉虱成虫30头作为试虫,释放至烟草叶盘上,任其爬行,接触一定时间后,记录试虫活体总数,然后将存活试虫置于培养箱培养(25~28℃、14 h光照/10 h 黑暗、湿度 60% ~80%),24 h、48 h和72 h后分别统计试虫存活数。试验重复3次,每重复含3个叶盘,以无菌水浸渍烟草叶盘处理为空白对照,计算烟粉虱校正死亡率,方法如下:烟粉虱处理组死亡率=(处理组试虫活体总数-处理组试虫存活数)∕处理组试虫活体总数×100%;烟粉虱空白对照死亡率=(空白对照试虫活体总数-空白对照试虫存活数)∕空白对照试虫活体总数×100%;烟粉虱校正死亡率=(处理组死亡率-空白对照死亡率)/(1-对照组死亡率)×100%。
1.5.2.2 单株活体法 转双基因烟草株系H1、H2和野生型普通烟草各取3~5株,每株单独罩防虫薄膜,每株接入150只烟粉虱进行取食,置于培养室内培养(温度20~25℃,14 h光照/10 h黑暗)。烟粉虱取食5 d后,分别用1 g/L阿维·吡虫啉和稀释1 000倍的辛硫磷喷施单株烟草,药剂处理24 h、48 h和72 h后统计烟草叶片上的烟粉虱活虫数。试验重复3次,以无菌水喷施烟草植株处理为空白对照,计算烟粉虱校正死亡率,方法如1.5.2.1所述。
2 结果
2.1 RNAi载体的构建
利用引物BamHⅠ-F3/HindⅢ-R3和SacⅠ-F4/XhoⅠ-R4分别扩增获取Q型烟粉虱CYP6CM1-Coe1基因序列,酶切后先后正反向连接到Hurricane载体FAD2内含子两侧,构建了含CYP6CM1-Coe1基因反向重复序列的 Hurricane-RNAi载体,用BamHⅠ和SacⅠ酶切该反向重复序列,连接到同样经BamHⅠ和SacⅠ酶切的pBI121植物表达载体,获得了35S启动子驱动表达的RNAi载体(图1、图2)。

图1 Coe1和CYP6CM1嵌合的dsRNA发夹结构示意图Fig.1 The schematic map of chimeric dsRNA hairpin structure of Coe1 and CYP6CM1

图2 RNAi载体BamHⅠ/SacⅠ双酶切验证Fig.2 The RNAi vector confirmed by BamH Ⅰ/Sac Ⅰ double digestion
2.2 转基因烟草T0代PCR验证
叶盘法转化本氏烟,经卡那霉素筛选共得到12株独立再生苗,CTAB法提取再生烟草植株叶片DNA,用引物Carb-Mono-409F和FAD-intron96R进行PCR,检测再生苗中的CYP6CM1-Coe1基因部分序列与内含子部分序列,获得5株独立转基因烟草(图3)。

图3 PCR检测转基因烟草中CYP6CM1-Coe1基因和FAD内含子间的部分序列片段Fig.3 PCR detection of partial sequence between CYP6CM1-Coe1 gene and FAD intron in transgenic tobacco plants by BamHⅠ/SacⅠdouble digestion
2.3 烟粉虱CYP6CM1基因和Coe1基因表达量
播种T1代转基因烟草,经卡那霉素处理后,筛选抗性较好的转基因株系H1和H2,各取10株转基因苗,置于独立防虫网箱内,释放烟粉虱进食,5 d后各收集烟粉虱30头,检测其体内CYP6CM1基因和Coe1基因的表达水平,结果发现取食转基因烟草的烟粉虱CYP6CM1基因和Coe1基因表达量仅为取食非转基因烟草的烟粉虱CYP6CM1基因和Coe1基因表达量的18% ~24%和17% ~33%(图4),说明转基因烟草的 RNAi表达框架可以降低烟粉虱CYP6CM1基因和Coe1基因的表达水平。
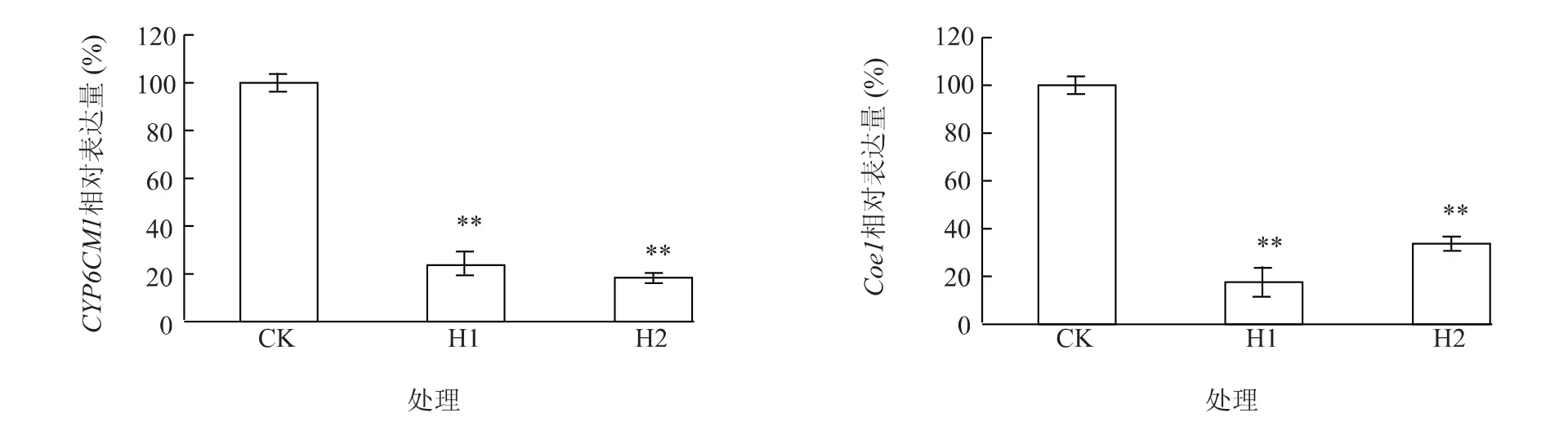
图4 烟粉虱体内CYP6CM1基因与Coe1基因的相对表达量Fig.4 The relative expressions of CYP6CM1 gene and Coe1 gene in Bemisia tabaci
2.4 烟粉虱喂食转基因烟草后抗药性检测
2.4.1 琼脂保湿浸叶法 烟粉虱进食烟草5 d后,转移至含阿维·吡虫啉和辛硫磷杀虫剂的烟草叶盘研究烟粉虱对杀虫剂的敏感性,结果发现接触阿维·吡虫啉杀虫剂24 h、48 h和72 h后,取食转基因烟草H1的烟粉虱死亡率分别是55.86%、81.70%、94.44%,取食转基因烟草H2的烟粉虱死亡率分别是58.96%、85.35%、96.13%,取食非转基因烟草的烟粉虱死亡率分别是35.15%、63.57%、79.67%,取食转基因烟草的烟粉虱死亡率比取食非转基因烟草的烟粉虱死亡率高14.77%~16.46%。接触辛硫磷杀虫剂24h、48h和72h后取食转基因烟草H1的烟粉虱死亡率分别是46.05%、71.94%、91.82%,取食转基因烟草H2的烟粉虱死亡率分别是47.87%、74.01%、92.46%,取食非转基因烟草的烟粉虱死亡率分别是30.54%、53.65%、68.88%,取食转基因烟草的烟粉虱死亡率比取食非转基因烟草的烟粉虱死亡率高22.94% ~23.58%。表明CYP6CM1-Coe1 RNAi转基因烟草增强了烟粉虱对烟碱类杀虫剂阿维·吡虫啉和有机磷杀虫剂辛硫磷的敏感性。
2.4.2 单株活体法 为进一步研究CYP6CM1-Coe1 RNAi转基因烟草对烟粉虱抗药性的影响,直接将烟粉虱释放在转基因烟草和非转基因烟草上取食,5 d后,喷施阿维·吡虫啉杀虫剂,24 h、48 h和72 h后,取食转基因烟草H1的烟粉虱死亡率分别是46.11%、60.65%、88.58%,取食转基因烟草H2的烟粉虱死亡率分别是48.91%、68.05%、91.08%,取食非转基因烟草的烟粉虱死亡率分别是31.47%、47.28%、72.57%,取食转基因烟草的烟粉虱死亡率比取食非转基因烟草的烟粉虱死亡率高16.01% ~18.51%。5 d后,喷施辛硫磷杀虫剂,24 h、48 h和72 h后,取食转基因烟草H1的烟粉虱死亡率分别是42.07%、60.19%、84.65%,取食转基因烟草H2的烟粉虱死亡率分别是45.95%、63.01%、86.01%,取食非转基因烟草的烟粉虱死亡率分别是28.31%、42.92%、67.25%,取食转基因烟草的烟粉虱死亡率比取食非转基因烟草的烟粉虱死亡率高17.4%~18.76%。单株活体法与琼脂保湿浸叶法的鉴定结果一致。
3 讨论
抗药性检测试验中,喂食烟粉虱表达CYP6CM1-Coe1 RNAi的转基因烟草后,烟粉虱体内P450基因CYP6CM1和羧酸酯酶基因Coe1表达量显著下降,喷施阿维·吡虫啉和辛硫磷药剂后,烟粉虱死亡率明显高于喂食非转基因烟草的烟粉虱死亡率,表明烟粉虱取食表达CYP6CM1-Coe1 RNAi的转基因烟草,导致体内细胞色素P450介导的多功能氧化酶和水解酶解毒功能降低,并且对杀虫剂敏感性显著增加,证明通过RNAi沉默烟粉虱P450基因和羧酸酯酶基因是有效防治烟粉虱的途径。但烟粉虱抗药性的产生是多种因素综合作用的结果,本研究只是就抗药性与其体内解毒酶作用的关系做了相关性研究,其他如分子水平基因突变、不同环境下药剂选择压力差异和生物型也会影响烟粉虱对药剂的敏感性程度[28]。
烟粉虱(Bemisia tabaci)作为世界性多寄主害虫,具有繁殖能力强、世代重叠严重、传播病毒能力强、生物型种类多和抗药性强的特点,防治困难[29]。Pan等研究发现来自14个省的43个种群检测为Q型,其他来自8个省的12个种群检测为B型,近年来,Q型烟粉虱逐渐取代B型烟粉虱呈现由南向北不断扩散的趋势[30]。江苏省内以Q型烟粉虱为主,其传毒能力和农药抗性方面强于B型烟粉虱[31]。长期连续单一使用农药导致其抗药性不断上升,可是新型农药的开发成本越来越高,开发速度也低于老品种的淘汰速度,所以延长现有农药品种的使用寿命,有助于降低防治烟粉虱的成本。RNA干扰敲除昆虫抗药性相关基因是分子生物学领域中功能基因及基因组研究的一种强有力工具。本研究通过构建CYP6CM1-Coe1-RNAi载体,利用喂食法沉默烟粉虱体内相关解毒酶基因,实现抗虫效果的明显提升,对农业生产具有指导意义,RNAi技术能够特异性地抑制昆虫防御基因的表达,在转基因抗虫植物的开发和害虫控制中的应用前景非常广阔[32-33]。
[1]BROWN J K,FROHLICH D R,ROSELL R C.The sweetpotato or silverleaf whiteflies:biotypes of Bemisia tobaci of a species complex[J].Annual Review Entomology,1995,40:511-534.
[2]OILREIRA M R V,HENNEBERRY T J,ANDERSON P.History,current status,and collaborative research projects for Bemisia tabaci[J].Crop Protection,2001,20(9):709-723.
[3]谭永安,肖留斌,孙 洋,等.寄主植物对Q型烟粉虱生长发育、海藻糖含量及2种酶活性的影响[J].江苏农业学报,2012,28(6):1272-1277.
[4]杨代凤,周奋启,顾俊荣,等.5种药剂对烟粉虱的室内毒力及田间防效[J].江苏农业科学,2012,40(7):114-115.
[5]ROWN J K,CZOSNEK H.Whitefly transmission of plant viruses[J].Advances in Botanical Research,2002,36:65-76.
[6]INBAR M,GERLING D.Plant-mediated interactions between whiteflies,herbivores,and natural enemies[J].Annual Review of Entomology,2008,53:431-448.
[7]JONES D R.Plant viruses transmitted by whiteflies[J].European Journal of Plant Pathology/European Foundation for Plant Pathology,2003,109(3):195-219.
[8]CHU D,WAN F H,ZHANG Y J,et al.Change in the biotype composition of Bemisia tabaci in Shandong Province of China from 2005 to 2008[J].Environmental Entomology,2010,39:1028-1036.
[9]CHU D,ZHANG Y J,WAN F H.Cryptic invasion of the exotic Bemisia tabaci biotype Q occurred widespread in Shandong Province of China[J].Florida Entomologist,2010,93:203-207.
[10]谭永安,肖留斌,孙 洋,等.江苏烟粉虱生物型鉴定与危害程度分析[J].环境昆虫学报,2012,34(3):277-282.
[11]何玉仙,翁启勇,黄 建,等.烟粉虱田间种群的抗药性[J].应用生态学报,2007,18(7):1578-1582.
[12]褚 栋,张友军,毕玉平,等.警惕Q型烟粉虱在我国进一步扩散[J].植物检疫,2005,19(3):171-174.
[13]徐德进,季英华,顾中言,等.10种杀虫剂对南京地区Q型烟粉虱的室内毒力测定[J].江西农业学报,2011,23(12):79-82.
[14]邓业成,徐汉虹,雷 玲.烟粉虱的化学防治及抗药性[J].农药,2004,43(1):10-15.
[15]孙双艳,胡敦孝.几种药剂对B型烟粉虱的毒力及药效测定[J].植物保护,2001,27(4):23-25.
[16]NAUEN I,STUMPF N,ELBERT A.Toxocohigical and mechanistic studies on neonicotinoid cross resistance in Q-type Bemisia tabaci(Hemiptera:Aleyrodidae)[J].Pest Management Science,2002,58:868-874.
[17]任家贵,朱金香.烟粉虱抗药性及其治理对策的研究[J].湖南农业科学,2005(4):59-61.
[18]王震宇.烟粉虱吡虫啉抗性的监测与机理[D].南京农业大学,2008.
[19]BYRNE F J,STEVE C,NILIMA P,et al.Biochemical study of resistance to imidacloprid in B biotype Bemisia tabaci from Guatemala[J].Pest Management Science,2003,59(3):347-352.
[20]张善明,彭建新,余泽华,等.酶学分析在昆虫抗有机农药研究中的应用[J].湖北农学院学报,2000,20(3):281-284.
[21]ALON M,ALON F,NAUEN R,et al.Organophsphates’resistance in the B-biotype of Bemisia tabaci(Hemipera:Alerodidae)is associated with a point mutation in an ace1-type acetylchlinesterase and overexpression of carboxylesterase[J].Insect Biochemistry and Molecular Biology,2008,38:940-949.
[22]BAUTISTA M A,MIYATA T,MIURA K,et al.RNA interference-mediated knockdown of a cytochrome P450,CYP6BG1,from the diamondback moth,Plutella xylostella,reduces larval resistance to permethrin[J].Insect Biochemistry and Molecular Biology,2009,39(1):38-46.
[23]MAO Y B,CAI W J,WANG J W,et al.Silencing a cotton bollworm P450 monooxygenase gene by plant-mediated RNAi impairs larval tolerance of gossypol[J].Nature Biotechnology,2007,25(11):1307-1313.
[24]SMALL G J,HEMINGWAY J.Molecular characterization of the amplified carboxylesterase gene associated with organophosphorus insecticide resistance in the brown planthopper,Nilaparvata lugens[J].Insect Molecular Biology,2000,9(6):647-653.
[25]张保龙,胡雪虹,陈天子,等.CYP6CM1基因RNA干扰载体的构建及转基因烟草对烟粉虱抗药性的影响[J].江苏农业学报,2012,28(4):717-721.
[26]罗 晨,姚 远,王戎疆,等.利用mtDNA COI基因序列鉴定我国烟粉虱的生物型[J].昆虫学报,2002,45:759-763.
[27]何 鑫,赵统敏,张保龙,等.烟粉虱对几种药剂的敏感度检测及其抗药性相关基因的表达特征分析[J].江苏农业学报,2012,28(3):482-486.
[28]何玉仙,黄 建.烟粉虱抗药性的研究进展[J].华东昆虫学报,2005,14(4):336-342.
[29]曲风勇,赵 龙,韩秀田.烟粉虱的发生与防治[J].山东蔬菜,2004(3):39-39.
[30]PAN H P,CHU D,YAN W Q.Rapid spread of Tomato Yellow Leaf Curl Virus in China is aided differentially by two invasive whiteflies[J].PLoS ONE,2012,7(4):e34817.
[31]沈 媛,杜予州,任顺祥,等.江苏地区烟粉虱生物型演替研究初报[J].应用昆虫知识,2011,48(1):16-21.
[32]杨 广,尤民生,赵伊英,等.昆虫的 RNA干扰[J].昆虫学报,2009,52(10):1156-1162.
[33]TURNER C T,DAVY M W,MACDIARMID R M,et al.RNA interference in the light brown apple moth,Epiphyas postvittana(Walker)induced by double-stranded RNA feeding[J].Insect Molecular Biology,2006,15(3):383-391.

