氮、磷、钾对甘薯生长前期根系形态和植株内源激素含量的影响
宁运旺, 马洪波, 张 辉,2, 许建平, 汪吉东, 许仙菊, 张永春
(1.江苏省农业科学院农业资源与环境研究所/农业部江苏耕地保育科学观测实验站,江苏 南京 210014;2.土壤与农业可持续发展国家重点实验室,中国科学院南京土壤研究所,江苏 南京 210008)
甘薯属于无限生长的匍匐作物,根系数量多、分布广,具有较强的吸肥和耐瘠薄能力,因此在生产中往往不重视施肥,相较于其他作物,对甘薯的植物营养研究也非常缺乏[1-4]。甘薯根系既是矿质养分的吸收器官,又是光合同化物的贮存器官,其产量形成必然要经过生长前期的功能分化过程,但迄今我们对这一过程与氮、磷和钾养分的关系还缺乏了解。前人研究已发现,氮是影响甘薯生长前期根系生长和分化的主要因素之一,一个较低水平的施氮量就能表现出对根系生长的抑制作用[5];虽然在一定施氮量范围内,甘薯生长前期的根系总量随施氮量的增加而增加,但向块根方向分化的根系总量却逐渐减少,当施氮量达到一定程度时甚至不产生向块根方向分化的根[6],但此研究是在营养液条件下进行的,对于土培条件下生长前期根系的生长和分化是否受到氮、磷和钾用量的影响还鲜有相关研究报道。作物根系生长除受内在遗传因素和所处发育阶段的影响外,还受到诸多外界环境信号的影响,植物激素处于这些信号所构成网络的中心,对形成作物根系有重要作用[7]。细胞分裂素(CKs)和生长素(IAA)可共同调控作物根尖分生组织细胞的分裂和生长,在作物根系构建中起重要作用[8-9]。氮、磷和钾用量可影响作物CKs和IAA含量与分布,并认为可能是影响根系构建的内在因素,已在许多作物上得到证实[10-13]。目前,关于氮、磷和钾对甘薯生长前期内源激素含量与分布影响的研究鲜有报道。
甘薯栽插后从茎基部长出的不定根可根据环境条件向3个方向分化:须根、柴根和块根[14],其中须根具有吸收功能,块根具有贮存功能,而柴根(又称梗根、牛蒡根、笔根)是一种徒耗养分的根[15]。在移栽后30 d,甘薯根系分化过程就已基本完成,且根系的生长状态与最终的产量性状(有效薯数)密切相关[16],并对最终的块根产量有决定作用。本文采用盆栽试验,在甘薯移栽后30 d(生长前期),研究氮、磷和钾用量对其根系形态和内源激素含量与分布的影响,以期为甘薯的养分管理提供依据。
1 材料与方法
1.1 材料
甘薯品种为江苏省农业科学院育成的苏薯14。土壤为取自里下河地区的高沙土,其基本理化性状为 pH 7.05,有机质 6.36 g/kg,碱解氮 44.14 mg/kg,有效磷 6.71 mg/kg,速效钾 52.00 mg/kg。试验盆钵为22 cm×25 cm的褐色塑料盆钵。
1.2 试验处理
盆栽试验于2012年8月~12月在江苏省农业科学院大棚内进行,每盆装土2.5 kg。根据不同氮、磷和钾肥施用量,试验设7个处理,即处理1为1 kg土中施氮量(N)0 mg+施磷量(P2O5)100 mg+施钾量(K2O)150 mg,处理 2为 1 kg土中施氮量150 mg+施磷量100 mg+施钾量150 mg,处理3为1 kg土中施氮量300 mg+施磷量100 mg+施钾量150 mg,处理4为1 kg土中施氮量150 mg+施磷量0 mg+施钾量150 mg,处理5为1 kg土中施氮量150 mg+施磷量200 mg+施钾量150 mg,处理6为1 kg土中施氮量150 mg+施磷量100 mg+施钾量0 mg,处理7为1 kg土中施氮量150 mg+施磷量100 mg+施钾量300 mg。重复4次。氮、磷和钾肥分别为尿素(含N 46.2%)、磷酸一钙(含P2O528.2%)和硫酸钾(含K2O 50.0%)。
1.3 试验管理与取样
土壤装盆后先浇底水至土壤饱和持水量的60%,然后取生长一致的薯苗材料,剪切茎尖以下约35 cm长的薯蔓,于2012年8月25日移栽,移栽时薯苗埋入钵内约10 cm,每盆移栽1株。移栽后浇水使土壤水分含量为田间持水量的80%,整个试验过程中以称重法控制土壤水分为田间持水量的75%。移栽后30 d取样,取样时先沿茎基部剪断,地下部分取样时将盆钵倒扣,小心将土壤中的甘薯根系悉数拣出,洗净晾干后称取鲜质量,用根系扫描仪扫描,最后-70℃液氮保存,待测激素含量。
1.4 测定方法与数据处理
根系形态用根系扫描仪(LA1600+scanner,Canada)扫描获得根系图像后,用根系分析软件(Winrhizo2003b,Canada)进行相关根系指标分析,内容包括根长、表面积、体积、根尖数和平均直径[17]。内源激素的测定参照王庆美的方法,即将1.0 g甘薯样品与液氮中速冻,用80%的甲醇溶液(含二叔丁基对甲苯酚(BHT)1 mmol/L)匀浆,4℃提取8 h,4 000 r/min离心15 min,80%甲醇溶液沉淀并重复提取3次,合并上清夜,氮气吹干,PBSTG溶液定容,ELISA法测定[16]。采用Excel和SPSS软件进行数据处理。
2 结果
2.1 氮、磷、钾对甘薯生长前期地上部和根系鲜质量的影响
如表1所示,随着施氮量的增加,甘薯根系鲜质量明显下降,且150 mg(处理2)和300 mg(处理3)施氮量处理的根系鲜质量显著降低不施氮处理(处理1)。与此相反,随着磷(处理4、处理2、处理5)和钾肥(处理6、处理2、处理7)施用量的增加,甘薯根系鲜质量呈增加趋势,但各处理间差异均不显著。表明氮、磷和钾肥对甘薯生长前期根系生长的作用明显不同,施氮肥抑制甘薯根系生长,而磷和钾肥则有一定的促进作用。

表1 氮、磷、钾对甘薯生长前期地上部及根系鲜质量的影响Table 1 Effects of nitrogen,phosphorus and potassium on fresh weights of above-ground part and roots of sweet potato at early growing stages
随着氮、磷和钾用量的增加,生长前期甘薯的地上部鲜质量呈增加趋势,但各处理间差异不显著。甘薯冠根比随施氮量的增加而显著增加(P<0.05),而随着磷和钾肥施用量的增加,冠根比逐渐下降(P>0.05)。
2.2 氮、磷、钾对甘薯生长前期根系形态的影响
表2所示,与不施氮处理(处理1)相比,施氮处理(处理2和处理3)可使根长显著减少35.9%(P<0.05)和59.1%(P<0.05),根平均直径显著减少9.4%(P<0.05)和15.3%(P<0.05),根表面积和根体积分别显著减少42.4%(P<0.05)和65.0%(P<0.05)及62.0%(P<0.05)和80.2%(P<0.05),而根尖数则只在高量施氮处理下(处理3)时显著降低68.8%(P<0.05)。随着磷和钾施用量的增加,甘薯的根尖数、根长、根平均直径、根表面积和根体积均有增加的趋势,且除高量施磷处理(处理5)的根平均直径比不施磷处理(处理4)显著增加8.5%(P<0.05)外,其处理间差异均不不显著。表明施氮使甘薯生长前期根系数量、根长(纵向生长)和根平均直径(横向生长)减少;磷和钾施用则有相反的趋势。
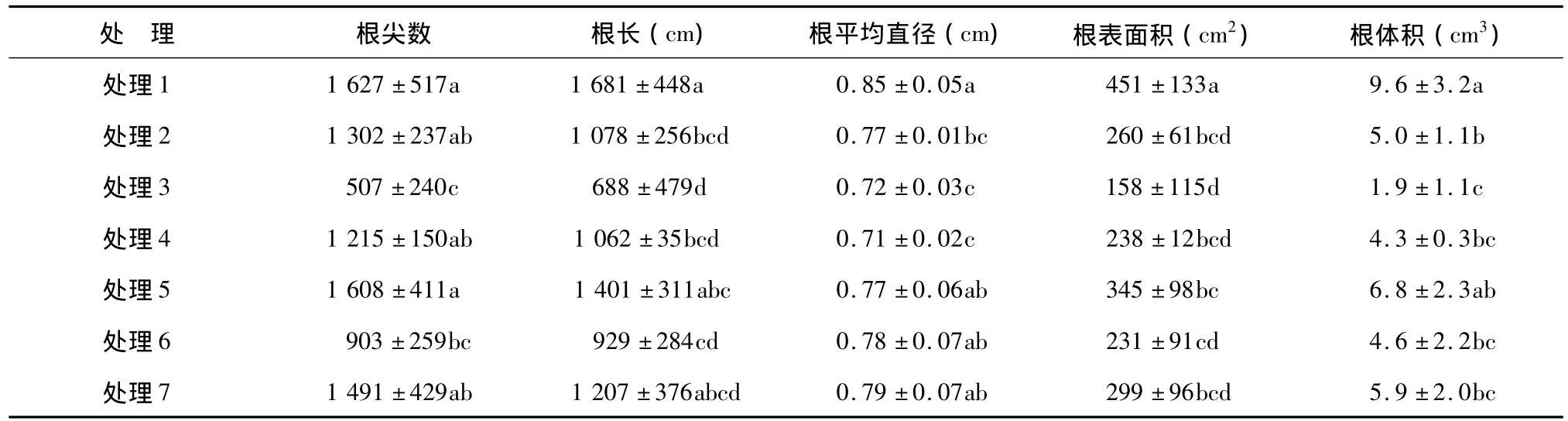
表2 氮、磷、钾对甘薯生长前期根系形态的影响Table 2 Effects of nitrogen,phosphorus and potassium on root morphology of sweet potato at early growing stages
2.3 氮、磷、钾对甘薯生长前期分化根根系形态的影响
甘薯生长前期根系分化发生变态是块根膨大的基础,由于这一时期甘薯的有效薯数已基本固定[16],而正常条件下甘薯最终形成的单株有效薯数以4~6个为宜,因此,根据本研究中根尖数的分布状况确定直径大于1.5 mm的根为已发生变态增粗的分化根。由表3所示,与不施氮肥处理(处理1)相比,施氮肥处理(处理2和处理3)可使分化根的根尖数分别下降21.1%(P>0.05)和57.1%(P<0.05),根长分别下降58.1%(P<0.05)和82.1%(P<0.05),根表面积和根体积也分别减少43.3%(P<0.05)和 59.5%(P<0.05)及 61.2%(P<0.05)和77.3%(P<0.05)。与不施磷处理(处理4)相比,施磷肥处理(处理2和处理5)可使分化根的根尖数分别增加35.0%(P>0.05)和120.0%(P<0.05),根长、根表面积和根体积也分别增加62.5%(P>0.05)和133.4%(P<0.05)、31.8%(P<0.05)和 83.7%(P<0.05)及 117.9%(P<0.05)和 250.0%(P<0.05)。施用钾肥对分化根的根系形态均无显著影响。表明甘薯生长前期,施氮可抑制根系分化,施磷可促进根系分化,而施钾对根系分化无影响。

表3 氮、磷、钾对甘薯生长前期分化根形态的影响Table 3 Effects of nitrogen,phosphorus and potassium on thickened root morphology of sweet potato at early growing stages
2.4 氮、磷、钾对甘薯生长前期根、茎和叶中细胞分裂素含量的影响
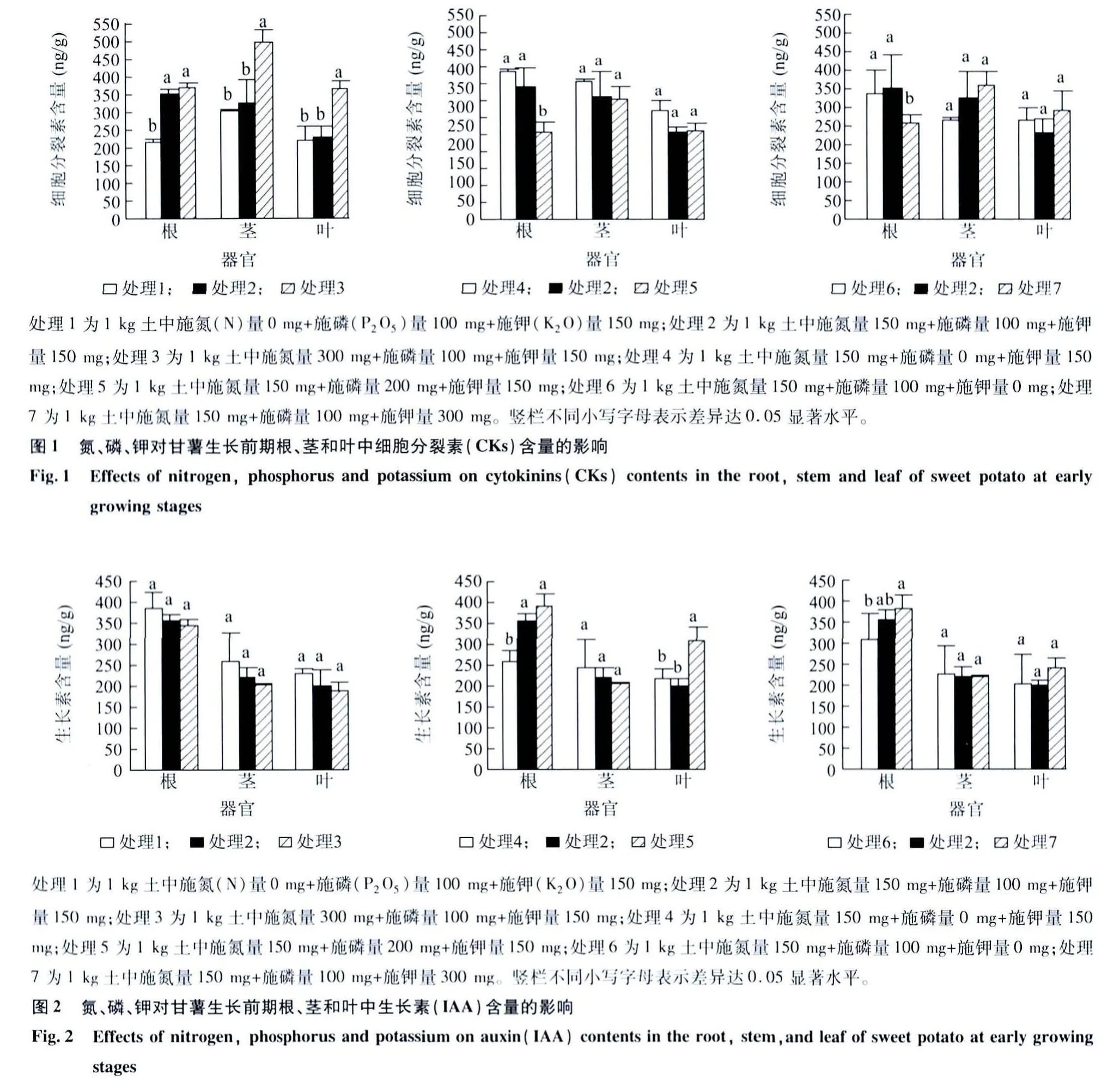
图1所示,与不施氮肥处理(处理1)相比,施氮肥处理(处理2和处理3)可使甘薯生长前期根系细胞分裂素(CKs)含量显著增加63.6%(P<0.05)和73.5%(P<0.05);随着施氮量的增加,茎和叶中CKs含量均呈上升趋势,高氮肥处理下(处理3)分别增加53.3%(P<0.05)和64.2%(P<0.05)。与不施磷肥处理(处理4)相比,施磷处理下(处理2和处理5)根系CKs含量分别减少34.4%(P>0.05)和41.4%(P<0.05);与不施钾肥处理(处理6)相比,施钾肥处理下(处理7)根系CKs含量减少26.6%(P<0.05);磷和钾施用对茎和叶中CKs含量的影响均不显著(P>0.05)。表明施氮可增加甘薯生长前期根系、茎和叶中CKs含量,从而抑制根系生长及促进茎叶生长;磷和钾肥施用则有相反的趋势。
2.5 氮、磷、钾对甘薯生长前期根、茎和叶中生长素含量的影响
图2所示,与不施氮肥处理(处理1)相比,施氮(处理2和处理3)虽可使甘薯生长前期根、茎和叶中生长素含量(IAA)有下降的趋势,但其影响都不显著。与不施磷肥处理(处理4)比较,施磷肥处理(处理2和处理5)可使根系 IAA含量分别提高34.9%(P<0.05)和 50.2%(P<0.05),施磷肥处理的甘薯叶片中IAA含量提高42.5%(P>0.05)和54.0%(P<0.05),但施磷肥处理的甘薯茎中IAA含量却有下降的趋势(P>0.05)。与不施钾肥处理(处理6)相比,施钾肥处理(处理2和处理7)的甘薯根系中的IAA含量提高15.3%(P>0.05)和24.0%(P<0.05),但施钾肥处理对甘薯叶片和茎中IAA含量均没有显著影响。表明施氮对甘薯前期生长的影响可能与IAA在植株体内的分布无关,而施用磷和钾可增加根系中IAA含量从而促进根系生长。
3 讨论
3.1 甘薯生长前期根系生长对氮、磷和钾的响应
作物根系具有固定、吸收、运输、贮存和合成等多种功能,对大多数作物而言,生长前期是根系构建的关键时期,因此在生产上为促进作物后期生长健壮,常常在苗期采取措施控制水肥供应以促使根系向纵深发展[18]。甘薯属于块根作物,根系构建具有显著的特点:属于营养繁殖的匍匐作物,具有较强的发根能力;生长前期根系发生分化,一部分根系贮存功能异常发达并逐渐向块根发展[15]。因此,甘薯根系数量多、分布广,根系构建过程中的主要矛盾不是吸收功能,而是生长前期的根系分化和生长中后期的块根膨大。
作物根系的生长受品种、栽培措施、环境因子等影响,其中土壤养分是影响作物根系生长的主要环境因素[19]。氮、磷和钾对作物根系生长的影响已经有较多研究,适量氮可促进作物根系发育,而缺氮或过量氮对根系生长都不利[19-23]。甘薯根系对氮的响应与上述作物不同,前人研究已经表明甘薯根系的生长和分化与培养液中NO-3的浓度成反比,当培养液中NO-3浓度达到210 mg/kg时,甘薯根系分化完全受到抑制[5-6]。本研究结果显示,即使在碱解氮含量仅为44.14 mg/kg的土壤中,随着施氮量的增加,甘薯根系生物量和根系形态指标(根尖数、根长、根平均直径、根表面积和根体积)均呈显著下降趋势,而且直径大于1.5 mm的分化根的根系形态指标也呈显著下降。因此,可以认为氮是影响甘薯根系前期生长和分化的主要因素之一,生长前期施氮不利于甘薯根系的生长和分化。
磷在土壤中移动性差而土壤属于高度非均质体,因此作物根系对磷的响应常有不一致的报道[24],但大多数研究认为作物缺磷时常常发生根系形态和根型的改变,即根冠比增加及根毛数量增加[25-27];缺磷胁迫下,作物根系通常会产生大量侧根来扩大根系在土壤中的吸收面积[28]。本研究结果显示,随着施磷量的增加,甘薯根系生物量和各项根系形态指标均呈上升趋势,冠根比呈下降趋势,而且施磷可使直径大于1.5 mm的分化根根系形态指标显著增加。表明甘薯根系对磷的响应与大多数作物不同,施磷对甘薯生长前期根系生长和分化均有一定促进作用,这可能与甘薯的根系特点有关。
钾对作物根系生长的影响有比较一致的报道,即在一定范围内,施钾有利于根系的生长[29-30]。甘薯产量形成取决于光合产物向地下部的运输和积累,而钾通常被认为有利于这一过程[31-32],因此,甘薯以喜钾著称。但有报道认为,由于在甘薯根系构建过程中存在2个明显不同的阶段,钾的功能可能存在生长前期与中、后期不一致[1]。本研究中,甘薯生长前期根系生物量和各项根系形态指标也都随着施钾量的增加而呈上升趋势,但施钾对直径大于1.5 mm分化根根系形态无影响,对冠根比也无显著影响,表明施钾并不影响生长前期甘薯根系分化(光合产物在根系中积累),进一步证实了钾对甘薯生长存在前、后功能不一致的可能。
3.2 内源激素含量与分布对甘薯根系前期生长的调控作用
植物激素作为在植物细胞、组织和器官之间传递信息的信使,对作物根系生长具有明显的调控作用[33]。氮、磷和钾可通过影响植物内源激素的合成代谢与分配,从而影响作物的生长发育,对大多数作物而言,当氮素供应水平提高时,植株体内CKs水平也会相应提高[34],缺氮时从根部输出的CKs总量会减少[13],但IAA的合成与运输则与施氮量呈负相关[35-36]。低磷胁迫可导致大麦根系中IAA含量增加,可促进根系生长[37]。随着营养液中钾浓度的增加,棉花根系中玉米素(ZR)和IAA含量均呈增加趋势,可促进根系生长[12];缺钾时水稻根系中 ZR和IAA含量均减少,根系生长受到抑制[38]。本研究中,施氮时甘薯根、茎和叶中CKs含量均增加,而IAA含量均减少,从而导致根系生长受阻、茎和叶生长加速及冠根比增加;施用磷和钾则有相反的趋势。表明甘薯根系前期生长对氮、磷和钾的响应虽然与其他作物存在不同,但氮、磷和钾对甘薯根系生长的影响可能是通过调节植株体内内源激素含量与分布来实现的。
[1]宁运旺,马洪波,许仙菊,等.氮磷钾缺乏对甘薯前期生长和养分吸收的影响[J].中国农业科学,2013,46(3):486-495.
[2]郝玉华.高β-胡萝卜素甘薯品种的组织培养技术研究[J].江苏农业科学,2012,40(12):60-62.
[3]王 欣,谢逸萍,李 强,等.淀粉专用型甘薯新品种徐薯3O的选育及栽培技术[J].江苏农业科学,2012,40(12):122-123.
[4]唐忠厚,李洪民,陆国权.基于近红外光谱的甘薯抗性淀粉含量的快速测定方法[J].江苏农业学报,2011,27(6):1426-1429.
[5]KIM S H,MIZUNO K,SAWADA S,et al.Regulation of tuber formation and ADP-glucose pyrophosphorylase(AGPase)in sweet potato [Ipomoea batatas(L.)Lam.]by nitrate[J].Plant Growth Regulation,2002,37:207-213.
[6]WILSON L A.Stumulation of adventious bud production detached sweet potato leaves by high levels of nitrogen supply[J].Euphytica,1973(22):324-326.
[7]鲍 娟,刘金鑫,陈范骏,等.植物激素在氮磷养分调节根形态建成中的作用[J].植物生理学通讯,2009,45(7):706-710.
[8]SKYLAR A,WU X L.Regulation of meristem size by cytokinin signaling[J].Journal of Integrative Plant Biology,2011,53:446-454.
[9]SU Y H,LIU Y B,ZHANG X S.Auxin-cytokinin interaction regulates meristem development[J].Molecular Plant,2011,4:616-625.
[10]潘 瑶,郑小东,张振华,等.磷胁迫和激素对烟草根系发育的影响及机理研究进展[J].湖南农业科学,2012(4):39-41.
[11]陈波浪,盛建东,蒋平安,等.钾营养对水培棉花氮磷钾分配和3种植物激素含量的影响[J].新疆农业大学学报,2008,31(1):60-63.
[12]马宗斌,王小纯,何建国,等.氮素形态对小麦花后不同器官内源激素含量的影响[J].植物生态学报,2006,30(6):991-997.
[13]TAMAKI V,MERCIER H.Cytokinins and auxin communicate nitrogen availability as long-distance signal molecules in pineapple(Ananas comosus)[J].Journal of Plant Physiology,2007,164:1543-1547.
[14]张庆会,徐步东.试论甘薯块根的生长机理[J].植物学通报,2002,37(8):22-23.
[15]江苏省农业科学院,山东省农业科学院.中国甘薯栽培学[M].上海:上海科学技术出版社,1984:41-45.
[16]王庆美,张立明,王振林.甘薯内源激素变化与块根形成膨大的关系[J].中国农业科学,2005,38(12):2414-2420.
[17]宋爱梅,黄新朋,孙淑斌,等.氮高效水稻品种苗期耐低磷种质的筛选与鉴定[J].中国水稻科学,2010,24(5):479-486.
[18]曹卫星.作物栽培学总论[M].北京:科学出版社,2011:31-32.
[19]平文超,张永江,刘连涛,等.棉花根系生长分布及生理特性的研究进展[J].棉花学报,2012,24(2):183-190.
[20]邱喜阳,王晨阳,王彦丽,等.施氮量对冬小麦根系生长分布及产量的影响[J].西北农业学报,2012,21(1):53-58.
[21]谢志良,田长彦.膜下滴灌水氮耦合对棉花干物质积累和氮素吸收及水氮利用效率的影响[J].植物营养与肥料学报,2011,17(1):160-165.
[22]姜琳琳,韩立思,韩晓日,等.氮素对玉米幼苗生长、根系形态及氮素利用效率的影响[J].植物营养与肥料学报,2011,17(1):247-253.
[23]史正军,樊小林.水稻根系生长及根构型对氮素供应的适应性变化[J].西北农林科技大学学报:自然科学版,2002,30(6):1-6.
[24]张志勇,汤菊香,王素芳,等.氮磷钾对植物侧根生长发育的影响及其生理机制[J].广东农业科学,2009(5):89-91.
[25]陈 磊,王盛锋,刘荣乐,等.不同磷供应水平下小麦根系形态及根际过程的变化特征[J].植物营养与肥料学报,2012,18(2):324-331.
[26]YANG M,DING G D,SHI L,et al.Quantitative trait loci for root morphology in response to low phosphorus stress in Brassica napus[J].Theor Appl Genet,2010,121:181-193.
[27]AKIFUMI S,KENJI K,AKIKO K,et al.Genetic analysis of root elongation induced by phosphorus deWciency in rice(Oryza sativa L.):Wne QTL mapping and multivariate analysis of related traits[J].Theor Appl Genet,2008,117:987-996.
[28]曾后清,朱毅勇,包 勇,等.缺磷胁迫下番茄侧根形成与miR164及 NaCl表达的关系[J].植物营养与肥料学报,2010,16(1):166-171.
[29]JIA Y B,YANG X E,FENG Y,et al.Differential response of root morphology to potassium deficient stress among rice genotypes varying in potassium efficiency[J].J Zhejiang Univ Sci B,2008,9(5):427-434.
[30]潘艳花,马忠明,吕晓东,等.不同供钾水平对西瓜幼苗生长和根系形态的影响[J].中国生态农业学报,2012,20(5):536-541.
[31]郑艳霞.钾对甘薯同化物积累和分配的影响[J].土壤肥料,2004(4):14-16.
[32]史春余,王振林,赵秉强,等.钾营养对甘薯某些生理特性和产量形成的影响[J].植物营养与肥料学报,2002,8(1):81-85.
[33]武维华.植物生理学[M].北京:科学出版社,2003:90-99.
[34]SAKAKIBARA H,TAKEI K,HIROSE N.Interactions between nitrogen and cytokinin in the regulation of metabolism and development[J].Trends in Plant Science,2006,11:440-448.
[35]FORDE B,LORENZO H.The nutritional control of root development[J].Plant and Soil,2001,232:51-68.
[36]TIAN Q,CHEN F,LIU J,et al.Inhibition of maize root growth by high nitrate supply is correlated with reducted IAA levels in roots[J].Journal of Plant Physiology,2008,165(9):942-951.
[37]刘 辉,王三根.低磷胁迫对大麦内源激素的影响[J].西南农业大学学报,2003,25(1):48-51.
[38]库文珍,彭克勤,张雪芹,等.低钾胁迫对水稻苗期矿质营养吸收和植物激素含量的影响[J].植物营养与肥料学报,2009,15(1):69-75.

