纳米TiO2基绿原酸印迹聚合物的制备及其吸附研究
谭先周,李 辉,,逯翠梅,李 贵
(1 吉首大学植物资源保护与利用湖南省高校重点实验室,湖南 吉首 416000;2 吉首大学化学化工学院,湖南 吉首 416000)
分子印迹识别的高选择性来源于印迹聚合物基体中大量在大小、形状及功能基等方面与目标分子相匹配的结合位点[1]。印迹位点的这一特性展现了分子印迹技术在萃取分离、催化合成、色谱分析、毛细管电泳、药物缓释及传感器等方面的优异特性和美好前景[2-7],但分子印迹技术在实际应用中仍受到诸多因素的影响和制约,人们在不断探寻新的制备技术以改善印迹识别效能,并提高其实际适用 性[8-9]。以纳米TiO2、硅胶等材料为载体的表面印迹技术近年来受到了研究者们的关注和重视[10-14]。绿原酸是金银花、杜仲等植物中的一种多酚化合物,具有抗菌、抗病毒、清除自由基等生物活性[15]。本文作者以纳米TiO2为牺牲材料、绿原酸为模板、甲基丙烯酸(MAA)为功能单体、二甲基丙烯酸乙二醇酯为交联剂制备了绿原酸印迹聚合物,并探讨了其吸附效能。
1 实验部分
1.1 试剂与材料
标准绿原酸(CGA,98%)和咖啡酸(CA,98%)购自中国药品生物制品检定所。其分子结构示于 图1。甲基丙烯酸(MAA)和二甲基丙烯酸乙二醇酯(EGDMA)来自Sigma 公司。偶氮二异丁腈(AIBN,天津市科密欧化学试剂开发中心),氢氟酸(HF)、三氯甲烷、冰乙酸(湖南汇虹试剂有限公司),甲醇(AR,天津富宇精细化工有限公司),乙腈(AR,天津市光复精细化工研究所)。Nano-TiO2(纯度为99%,200 nm)购自上海汇精纳米材料有限公司。杜仲叶采自湖南慈利县江垭林场。杜仲叶甲醇提取物按如下方法制备:称取5.0 g干燥的杜仲叶,粉碎,用三氯甲烷回流30 min,过滤,残渣再用甲醇提取20 min,过滤后的滤液置于冰箱中备用。

图1 绿原酸及咖啡酸的分子结构
1.2 仪器与设备
FA2004 电子天平(上海精科天平公司)、KQ-250E 超声振荡器(昆山市超声仪器有限公司)、LC-20A 高效液相色谱(日本岛津公司)用于定性定量分析,WGH-30A 红外光谱仪(上海勇规分析仪器有限公司)用于测定聚合物的红外光谱。S-3400扫描电镜用于观测聚合物的表面形貌。
1.3 分子印迹聚合物的制备
1.3.1 纳米TiO2表面制备分子印迹聚合物(T-MIP)
将1.0 mmol 绿原酸和4.0 mmol MAA 溶解到装有10 mL 乙腈的50 mL 圆底烧瓶中,超声处理2 min,通氩气5 min。混合物溶液静置30 min 后,加入240 mg 纳米TiO2,室温下搅拌2 h 后,加入16 mmol EGDMA 和0.1 mmol AIBN,得到预聚合混合物。通入氩气10 min,然后置于60 ℃水浴中,反应24 h(保持通氩气),冷却到室温,得疏松块状聚合物。聚合物依次用甲醇-乙酸混合液(体积比为8∶2)、乙醇和乙腈洗脱,直至洗脱液中检测不出模板分子。将聚合物置于真空干燥箱中于323 K 干燥后,稍加研磨得颗粒状分子印迹聚合物T-MIP。不加模板,按照同样的步骤制得非印迹聚合物T-NIP。
1.3.2 制备中空分子印迹聚合物H-MIP
将如上制备的聚合物T-MIP 和T-NIP 分别装入聚乙烯塑料烧杯中,加入3 mL 丙酮润湿,再加入20 mL40%的HF,充分搅拌,反应20 h 后加入50 mL去离子水,过滤,用去离子水洗涤聚合物至洗脱液呈中性。固体物质于60 ℃真空干燥,得到脱除了纳米TiO2基质的中空分子印迹聚合物H-MIP 和非印迹聚合物H-NIP。制备过程如图2 所示。
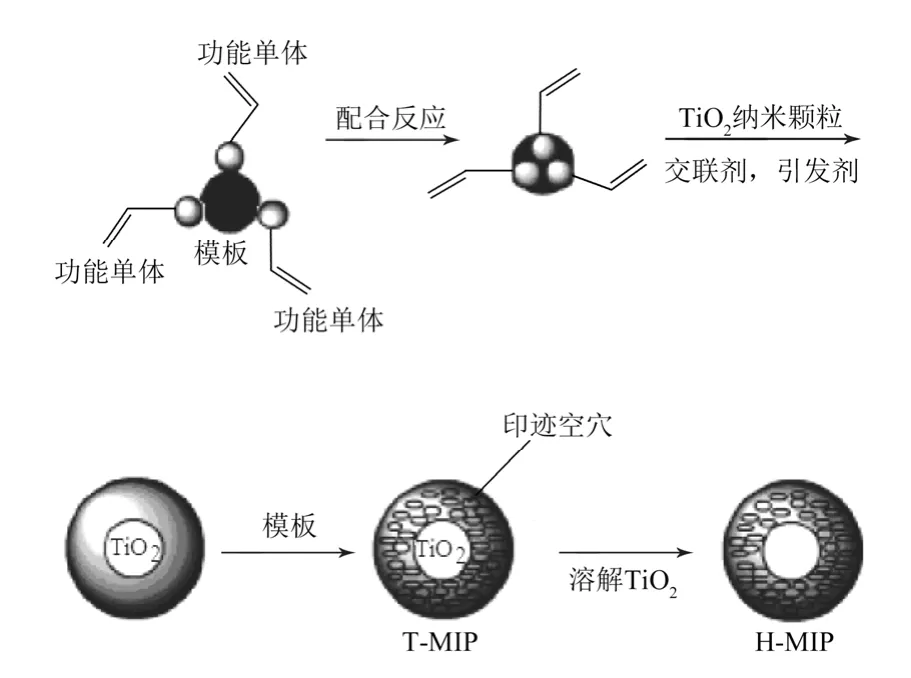
图2 分子印迹聚合物制备流程
1.4 等温吸附
将10 mg 分子印迹聚合物T-MIP、H-MIP、T-NIP或H-NIP 分别加入到10 mL 不同浓度的绿原酸乙腈溶液中(绿原酸浓度分别为0.01 mmol/L、0.02 mmol/L、0.04 mmol/L、0.06 mmol/L、0.08 mmol/L、0.10 mmol/L、0.15 mmol/L、0.20 mmol/L、0.30 mmol/L、0.40 mmol/L),静态吸附4 h 后,过滤,滤液用乙腈定容到5 mL,测试滤液中绿原酸浓度,由式(1)计算平衡吸附量qe(μmol/g)。
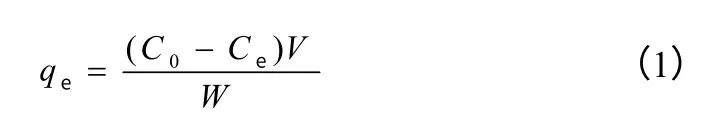
式中,C0为吸附质初始浓度,mmol/L;Ce为平衡浓度,mmol/L;W 为聚合物质量,g;V 为溶液体积,mL。
1.5 吸附选择性
通过测定中空分子印迹聚合物H-MIP 和非印迹聚合物H-NIP 对模板及结构类似物咖啡酸的静态吸附量来研究分子印迹聚合物的选择识别能力。测试时,底物初始浓度为0.1 mg/mL-1,吸附4 h 后,高效液相色谱测定溶液中底物浓度。分布系数(Kd,mL/g)定义为式(2)。

印迹聚合物对模板的选择系数(k)和相对选择系数(k′)分别定义为式(3)、式(4)。

式中,Kd(template)和 Kd(analogue)分别为模板及类似物的分布系数;MIPk 和NIPk 分别是印迹聚合物和非印迹聚合物的选择系数。
1.6 样品固相萃取
称取20 mg 分子印迹聚合物H-MIP,填入微固相萃取器中。取10 mL 杜仲叶的甲醇提取液,分成两份,每份5 mL。其中一份流经微固相萃取器,收集滤液定容到5 mL;另一份作为对照。用高效液相色谱分析甲醇提取液和固相萃取滤液中的绿原酸 含量。
1.7 高效液相色谱分析
高效液相色谱用于定性和定量分析。C18 柱(250 mm×4.6 mm,5 μm)为分离柱,甲醇-水-乙酸(20.3∶78.7∶1.0,体积比)混合物为流动相,流速为1.0 mL/min。进样体积为10 μL,检测波长为278 nm。每次测定重复2 次,标准曲线法用于 定量。
2 结果与讨论
2.1 分子印迹聚合物的结构表征
2.1.1 红外光谱分析
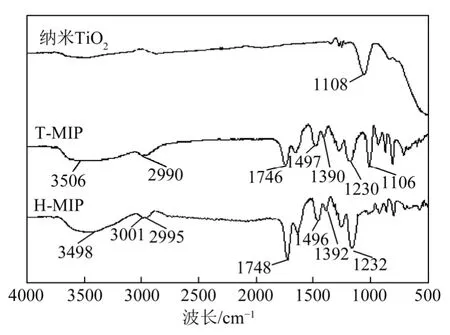
图3 纳米二氧化钛、印迹聚合物T-MIP 和H-MIP 的傅里叶红外光谱
图3 给出了纳米TiO2、分子印迹聚合物T-MIP 和H-MIP 的傅里叶红外光谱图。波数1108 cm-1处是TiO2分子中的Ti—O 伸缩振动吸收峰,当分子印迹聚合物在纳米TiO2表面制备后,该吸收峰移到1106 cm-1处,而除去TiO2后的H-MIP 中,该吸收峰消失。T-MIP 红外光谱中,波数3506 cm-1和2990 cm-1分别为羟基—OH 的O—H 伸缩振动和亚甲 基—CH2—中C—H 伸缩振动吸收,波数1746 cm-1、1497 cm-1、1390 cm-1和1230 cm-1处分别对应于C=O、C=C、C—C 及C—O 键伸缩振动吸收。对于中空的分子印迹聚合物,羟基O—H 伸缩振动移动到3498 cm-1,亚甲基中的C—H 伸缩振动在3001 cm-1和2995 cm-1出现两个吸收峰,而C=O、C=C、C—C 及C—O 键伸缩振动吸收则分别移到1748 cm-1、1496 cm-1、1392 cm-1和1232 cm-1处。该光谱显示了在纳米TiO2表面的成功印迹及纳米TiO2作为牺牲材料的有效去除。
2.1.2 电镜分析
印迹聚合物T-MIP 和非印迹聚合物T-NIP 及去除纳米TiO2基质后的中空分子印迹聚合物(H-MIP)和非印迹聚合物(H-NIP)的电镜图示于图4 中。可以看到,溶解纳米TiO2前,聚合物颗粒大小分布不均,形状不规则,这可能是由于预聚合体系中存在多种相互作用及生成了一些低聚物而引起的。而当纳米TiO2被去除后,H-MIP 和H-NIP 均显示了大量的小空洞,印迹位点分布于这些小空洞中,印迹位点及大量空穴的形成有利于分子印迹聚合物对目标分子的选择吸附。
2.2 聚合物的吸附性能
2.2.1 等温吸附
图5 显示了分子印迹聚合物(T-MIP 和H-MIP)及非印迹聚合物(T-NIP 和H-NIP)的吸附等温线。可以发现,当底物浓度相同时,中空分子印迹聚合物H-MIP 吸附量最大,远高于H-NIP 的吸附能力,这是由于H-MIP 表面存有大量与模板分子匹配的 键合位点。另外,H-MIP 的吸附能力也高于T-MIP,这主要是由于溶解支持物后,生成了大量的微孔穴,印迹位点易于裸露出来,促进了印迹聚合物对模板分子的吸附;同时,聚合物颗粒变小,比表面积增大,有利于吸附。

图4 印迹聚合物及非印迹聚合物的扫描电镜图
为探究中空分子印迹聚合物H-MIP 的表面结合位点分布及位点均匀程度,分别用Langmuir 和Freundlich 模型对H-MIP 的实验吸附等温线进行 拟合。见式(5)、式(6)。
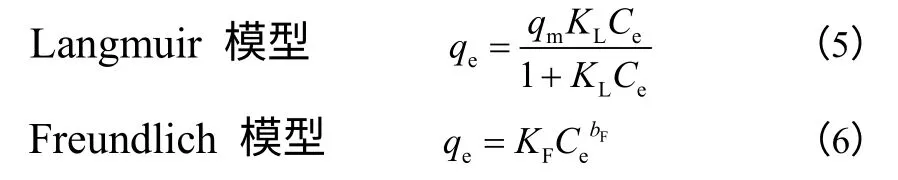
式中,Ce为绿原酸的平衡浓度,mmol/L;qe为平衡吸附量,μmol/g;qm和KF为最大吸附量,μmol/g;KL为Langmuir 吸附常数,L/mmol;bF为吸附强度系数。
图6 给出了H-MIP 的实验等温吸附值及两种模型的拟合曲线。实点为H-MIP 的实验吸附点,线为拟合曲线。拟合程度的好坏用R2来评价,其值越小表明拟合程度越好。
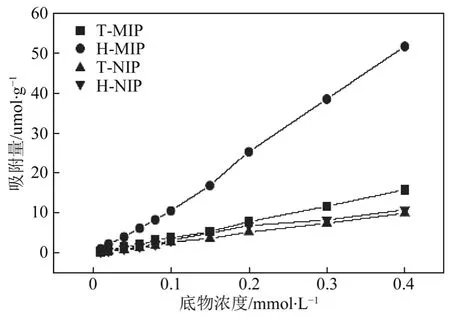
图5 分子印迹聚合物(T-MIP 和H-MIP)及非印迹聚合物(T-NIP 和H-NIP)的吸附等温线
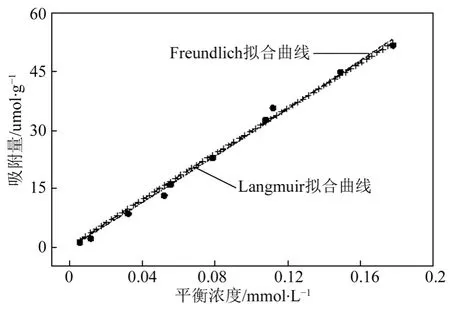
图6 H-MIP 实验吸附等温值(实点)及Langmuir(短虚线)和Freundlich(加号线)拟合曲线

式中,qi,Theory和 qi,Experimental分别是理论值和实验值;n 为实验点个数。
2.3 样品应用
图7 显示了杜仲叶甲醇提取液及其用分子印迹聚合物(H-MIP)吸附后滤液的高效液相色谱图。保留时间20.88 min 和28.5 min 的峰分别是绿原酸和咖啡酸。通过比较两图可以发现,杜仲叶的甲醇提取液经分子印迹聚合物吸附后,绿原酸和咖啡酸的峰高均大幅降低,表明了印迹聚合物对目标物绿原酸的高效吸附性能。

表1 分子印迹聚合物H-MIP 实验吸附等温值及Langmuir和Freundlich 拟合参数
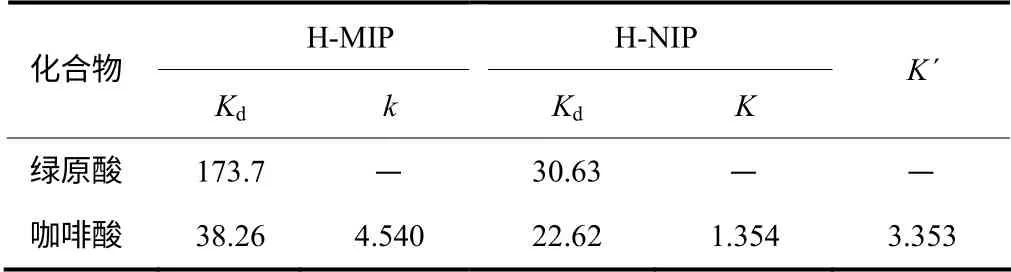
表2 分子印迹聚合物H-MIP 和非印迹聚合物H-NIP 对模板的选择识别

图7 杜仲叶甲醇初提液及分子印迹聚合物(H-MIP)吸附后滤液的HPLC 图
3 结 论
以TiO2为牺牲材料制备了绿原酸印迹聚合物(T-MIP、H-MIP)及非印迹聚合物面(T-NIP、H-NIP),用傅里叶红外光谱和扫描电镜对聚合物进行结构表征。通过静态吸附研究,发现中空分子印迹聚合物H-MIP 对模板分子具有较强的吸附能力和较高的吸附选择性(相对选择系数为3.353)。Freundlich 模型比Langmuir 模型更适合描述H-MIP对模板的吸附行为。另外,将分子印迹聚合物H-MIP用于对杜仲甲醇提取液的绿原酸进行固相微富集时,表现了较好的吸附效果。但中空分子印迹聚合物中印迹位点、空穴数目与吸附容量间的关系及支持载体TiO2对H-MIP 结构和性能的影响仍有待进一步研究。
[1] David A S. Optimization,evaluation,and characterization of molecularly imprinted polymers [J]. Adv. Drug Delivery Rev.,2005,57:1779-1794.
[2] Mohamed R,Mottier P,Treguier L,et al. Use of molecularly imprinted solid-phase extraction sorbent for the determination of four5-nitroimidazoles and three of their metabolites from egg-based samples before tandem LC-ESIMS/MS analysis [J]. J. Agric. Food Chem.,2008,56:3500-3508.
[3] 左华敏,李雁,李璐,等. 二步种子溶胀法制备氯霉素分子印迹聚合物微球及其识别性能[J]. 化工进展,2011,30(3):589-597.
[4] 洪英,钟泽辉,郭宾. 壳聚糖印迹聚合物对Zn2+的吸附动力学 [J]. 化工进展,2011,30(6):1296-1302.
[5] Shiho T,Hiroshi S,Tsutomu N. Review:Micro- and nanosized molecularly imprinted polymers for high-throughput analytical applications [J]. Anal. Chim. Acta,2009,641:7-13.
[6] Song S H,Shirasaha K,Katayama M,et al. Recognition of solution structures of peptides by molecularly imprinted cyclodextrin polymers [J]. Macromolecules,2007,40:3530-3532.
[7] 李辉,符再德,石慧,等. 沉淀聚合法制备高三尖杉酯碱印迹聚合物 [J]. 化工进展,2009,28(10):1787-1792.
[8] Kan X,Zhao Q,Zhang Z,et al. Molecularly imprinted polymers microsphere prepared by precipitation polymerization for hydroqunone recognition [J]. Talanta,2008,75:22-26.
[9] Gao D ,Zhang Z ,Wu M ,et al. A surface functional monomer-directing strategy for highly dense imprinting of TNT at surface of silica nanoparticles [J]. J. Am. Chem. Soc.,2007,129:7859-7866.
[10] Claudio B,Patrizia B,Cristina G,et al. Binding behaviour of molecularly imprinted polymers prepared by a hierarchical approach in mesoporous silica beads of varying porosity [J]. J. Chromatogr. A,2011,1218:1828-1834.
[11] Qin L,He X W,Li W Y,et al. Molecularly imprinted polymer prepared with bonded-cyclodextrin and acrylamide on functionalized silica gel for selective recognition of tryptophan in aqueous media [J]. J. Chromatogr. A,2008,1187:94-102.
[12] Kan X W,Geng Z R,Wang Z L,et al. Core-shell molecularly imprinted polymer nanospheres for the recognition and determination of hydroquinone[J]. J. Nanosci. Nanotechnol.,2009,9:2008-2013.
[13] Xu W Z,Zhou W,Xu P P,et al. A molecularly imprinted polymer based on TiO2as a sacrificial support for selective recognition of dibenzothiophene[J]. Chem. Engineer J.,2011,172:191-198.
[14] 徐菲菲,段玉清,张海晖,等. 表面分子印迹聚合物载体研究新进展 [J]. 化工进展,2011,30(5):1033 -1040.
[15] 高锦明,张鞍灵,张康健,等. 绿原酸分布、提取与生物活性研究综述[J]. 西北林学院学报,1999,14(2):73-82.

