NaCl胁迫对胡卢巴幼苗光合生理特性的影响
李 慧,彭立新,于玮玮,冯 涛,阎国荣
(天津农学院园艺系,天津 300384)
胡卢巴(Trigonella foenum-graecumL.),又名香豆子、香苜蓿、卢巴子,为豆科蝶形花亚科胡卢巴属一年生草本植物,全株有香气,是一种使用历史悠久的传统药材[1]。其叶作香料,种子具有温肾、散寒、止痛作用。从胡卢巴种子中提取的胡卢巴胶,可替代进口瓜儿胶,是国内石油行业最理想的压裂稠化剂之一[2]。
土壤盐渍化严重影响农业生产和土地生产力,已成为全球关注的严峻问题[3]。利用适宜耐盐植物对盐渍土进行生物改良,不仅能够使土壤迅速脱盐,且能够改善土壤养分状况和化学性质,提高土壤肥力[4]。已有研究表明,胡卢巴具有一定的耐盐性[5-6],同时,胡卢巴根系发达、具根瘤,可以用于保持水土、改良土壤等,具有改良盐碱地的潜力。盐胁迫既可以直接影响植物生长,也可以通过抑制光合作用而间接影响生长。因此,研究盐胁迫如何影响植物的光合作用及光合作用对盐渍环境的适应机理具有重要意义。本试验以胡卢巴幼苗为试验材料,探讨不同浓度NaCl胁迫对胡卢巴幼苗光合生理特性的影响,为胡卢巴在盐碱地区推广提供参考。
1 材料与方法
1.1 材料
胡卢巴(Trigonella foenum-graecumL.)种子,采收于天津市大港区中塘镇马圈村。
1.2 方法
挑选饱满的胡卢巴种子进行催芽处理。待种子发芽后挑选整齐度一致、长势较好的幼苗植株转移至装有基质(蛭石∶草炭土∶砂子=1∶1∶1,基质含盐量为0.012%,可忽略不计)的花盆中,每盆10株,每天浇灌Hoagland营养液。待其第三羽状复叶充分展开时,选取生长状况一致、无病虫害的植株进行盐胁迫处理。分别用含0、0.2%、0.5%和1.0%NaCl的Hoagland营养液对胡卢巴幼苗进行盐胁迫处理,为防止盐冲击,每天递增盐浓度直至预定浓度,使其达到试验要求盐分浓度。每个处理3次重复。从达到预定盐胁迫浓度开始处理7 d后,每盆取整齐度一致的幼苗3株,测定生理指标。
1.3 测定项目及方法
1.3.1 叶片光合参数的测定
采用手持式光合作用测定系统(CI-340,美国)测定从下往上数第二羽状复叶功能叶片的净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)和胞间CO2浓度(Ci)等,3次重复。
1.3.2 叶绿素含量及细胞膜伤害度的测定
叶绿素含量测定采用分光光度法,叶片细胞膜伤害度的测定采用电导法[7]。
2 结果与分析
2.1 NaCl胁迫对胡卢巴幼苗光合参数的影响
净光合速率是体现光合系统功能,衡量植株光合能力强弱的重要指标。由表1可知,随着NaCl胁迫程度增加,净光合速率(Pn)、蒸腾速率(Tr)和气孔导度(Gs)都呈下降趋势。盐胁迫对胡卢巴幼苗的净光合速率有显著影响,各处理的净光合速率值较对照均降低,且差异达极显著水平。0.2%NaCl处理下,净光合速率(Pn)比对照降低34.5%;0.5%和1.0%NaCl处理下,净光合速率(Pn)比对照降低47.8%和68.4%。各处理的蒸腾速率(Tr)和气孔导度(Gs)与对照也存在显著性差异(P<0.05)。0.2%、0.5%和1.0%NaCl浓度处理下,蒸腾速率(Tr)和气孔导度(Gs)分别比对照降低14.6%和28.7%、38.2%和52.9%、57.5%和69.0%。胞间CO2(Ci)浓度在0.2%和0.5%NaCl处理下均下降,且与对照存在极显著差异(P<0.01);随后,在1.0%NaCl处理下胞间CO2(Ci)浓度有所增加,但浓度仍小于对照和0.2%NaCl处理。
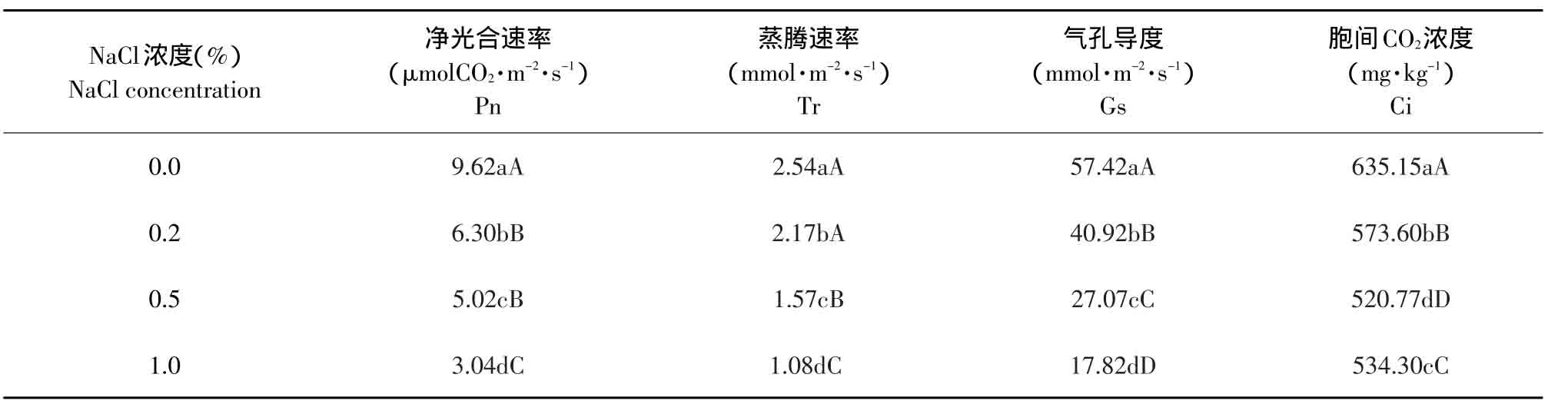
表1 NaCl胁迫对胡卢巴光合参数的影响Table 1 Effect of NaCl stress on photosynthetic parameters of Trigonella foenum-graecum L.
2.2 NaCl胁迫对胡卢巴幼苗光合色素含量的影响
由表2可知,胡卢巴幼苗叶片叶绿素a含量、叶绿素b含量和叶绿素a+b含量均随盐胁迫浓度的增加呈先增加后降低趋势,在0.5%NaCl浓度处理时达到峰值,随后在1.0%NaCl浓度处理时含量降低。可见,较低的盐浓度并不影响胡卢巴叶片的光合潜力;当盐浓度超过0.5%时,叶绿素含量出现下降,表明光合潜力受到抑制。在1.0%NaCl浓度处理下叶绿素a+b含量和叶绿素a含量仍显著高于对照,而叶绿素b含量急剧下降至低于对照。叶绿素a/b比值则呈递增趋势。
2.3 NaCl胁迫对细胞膜伤害度的影响
细胞膜透性(以相对电导率表示)可间接反应细胞膜的伤害度。测定结果显示(见图1),随着NaCl处理浓度的增大,胡卢巴幼苗细胞膜伤害度呈显著上升趋势,说明盐分胁迫对胡卢巴叶片细胞膜造成一定伤害。NaCl胁迫浓度由0.2%升至0.5%时,细胞膜伤害度迅速由1.06%上升到6.32%;处理浓度由0.5%上升至1.0%时,细胞膜伤害度增加较为缓慢,达7.81%。

表2 NaCl胁迫对胡卢巴光合色素含量的影响Table 2 Effect of NaCl stress on photosynthetic pigments content of Trigonella foenum-graecum L.
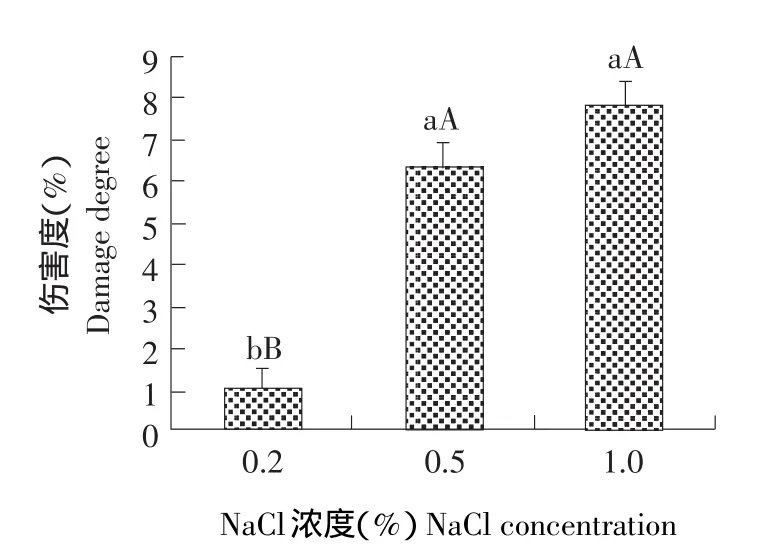
图1 NaCl胁迫对胡卢巴叶片细胞膜伤害度的影响Fig.1 Effect of NaCl stress on cell membrane damage degree in leaves of Trigonella foenum-graecum L.
3 讨论
光合作用是维持植物正常生长并获得产量的重要生理代谢过程。前人研究表明[8-12],盐胁迫在一定程度上会抑制植物光合作用,主要体现在:①土壤中高浓度的盐分会降低土壤水势,使植物吸水困难,造成气孔开度减少,光合机构受破坏等;②盐分过多使RuBP羧化/加氧酶等酶活性降低,叶绿体趋于分解,叶绿素和类胡萝卜素生物合成受干扰等,光合作用受到抑制;③盐分过多造成植物细胞膜透性增加,电解质等内容物外渗;此外,盐碱土中Na+、Cl-等含量过高,会引起K+、HPO42-等离子缺乏,使植物营养失调。
本研究表明,随着NaCl胁迫浓度增加,胡卢巴幼苗净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)均呈下降趋势,而胞间CO2浓度(Ci)则表现为先降后增趋势。在NaCl处理浓度为0.2%和0.5%时,胞间CO2浓度(Ci)表现为下降趋势,说明低盐浓度下由于气孔导度下降,阻止CO2供应,使净光合速率(Pn)和蒸腾速率(Tr)都逐渐下降,即气孔限制起作用;而当处理浓度增加到1.0%时,叶肉细胞光合能力下降,使其固定CO2能力降低,从而导致胞间CO2浓度升高[13-14]。这与前人研究结果一致[15-17]。
有研究表明,低钠盐可以增加植物体内叶绿素含量[18-21]。在0.2%和0.5%NaCl浓度胁迫下,植物体通过增加叶绿素含量来维持光合作用,避免净光合速率过度下降,表明胡卢巴具有一定耐盐性。而当盐胁迫增加至1.0%时,叶绿素含量均下降,叶绿素b和叶绿素a+b含量下降达显著或极显著水平(与0.5%处理相比),主要是由于叶绿素酶对叶绿素b的降解所致[12]。这说明,高盐胁迫下叶肉细胞的叶绿素合成小于分解,导致光合能力下降而使净光合速率降低。
植物遭受盐胁迫时,首先会导致细胞膜受到伤害,使细胞膜通透性增大,细胞内电解质等内容物大量外渗,外渗液电导率增大。因此,细胞膜透性的大小可反映膜受伤害的程度[22]。本试验结果显示,随NaCl浓度增大,胡卢巴幼苗细胞膜伤害度虽呈上升趋势,但当1.0%NaCl浓度处理时,细胞膜伤害度仍小于8%。这与作者前期测定NaCl对胡卢巴幼苗抗氧化酶活性和丙二醛含量影响的试验结果吻合[6]。当NaCl浓度在1.0%以下时(包括1.0%),叶片细胞可通过加强抗氧化酶系统功能来消除盐胁迫产生的过量自由基,降低膜脂过氧化作用,从而减轻对细胞膜伤害,使细胞膜伤害度维持在较低水平。进一步表明胡卢巴具有耐盐性,具备在盐碱地推广潜力。
4 结论
a.随着盐胁迫程度增加,净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)都呈下降趋势;胞间CO2(Ci)浓度先降低,随后在1.0%NaCl浓度处理下有所增加。导致净光合速率下降的主导因素在NaCl浓度达到1.0%之前是气孔限制,之后为非气孔限制。
b.随着盐胁迫程度的增加,胡卢巴幼苗叶绿素含量呈现先升后降趋势,在0.5%NaCl浓度处理下达最大值;叶绿素a/b比值则一直呈增加趋势。
c.胡卢巴幼苗叶片细胞膜伤害度随盐胁迫程度的增加而增加,但在1.0%NaCl浓度处理下仍维持在小于8.0%水平。
[1]中国医学科学院药用植物资源开发研究所.中国药用植物栽培学[M].北京:农业出版社,1991:876.
[2]王盾,张红燕,朱华,等.国内外胡芦巴研究开发现状[J].宁夏农林科技,2001(6):42-44.
[3]Robert C.Methods for analysis by farmers:The professional challenge[J].Journal for Fanning Systems Research Extension,1993,4(1):87-101.
[4]赵可夫,范海,江行玉,等.盐生植物在盐渍土壤改良中的作用[J].应用与环境生物学报,2002,8(1):31-35.
[5]李慧,张璐,彭立新,等.NaCl胁迫对胡芦巴种子萌发及幼苗生长的影响[J].天津农学院学报,2008,15(2):24-26.
[6]李慧,王妙媛,彭立新,等.NaCl胁迫对胡卢巴幼苗抗氧化酶活性和丙二醛含量的影响[J].华北农学报,2012,27(2):185-188.
[7]赵世杰.植物生理学实验指导[M].北京:中国农业科学技术出版社,2002:55-57,130-131.
[8]王素平,郭世荣,李璟,等.盐胁迫对黄瓜幼苗根系生长和水分利用的影响[J].应用生态学报,2006,17(10):1883-1888.
[9]陈健妙,郑青松,刘兆普,等.麻疯树(Jatropha curcasL.)幼苗生长和光合作用对盐胁迫的响应[J].生态学报,2009,29(3):1356-1365.
[10]孙广玉,侯晨.盐碱土条件下马蔺幼苗渗透调节物质和光合特性对干旱的响应[J].水土保持学报,2008,22(2):202-205.
[11]王忠.植物生理学[M].北京:中国农业出版社,2008:553.
[12]朱新广,张其德.NaCl对光合作用影响的研究进展[J].植物学通报,1999,16(4):332-338.
[13]Farquhar G D,Sharkey T D.Stomatal conductance and photosynthesis[J].ANN Rev Plant Physiol,1982,33:317-345.
[14]Satoh K,Smith C M,Fork D C.Effect of salinity on primary processes of photosynthesis in the red algaPorphyra perforata[J].Plant Physiology,1983,73:643-647.
[15]张会慧,张秀丽,李鑫,等.NaCl和Na2CO3胁迫对桑树幼苗生长和光合特性的影响[J].应用生态学报,2012,23(3):625-631.
[16]马进.滨柃幼苗(Eurya emarginata)对NaCl胁迫的生理响应[J].东北农业大学学报,2011,42(10):110-113.
[17]惠红霞,许兴,李守明.宁夏干旱地区盐胁迫下枸杞光合生理特性及耐盐性研究[J].中国农学通报,2002,18(5):29-34.
[18]Munns R,Temmat A.Whole-plant responses to salinity[J].Australian Journal of Plant Physiology,1986(13):143-160.
[19]Matoh T,Murata S.Sodium stimulates growth ofPanicum coloratlzmthrough enhanced photosynthesis[J].Plant Physiology,1990(92):1169-1173.
[20]李龙梅,王瑞刚.盐胁迫对射干和鸢尾2种地被植物理化特性的影响[J].中国农学通报,2012,28(7):181-184.
[21]郭艳超,孙昌禹,王文成,等.NaCl胁迫对芙蓉葵种子萌发和种苗生长的影响[J].西北农业学报,2012,21(3):158-163.
[22]肖雯,贾恢先,蒲陆梅.几种盐生植物抗盐生理指标的研究[J].西北植物学报,2000,20(5):818-825.

