小地老虎几丁质脱乙酰基酶基因的克隆与原核表达
樊 东,郭博智,高艳玲,赵奎军,王晓云
(东北农业大学农学院,哈尔滨 150030)
昆虫几丁质脱乙酰基酶(Chitin deacetylase,CDA,EC 3.5.1.41)是昆虫体内一类重要几丁质结合蛋白,可分布在虫体内多个含几丁质成分组织结构中,可将几丁质修饰为壳聚糖,在昆虫生长、发育和代谢中具有重要作用[1]。根据功能域不同,把昆虫CDA分为5类(Group)。第1类包含CDA结构域、ChBD结构域,还含有LDLa结构域;第2类结构域与第1类的CDA一致,但是序列差异大;第3类和第4类都具有CDA与ChBD结构域,不含有LDLa结构域,但是第3类和第4类CDA的结构域在CDA上的位置存在较大程度差异,第5类CDAs只含有CDA结构域,不具有ChBD与LDLa结构域。棉铃虫中克隆得到3个CDA基因分别属于2个不同的CDA类型,Group I和Group V;粉纹夜蛾和蓓带夜蛾中的CDA属于Group V;家蚕中的2个CDA属于Group I;赤拟谷盗中克隆的9个CDA属于5个不同的类型Group I到Group V;苜蓿夜蛾中CDA属于Group V,而甘蓝夜蛾的CDA则属于Group I和Group V[2-4]。目前鳞翅目昆虫克隆的CDA主要集中在Group I和Group V中。
昆虫中CDA功能了解不多,有些功能还局限于推测阶段,并没有得到试验验证。目前对粉纹夜蛾(Trichoplusia ni)、棉铃虫(Helicoverpa armigera)、蓓带夜蛾(Mamestra configurata)和赤拟谷盗(Tribolium castaneum)等几种昆虫的CDA活性和功能进行研究。粉纹夜蛾CDA研究表明,幼虫肠中的CDA只在幼虫取食期表达,当幼虫停止取食时,中肠中的CDA表达也随之停止,其功能可能与围食膜的更新密切相关[5]。蓓带夜蛾CDA在大肠杆菌中表达的蛋白具有酶活性,同时在虫体内也检测到CDA活性[6]。蓓带夜蛾CDA的研究结果推测CDA的作用可能是参与改变围食膜中几丁质的物理和化学性质,而这一生化活动不仅改变几丁质纤维结构,且对围食膜蛋白的结合程度、围食膜的完整性和孔隙率产生影响[1]。在黑腹果蝇(Drosophila melanogaster)中,克隆得到2个能编码具有典型CDA功能域的CDA,通过气管上几丁质的脱乙酰基限制气管延长[7-8]。对赤拟谷盗(Tribolium castaneum)中的9个CDA进行研究,TcCDA1和TcCDA2在表皮细胞内表达,TcCDA1还在幼虫气管中表达,TcCDA6到TcCDA9在中肠内特异性表达,TcCDA3在胸部肌肉内表达,TcCDA4则在早期的成虫附肢内表达,甘蓝夜蛾的2个CDA均可在中肠内表达,但其中一种CDA亦可在其他组织中进行表达[9]。可见CDA功能可能存在多样性[1]。随着越来越多CDA从不同昆虫中克隆出来,有必要对昆虫CDA进行深入的功能和相关机理研究。
小地老虎(Agrotis ipsilonHufnagel)属鳞翅目夜蛾科,为世界性害虫,在我国各地都有分布,食性杂,能危害36科100多种植物。轻发生时造成缺苗断垄,重发生时田块可造成几乎无苗或毁种[10]。本研究对小地老虎几丁质脱乙酰基酶基因cDNA进行克隆,获取基因cDNA全长序列,并对该基因在大肠杆菌中的表达进行研究,为该基因进一步研究和应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 供试昆虫
供试昆虫为小地老虎,利用黑光灯在田间诱集成虫,室内饲以5%蜂蜜水使其产卵并用大豆叶作饲料喂养到不同发育阶段备用。
1.1.2 主要试剂及菌株
RNA提取试剂盒TRIzol®Reagent购自Invitrogen公司;反转录酶M-MLV Reverse Transcriptase、蛋白 Marker、低熔点琼脂糖购自 Fermentas(FBI)公司;T4DNA连接酶、克隆载体pMD18-T、DNA胶回收试剂盒、DL2000 DNA Marker、TaKaRa 5'-Full RACE Kit购自TaKaRa公司,其余试剂为进口或国产分析纯;受体菌DH5α、BL21、载体PET21b由本研究室保存。
1.2 方法
1.2.1 总RNA的提取
将小地老虎五龄幼虫转移到研磨器中,按每100 mg虫体加入TRIzol®Reagent 1 mL进行研磨,提取RNA,具体步骤参见TRIzol试剂盒使用说明,提取得到的RNA放入-80℃冰箱中备用。
1.2.2 第一链cDNA的合成
以 dt-Adapter: 5'GACTCGAGTCGACATCGA(T)173'为cDNA合成引物,利用反转录酶M-MLV Reverse Transcriptase合成第一链cDNA,具体参照M-MLV反转录酶使用说明。
1.2.3 利用RT-PCR技术克隆基因cDNA序列片段
比较棉铃虫(Helicoverpa armigera,EU325568)、苜蓿夜蛾(Heliothis viriplaca,GU188855)两种昆虫几丁质脱乙酰基酶基因的cDNA序列,设计1对适用于克隆小地老虎CDA的引物。CDA:5'GTG CTGCCTGACTGCTTC 3'和 antiCDA:5'AAGTGT TCCGTTGAAGGA 3'。以合成的cDNA为模板,以CDA和AntiCDA为引物扩增小地老虎几丁质脱乙酰基酶cDNA序列的特异片段。
PCR反应条件均为:94℃预变性5 min;94℃,30 s;52℃,30 s;72℃,1 min,30个循环;72℃延伸10 min,PCR产物经1.0%琼脂糖凝胶电泳检测后,将PCR产物回收,与pMD18-T vector连接、转化、筛选、鉴定。连接正确的重组子由南京金斯瑞生物工程公司进行序列测定。用克隆到的CDA的部分序列,设计5'和3'RACE引物。
1.2.3.1 克隆cDNA全长序列
根据所得基因片段设计3'端上游引物CDA1:5'CTCGATTGATGAAATCCTGTCGAGTC 3',与引物Adapter进行PCR克隆基因的3'端序列,电泳、回收、测序等反应同上。
使用TaKaRa 5'-Full RACE Kit进行5'RACE试验,根据试剂盒中的Outer Primer和Inner Primer设计克隆CDA基因5'端序列的引物。引物序列分别为CDA outer primer:5'AGCGTTACTCCAGAAGCG TTCGT 3';CDA inner primer:5'AAAGTATGTAGC CTTAATGTCGCAACCGTTAGGG 3',试验按照试剂盒说明进行,电泳、回收、测序等反应同上。
拼接全长序列,根据拼接所得基因序列设计3'端以及5'端引物扩增得到小地老虎CDA全长序列。
1.2.3.2 序列分析
得到的核苷酸序列使用NCBI中的Blast搜索,得到与克隆目的基因同源性较高的鳞翅目昆虫CDA核苷酸序列;使用InforMax软件中的AlignX对所得序列和已知昆虫的CDA基因进行同源性分析;使用Clone软件找到序列的ORF、酶切位点以及翻译得到氨基酸序列;利用ExPASy网站(http://us.expasy.org/tools/dna.html)的蛋白分析软件推导得到氨基酸序列的分子质量、等电点;利用Expasy molecular biology server的Scanprosite facility对推导得到的氨基酸结构域进行预测。
1.2.4CDA基因在大肠杆菌中的表达
利用Clone软件找到CDA序列的ORF,并根据载体PET21b的载体图设计表达引物,上游含有SalⅠ酶切位点,CDASalⅠ:5'ACGCGTCGACAT GGCGCGCTACGCCCGTGTCGCTACTC 3';下游含有XhoⅠ酶切位点,CDAXhoⅠ:5'CCGCTCGAGGT AACGGCCGTCACCCGTGGGGTCGTTCAG 3',PCR。回收产物、提取得到PET21b质粒分别进行双酶切,T4连接酶16℃过夜连接。将构建好的载体转化到BL21中,使用表达引物对菌液进行PCR,电泳。含有目的条带的菌液培养后提取少量质粒,XhoⅠ单酶切,XhoⅠ与SalⅠ双酶切鉴定重组阳性克隆,挑选含有目的片段的阳性克隆测序。测序正确的重组克隆使用IPTG诱导表达,SDS-PAGE凝胶电泳检测。
2 结果与分析
2.1 小地老虎CDA cDNA序列的获得
小地老虎CDA的cDNA序列大小为2 048 bp(见图1)。该基因已经在GenBank登记,登录号为JQ012932。该基因包括一个1 626个碱基的开放读码框,编码541个氨基酸,分子质量约为61.7 ku。
2.2 小地老虎CDA氨基酸序列分析
利用Expasy molecular biology server的 Scanprosite facility对推导的小地老虎几丁质脱乙酰基酶氨基酸的结构域进行分析,结果发现其最显著的特点是含有三个明显的结构域,几丁质结合区[Chitin binding Peritrophin-A domain(50-103)],低密度脂蛋白受体区[Low-density lipoprotein receptor class A domain(LDLa)(124-158)],几丁质催化区[Polysaccharide deacetylase domain(199-355)]。
用NetOGlyc软件对小地老虎几丁质酶氨基酸序列在N-位上的糖基化位点进行预测分析时发现,CDA的氨基酸序列中存在3个N位糖基化位点,分别为246NYSA、276 NATV、298NITD,证明该蛋白序列均属于糖蛋白,在昆虫体内需要经过糖基化作用才能有效发挥酶活性。

图1 小地老虎几丁质脱乙酰基酶基因CDA cDNA序列和推测的氨基酸序列Fig.1 Nucleotide and deduced amino acid sequence of Agrotis ipsilon CDA cDNA
SignalP3.0进行信号肽分析发现cDNA推导的氨基酸的21和22位之间存在一个信号肽切割位点。
2.3 同源性分析
小地老虎几丁质脱乙酰基酶氨基酸序列与已经克隆得到的其他鳞翅目几丁质脱乙酰基酶序列进行序列比对,结果见表1。小地老虎CDA氨基酸序列与棉铃虫(GQ411189),苜蓿夜蛾(GU188855)以及甘蓝夜蛾(HQ680620)CDA氨基酸序列关系比较密切,一致性分别为97%、98%和99%,而与鳞翅目昆虫家蚕(AK385842/AK378243)、棉铃虫(GQ-411190/GQ411191/EF600051)、粉纹夜蛾(AY966-402)、蓓带夜蛾(EU660852/HM357864)和甘蓝夜蛾(HQ680621)的CDA氨基酸序列同源性均低于40%。
系统进化分析表明,已登录GenBank的CDA基因属于不同的类群,本研究获得的CDA与已有甘蓝夜蛾(HQ680620)、棉铃虫(GQ411189)、苜蓿夜蛾(GU188855CDA)属于同一类群,结合功能域分析它们属于CDA家族中的第I组(Group I),而与其他CDA则分属不同类群(见图2)。
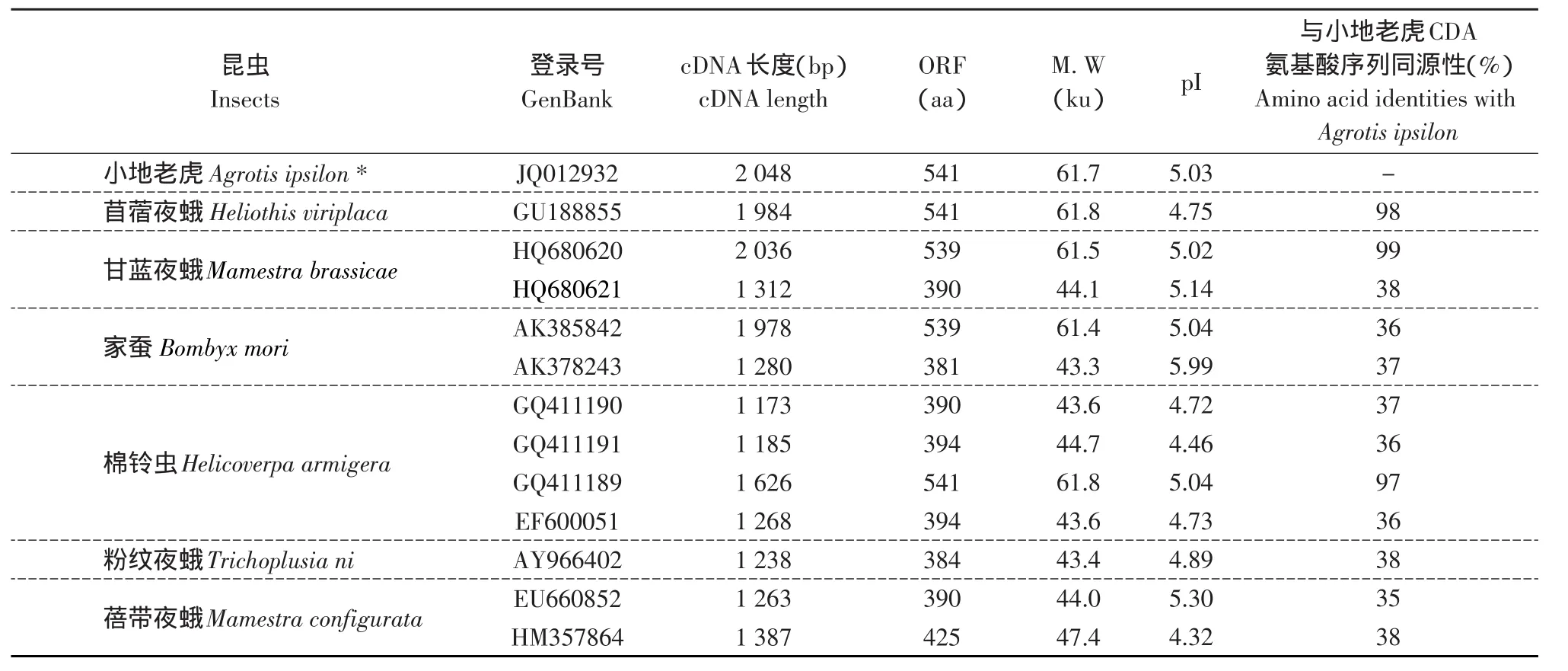
表1 不同鳞翅目昆虫CDA基本特征及与小地老虎CDA序列的一致性Table 1 Characteristics of some chitin deacetylase from different lepidopteran insects and their amino acid identities with Agrotis ipsilon

图2 登录GenBank的鳞翅目昆虫CDA聚类分析Fig.2 Phylogenetic tree of lepidopteran insects chitin deacetylase amino acid sequences
2.4 CDA原核表达结果
将PCR扩增的CDA基因序列插入PET21b中,构建重组表达质粒,转化大肠杆菌BL21菌株,经过37℃、4 h诱导表达,获得一条高表达的蛋白带,经过SDS-PAGE分析该蛋白质的分子质量约为60 ku,与预期的融和蛋白质分子质量相同(见图3)。
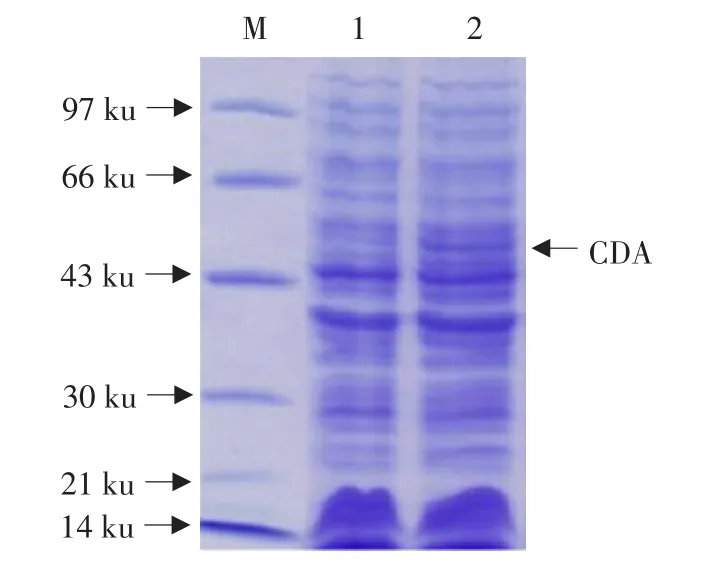
图3 CDA诱导表达的SDS-PAGE结果Fig.3 SDS-PAGE showing the induced expression of CDA
3 讨论与结论
在害虫的生物防治中,几丁质脱乙酰基酶被证明是潜在的杀虫剂靶标。该酶通过改变围食膜几丁质的物理结构和化学组成保护肠道免受病原物和毒素侵入。利用昆虫CDA构建重组病毒,可提高病毒的杀虫活性[11-12];利用RNA干扰技术对昆虫CDA表达进行调控[13],改变围食膜的通透性,干扰昆虫正常生长发育和新陈代谢过程以及抵抗病原物的特性。通过双向调节,增加或降低CDA表达,干扰围食膜中几丁质和壳聚糖组成,从而影响围食膜正常结构和功能,影响昆虫生长、发育和代谢。作为害虫防治的潜在方法,CDA在害虫生物防治中具有应用前景。
本试验克隆得到的小地老虎几丁质脱乙酰基酶cDNA序列,通过与其他昆虫CDA基因进行同源性比对、系统进化分析,功能域预测,明显可见小地老虎CDA基因属于第一种类型。在以后的研究中将继续克隆小地老虎其他类型CDA基因,进一步完善昆虫几丁质脱乙酰基酶基因拷贝数研究。
[1]Zhao Y,Park R D,Muzzarelli R A A.Chitin deacetylases:Properties and applications[J].Marine Drugs,2010(8):24-46.
[2]Campbel P M,Cao A T,Hines E R,et al.Proteomic analysis of the peritrophic matrix from the gut of the caterpillarHelicoverpa armigera[J].Insect Biochem Mol Biol,2008,38:950-958.
[3]Dixit R,Arakane Y,Specht C A,et al.Domain organization and phylogenetic analysis of proteins from the chitin deacetylase gene family ofTribolium castaneumand three other species of insects[J].Insect Biochem Mol Biol,2008,38:440-451.
[4]李玲,樊东,吴丽梅,等.苜蓿实夜蛾几丁质脱乙酰基酶基因cDNA序列的克隆与序列分析[J].植物保护,2011,37(1):24-34.
[5]Guo W,Li G,Pang Y,et al.A novel chitin-binding protein identified from the peritrophic membrane of the cabbage looper,Trichoplusiani[J].J Insect Biochem Mol Biol,2005,35(11):1224-1234.
[6]Toprak U,Baldwin D,Erlandson M,et al.A chitin deacetylase and putative insect intestinal lipases are components of theMamestra configurata(Lepidoptera:Noctuidae)peritrophic matrix[J].Insect Mol Biol,2008,17(5):573-585.
[7]Wang S,Jayaram S A,Hemphälä J,et al.Septate-junction-dependent luminal deposition of chitin deacetylases restricts tube elongation in theDrosophila trachea[J].Curr Biol,2006,16:180-185.
[8]Luschnig S,Bätz T,Armbruster K,et al.Serpentine and vermiform encode matrix proteins with chitin binding and deacetylation domains that limit tracheal tube length inDrosophila[J].Curr Biol,2006,16:186-194.
[9]姚磊,樊东,王晓云,等.甘蓝夜蛾两种不同类型几丁质脱乙酰基酶基因的克隆与组织特异性表达[J].应用昆虫学报,2011,48(5):1417-1424.
[10]张履鸿,李国勋,赵奎军.农业经济昆虫学[M].哈尔滨:哈尔滨船舶工程学院出版社,1993:154.
[11]Inceoglu A B,Kamita S G,Hammock B D.Genetically modified baculoviruses:A historical overview and future outlook[J].Adv Virus Res,2006,68:323-360.
[12]Jakubowska A K,Silvia C,Gordon K H,et al.Downregulation of a chitin deacetylase-like protein in response to baculovirus infection and its application for improving baculovirus infectivity[J].Journal of Virology,2010,84(5):2547-2555.
[13]Arakane Y,Dixit R,Begum K,et al.Analysis of functions of the chitin deacetylase gene family inTribolium castaneum[J].Insect Biochem Mol Biol,2009,39:355-365.

