植物CBL-CIPK信号系统研究进展
唐仁杰,杨 阳,郁萌萌,张洪霞
(中国科学院上海生命科学研究院植物生理生态研究所,上海 200032)
植物细胞质中游离的钙离子(Ca2+)作为信号转导第二信使,介导植物在不同发育阶段反应。细胞内时空特异性的钙信号通过各种不同的钙结合蛋白即钙的感受器(Calcium sensor)进行感知与传递[1]。在高等植物中,目前已经鉴定出的Ca2+感受器主要分为三大类:钙调蛋白CaM(Calmodulin)及类钙调蛋白 CML(CaM-like protein),钙依赖蛋白激酶 CDPK(Calcium-dependent protein kinase),类钙调磷酸酶B蛋白CBL(Calcineurin B-like protein)。CBL蛋白是植物中一类特殊的钙感受器,通过与蛋白激酶CIPK(CBL-interacting protein kinase)相互作用形成复合体,活性状态的CBL-CIPK复合体通过磷酸化修饰下游靶蛋白,解码各种动态变化的钙信号并调控相关的生理过程[2]。本文主要介绍植物CBL-CIPK信号系统组分结构、作用原理、生理功能及分子机制的最新研究进展。
1 CBL与CIPK蛋白的基本结构与特征
1.1 CBL蛋白家族
植物中的CBL蛋白与酵母中的钙调神经素B亚基(CNB)及动物中的神经元钙感受器(NCS)蛋白有一定的同源性并由此得名[3]。早期从拟南芥盐敏感突变体sos3中克隆的SOS3基因也属于该家族,因此CBL家族的蛋白也被称为SCaBP(SOS3-like calcium binding protein)[4]。随后的基因组学分析显示拟南芥全基因组中含有10个编码CBL蛋白基因[5]。在水稻、杨树、豌豆等其他多种植物中也有同源性很高的CBL基因家族[5-7],但尚未在高等动物中发现此类基因。所有的CBL蛋白都含有4个EF手型基序(EF-hand motif),且这4个EF手型基序之间间隔的氨基酸数目非常保守[5-8]。不同CBL蛋白EF手型基序的差异可能会导致其结合Ca2+方式不同。
拟南芥CBL蛋白可大致根据其N-端的结构划分为两个亚族。第一个亚族包括CBL1、CBL4、CBL5、CBL8和CBL9,这些蛋白含有一个相对较短(27~32个氨基酸)的N-端结构域,其中除CBL8另外4个成员在N-端都有非常保守的豆蔻酰化位点和棕榈酰化位点MGCXXS/T[9]。第二个亚族包括CBL2、CBL3、CBL6、CBL7 和 CBL10,这些 CBL蛋白拥有较长(41~43个氨基酸)的N-端且不含明确的脂酰化修饰位点。
1.2 CIPK蛋白家族
CBL虽然能够结合Ca2+,但其自身没有酶的活性,它必须与下游的靶蛋白结合才能发挥生物学功能。研究人员利用酵母双杂交方法鉴定出CBL的主要靶蛋白是一类植物中特有的丝氨酸/苏氨酸蛋白激酶,命名为CIPK(CBL-interacting protein kinase)[10]或PKS(SOS2-like protein kinase)[4]。根据结构特征与进化关系,植物CIPK蛋白被划为SnRK3(SNF1-related kinases,group 3)激酶亚家族,在进化上同属于 CaMK(CaM-dependent kinase)超家族[11]。与CaMK超家族的其他激酶成员一样,CIPK拥有保守的N-端激酶结构域(Kinase domain)与不太保守的C-端调节结构域(Regulatory domain),且两者之间被一个连接结构域(Junction domain)隔开。在CIPK的调节结构域中含有一个保守的24个氨基酸组成的NAF结构域(又称FISL基序),该基序是一个自抑制结构域并介导与CBL的相互作用[4]。CIPK与CBL的结合能够解除C-端调节结构域对N-端激酶结构域的抑制作用,激发CIPK的自磷酸化和磷酸化活性从而使复合体处于激活状态[12]。同时,位于激酶结构域内的激活环(Activation loop)序列可能被某些未知的上游激酶磷酸化,从而使CIPK转变成组成型激活形式[4,12]。另外,值得注意的是,NAF结构域附近还有一个PPI(Protein phosphatase type-2C interaction motif)基序,能够介导其与ABI1、ABI2等PP2C类蛋白磷酸酶的相互作用,关于CBL与CIPK蛋白的基本结构见图1。CBLs中第一个EF手形基序含有14个氨基酸,而非含有12个氨基酸的典型EF手形结构(浅灰色方块)。CIPKs的N-端激酶结构域中含有一个激活环,C-端调节结构域分为两个相互作用的结构域即介导CBL-CIPK相互作用的NAF结构域和临近的PPI结构域,这两个结构域之间的连接区域则进一步负责激酶的激活[13]。
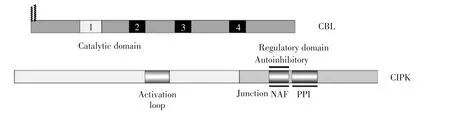
图1 CBL与CIPK蛋白的基本结构Fig.1 Basic structure of CBL and CIPK protein
1.3 CBL-CIPK家族的进化
CBL-CIPK信号系统中基因的进化分析显示,绿藻中只有单个CBL和CIPK基因,苔藓中有4个CBLs和7个CIPKs,蕨类植物百叶卷柏中有5个CBLs和5个CIPKs基因[13-14],而拟南芥、水稻和杨树
中分别有 10 个 CBLs[5-6],26、27 和 30 个 CIPKs[5,14-15]。这些信息显示为适应环境,陆生植物在形态学和发育学上进化可能也演化出愈加复杂的CBL-CIPK系统。最近在低等原生动物中也找到某些CBL和CIPK同源基因[13],但是这些基因在非植物物种中的功能尚无研究。
2 CBL与CIPK相互作用
2.1 CBL通过与CIPK的相互作用激活CIPK的激酶活性
早期研究者通过研究SOS2/CIPK24的分子结构以及SOS2-SOS3的相互作用发现CBL调控CIPK的保守机制[4,12-16]。在CIPK中,激酶结构域与调节结构域发生分子内的相互作用从而发生激酶催化活性的自抑制,而缺失FISL/NAF结构域后CIPK表现为组成型的持续激活形式。CBL通过与CIPK的NAF结构域相互作用解除了分子内的自抑制作用,从而激活CIPK,使其具有很强的自磷酸化活性以及磷酸化底物的活性。在盐敏感突变体sos3中,过量表达组成型激活的SOS2可以部分恢复突变体的耐盐性,说明在体内SOS3至少部分通过激活SOS2来介导下游的耐盐反应[17]。
2.2 CBL招募CIPK到特定的细胞空间位置
对10个拟南芥CBL蛋白定位研究揭示N-端对其亚细胞定位非常重要:CBL1,4,5,9蛋白定位在质膜上;CBL2,3,6,10蛋白定位在液泡膜上;CBL7和CBL8则定位在细胞核和细胞质中[18],这些多样而特异的亚细胞定位暗示CBL作为钙的感受器能够快速传递局部钙释放事件。与CBL蛋白不同,大部分CIPK蛋白单独存在时表现出分布在细胞核、质、膜上的遍在定位模式[18]。双分子荧光互作(Bimolecular fluorescence complementation,BiFC)分析CBL与CIPK相互作用时发现CBL-CIPK复合体的定位取决于复合体中CBL蛋白的定位[9,18-20]。说明CIPK被与其相互作用的CBL招募到特定的细胞位置以便更高效地发挥作用。
2.3 CBL作为CIPK的底物被磷酸化
长期以来,CBL都被认为是CIPK上游的激活者或招募者调节CIPK的活性与定位。但最近的研究表明,CBL也可以作为CIPK的底物被其磷酸化,从而受到CIPK修饰上的调控。Lin等报道SOS2/CIPK24可以特异性地磷酸化SCaBP8/CBL10,从而增强SCaBP8-SOS2复合体的稳定性[21]。更重要的,通过特异性的磷酸化抗体证明该磷酸化作用在植物体内也确实存在,并且受到NaCl的诱导而增强[21],这说明在盐胁迫下钙感受器SCaBP8蛋白不仅是信号的转导者,它的磷酸化修饰反过来受到自身传递信号的调控。
3 CBL-CIPK信号系统解码特异性钙信号的可能机制
3.1 不同的CBL可能具有不同的钙结合属性
每个CBL蛋白中典型与非典型EF手型基序的数目和位置不同,使其可能表现出不同的Ca2+结合属性。拟南芥CBL蛋白家族可以依据标准EF手型结构的数目分为三类:不含任何标准EF手型结构的,如AtCBL2,3,4,5;含有一个标准EF手型结构的,包括AtCBL6,7,8,10;含有两个标准EF手型结构的,即AtCBL1和AtCBL9[5]。不含有任何标准EF手型结构的CBL并不意味着不能结合Ca2+,只是亲和力可能较低。AtCBL1拥有两个标准的EF手型结构,凝胶阻滞实验和Ca2+结合实验表明AtCBL1能够稳定结合Ca2+[3];除CBL本身的特性外,它与CIPK的结合可能改变原本钙的结合特性。CBL蛋白这种Ca2+结合的不同属性如何影响不同环境刺激下特异性钙信号的转导,还需试验验证。
3.2 CBL与CIPK互作的特异性
拟南芥不同成员的CIPK与CBL相互作用的特异性已有较多报道[4,23]。一般而言,这种相互作用在一些成员间存在重叠:某些CBL可与多个CIPKs发生相互作用,同样某些CIPK也可与多个CBLs相互作用。相互作用的特异性可能由多个因素决定,包括CBL的结构差异,CIPK的NAF区域及其两侧序列的差异。早期的酵母双杂结果显示CBL4可与CIPK5和CIPK6的调节域相互作用,但在使用全长的蛋白激酶时却只有CIPK6能与CBL4相互作用,用CIPK6的调节域和CIPK5的激酶域构建的嵌合蛋白也不能与CBL4相互作用[23],这表明激酶域很可能在稳定相互作用和决定相互作用的特异性方面起一定作用。Ca2+也可能参与CBL-CIPK相互作用的特异性,CBL与Ca2+的结合并不是其与CIPK相互作用的必要条件[24]。
3.3 不同CBL与CIPK特异的基因表达模式
基因表达模式与其执行的生物学功能密切相关,因此基因表达模式的特异性对于其发挥功能特异性非常重要。目前研究结果表明,拟南芥和水稻中CBLs和CIPKs不同成员的表达谱既有部分重叠,又具有自己较为特殊的表达模式[3-4,25]。因此,在植物体内,多种CBL-CIPK复合体的真正形成除它们之间相互作用的特异性,还取决于CBL和CIPK特异的表达模式,这也构成了CBL-CIPK途径能够解码众多特异性钙信号的又一分子基础。在特定的时空及特定的胁迫条件下,具有相同表达模式的CBL和CIPK更易于形成相应的CBL-CIPK复合体从而转导特异的钙信号。例如,棉花的GhCBL2和GhCBL3偏爱在纤维细胞伸长过程中表达,而GhCIPK1具有类似的表达模式,酵母双杂结果证明GhCIPK1与GhCBL2及GhCBL3都可以发生互作,此二组合的复合体可能在棉花纤维伸长过程中起重要作用[26]。
3.4 CBL-CIPK复合体选择性的亚细胞定位
钙信号特异性中很重要一点就是它限定在细胞的特定位置,因此CBL-CIPK复合体的亚细胞定位对于解码特定位置的钙信号就显得至关重要。如前面所述,在CBL-CIPK复合体中,CIPK的亚细胞定位主要是由CBL的定位决定的。同一个CIPK与不同CBL可以形成定位不同的选择性复合体(Alternative complexes),从而介导不同的反应。
3.5 CBL-CIPK复合体的功能特异性
CBL-CIPK信号系统的特异性还在于只有特定的CBL-CIPK复合体才能激活特定的靶标。这在cbl1盐敏感性的互补实验中得到较好的体现。在这个实验中只有表达CBL1野生型的蛋白才能抑制cbl1的盐敏感性,CBL1 N-端12个氨基酸与CBL2的融合蛋白CBL1nCBL2虽然也能够像CBL1一样在质膜上与CIPK相互作用但却不能互补突变体的表型[9]。另外,CIPK1被两个高度相关的CBL蛋白调节参与不同的生理过程:CBL1-CIPK1可能调节其不依赖于ABA的盐胁迫下游过程,而CBL9-CIPK1介导植物对ABA的相关反应[19]。由此也可看出,CBL-CIPK复合体中的钙感受器CBL蛋白对于调节磷酸化靶标的活性至关重要。
4 CBL-CIPK信号系统参与的生理功能及分子机制
众多的CBL-CIPK信号组分构成广泛的网络系统,在植物各种生理活动与多种信号途径中起作用。在模式植物拟南芥中,通过遗传学的方法和大量cbl及cipk突变体的功能分析很大程度地丰富了我们对CBL-CIPK信号系统在植物中生理功能的认识及相关过程分子机制的解析(见图2)[22],其中,AKT1代表拟南芥K+转运体1,SOS1代表质膜Na+/H+逆向转运蛋白,CHL代表硝酸根转运体,AHA2代表拟南芥质子ATP酶2。

图2 植物CBL-CIPK信号系统介导的钙信号转导过程Fig.2 Ca2+-signaling pathways mediated by plant CBL-CIPK system
4.1 CBL-CIPK信号系统参与植物盐胁迫下的信号转导—SOS信号转导途径
植物中最早关于CBL-CIPK功能的研究是中国科学院朱健康教授领导的小组在盐胁迫信号转导方面做出的开创性工作。研究者使用EMS、快中子诱变和T-DNA插入技术,通过弯根试验(Rootbending assay)从约25 000粒种子中筛选得到40多个sos(Salt overly sensitive)突变体[27-28]。通过比较sos突变体在不同离子胁迫下的生长表型发现,sos1、sos2和sos3显示出对Na+和Li+特异的超敏感性。随后用图位克隆方法克隆相关基因,并从分子、遗传、生化、细胞等各方面进行功能分析,最终揭示出一条与盐胁迫应答直接相关的调控途径即SOS途径。在盐胁迫下,通过细胞膜上Na+感受器的信号传入使细胞质内Ca2+浓度增加,激活SOS3/CBL4,并促使SOS3/CBL4和SOS2/CIPK24结合转变为活性态,SOS2/CIPK24被招募到细胞质膜附近发挥激酶的功能,激活下游蛋白行使功能,而质膜上的Na+/H+逆向转运蛋白SOS1是其底物之一。最终,SOS2-SOS3复合体激活SOS1,提高质膜Na+/H+逆向转运的能力,防止Na+在细胞内过量积累[29]。SOS3主要在拟南芥的根部表达,因此sos3主要表现为根对盐胁迫更加敏感,暗示着在地上部分很可能存在一个SOS3的同源基因发挥类似功能。Quan等证明SCaBP8/CBL10参与拟南芥地上部分的SOS途径,且SOS3与CBL10不能替换对方的功能[30]。另外,盐胁迫下SOS2在细胞内可以与多种蛋白相互作用,从而发挥多效性功能。
4.2 CBL-CIPK信号系统参与植物响应低钾胁迫的信号转导
钾(K+)作为高等植物细胞必需的一种大量元素在植物生长发育中起重要作用。植物细胞对K+的吸收和转运主要是通过K+转运体完成。CBL-CIPK信号转导系统在调控植物响应低钾胁迫的反应中起重要作用。CIPK23可通过与CBL1或CBL9相互作用来磷酸化下游的K+通道AKT1,进而激活K+转运,因此拟南芥cipk23突变体以及cbl1-cbl9双突变体对低钾胁迫更加敏感[31]。CBL1-CIPK23或CBL9-CIPK23复合体只专一性地作用于AKT1,而对其他K+转运体无影响。钙感受器CBL1与CBL9还可以通过与CIPK6、CIPK16的相互作用传递低钾信号并调控AKT1[32]。进一步研究发现,AKT1与CIPK23都可与磷酸酶PP2CA家族中的成员AIP1发生相互作用。AIP1可以通过去磷酸作用负调控AKT1,它与CIPK系统一起工作从而实现对K+通道AKT1开闭的可逆调控[32]。
4.3 CBL-CIPK信号系统对质膜H+-ATP酶活性的调节
质膜H+-ATP酶(PM H+-ATPase)负责跨质膜电化学梯度的建立为次级运输提供动力,广泛参与植物细胞生长,胞内pH调节,气孔开闭,逆境响应等生理过程。最近研究发现,CBL-CIPK信号途径中的PKS5/CIPK11是质膜H+-ATP酶AHA2的负调节因子[33]。AHA2的C-端结构域中第931位的丝氨酸残基被PKS5磷酸化后阻止该区域与14-3-3蛋白结合,从而导致AHA2质子转运活性下调。在PKS5功能缺失的突变体pks5中,AHA2活性的抑制得以解除,H+转运能力增强,因此pks5突变体比野生型植株更能适应碱性环境[33]。最新研究又发现质膜H+-ATPase的另一个调节因子J3(DnaJ homolog 3,heat shock protein 40-like),J3作用于PKS5上游并能抑制PKS5的激酶活性,从而正调控质膜H+-ATPase活性[34]。
4.4 CBL-CIPK信号系统对植物硝酸根营养及信号的调控
氮素作为植物必需的一类大量元素在植物生长发育过程中起重要作用,而硝酸根(NO3-)是植物对氮素吸收和利用的主要形式[35]。植物通过硝酸根转运蛋白(Nitrate transporter)吸收和利用 NO3-。CHL1/AtNRT1.1是植物中最早鉴定出的硝酸根转运蛋白[36],具有双重亲和力,在高、低亲和力两个硝酸盐转运系统中均能发挥作用[37]。另一方面,CHL1不仅能够转运NO3-,还能够响应NO3-信号从而引起基因表达与生理上的变化[38]。chl1-9等位突变体对NO3-转运能力丧失而对NO3-信号的响应不受影响,充分说明CHL1既是NO3-的转运体又是NO3-的感受器,且两者功能不偶联[39]。当外界环境是低浓度的NO3-时,植物感应到低氮胁迫,激活CBLCIPK信号途径,通过磷酸化作用使CHL从低亲和力转变为高亲和力,增强植物转运NO3-能力并维持低氮的原初反应[39]。另外发现CIPK8在调控低氮营养上也具有重要作用,但是对于其调控过程中涉及的CBL蛋白以及硝酸根转运体目前还不清楚[40]。
4.5 CBL-CIPK信号途径参与调控植物ABA信号途径
积累ABA是植物对逆境的普遍反应之一。在植物体内分别存在依赖ABA和不依赖ABA两种信号途径参与对逆境胁迫的响应,它们与钙信号传递网络相互交叉,形成多条信号传递支路参与植物对逆境信号的转导。CBL-CIPK作为一类重要的钙信号系统也参与ABA依赖与ABA非依赖的信号转导过程。如CBL1的功能缺失突变体cbl1对干旱、冷害和盐胁迫等多种非生物胁迫的敏感性不依赖于ABA,而与CBL1高度同源的CBL9的功能缺失突变体cbl9则对ABA超敏感[41-42]。在拟南芥种子萌发过程中,CIPK3基因表达能被强烈诱导;在施加外源ABA条件下,cipk3突变体种子的萌发比野生型延迟,且ABA相关的Marker基因的表达发生变化,说明CIPK3参与ABA信号转导过程[43]。CBLCIPK信号途径和ABA信号途径交叉响应的分子调控机理目前没有研究清楚。
4.6 CBL-CIPK信号途径参与调控植物的其他生理过程
CBL-CIPK信号系统广泛参与其他生理过程。水稻中OsCIPK15与水稻的缺氧耐性有关,可能调节SnRK1A整合缺氧响应和糖信号反应[44]。除介导植物对外界环境的响应,CBL-CIPK系统还参与植物发育的相关过程。据报道,在CIPK6功能缺失的突变体cipk6中,向基式与向顶式的生长素运输均明显减弱,造成植株表现为子叶融合、下胚轴膨大、侧根发生延迟等生长缺陷[45]。
5 展 望
植物中钙信号系统参与的生物过程错综复杂,长期进化选择压力必然形成一套精密的调控机制,因此要完全解析整个CBL-CIPK钙信号转导网络在植物发育与环境响应中的作用仍有不少问题亟待解决。首先,目前对CBL-CIPK信号系统的研究主要集中在拟南芥和水稻等模式植物中,而不同植物在长期适应不同生境演化过程中必然在该信号网络的多个节点发生分歧,因此全面了解CBL-CIPK信号系统所行使的生物学功能与分子机制将是一项系统而艰巨工作。其次,最新研究表明,每个CBL和CIPK都蕴含有一个多功能的信号组分,其可变的复合体和多样的细胞靶向路径决定了通过这个信号系统处理信息的最终生物学功能产出。因此,今后具有挑战性的研究方向在于进一步阐明决定CBLCIPK互作网络靶向的调控机制,CBL-CIPK复合体形成的时空调控,以及影响复合体定位的调控因子。另外,揭示CBL-CIPK信号系统与植物中PP2C、CDPK、MAPK等其他信号系统的功能与调控关系也将是研究热点。
[1]DeFalco T A,Bender K W,Snedden W A.Breaking the code:Ca2+sensors in plant signalling[J].Biochem J,2009,425:27-40.
[2]Luan S.The CBL-CIPK network in plant calcium signaling[J].Trends Plant Sci,2009,14:37-42.
[3]Kudla J,Xu Q,Harter K,et al.Genes for calcineurin B-like proteins inArabidopsisare differentially regulated by stress signals[J].Proc Natl Acad Sci USA,1999,96:4718-4723.
[4]Guo Y,Halfter U,Ishitani M,et al.Molecular characterization of functional domains in the protein kinase SOS2 that is required for plant salt tolerance[J].Plant Cell,2001,13:1383-1400.
[5]Kolukisaoglu U,Weinl S,Blazevic D,et al.Calcium sensors and their interacting protein kinases:Genomics of the Arabidopsis and rice CBL-CIPK signaling networks[J].Plant Physiol,2004,134:43-58.
[6]Zhang H,Yin W,Xia X.Calcineurin B-Like family in populous:Comparative genome analysis and expression pattern under cold,drought and salt stress treatments[J].Plant Growth Regul,2008,56:129-140.
[7]Mahajan S,Sopory S K,Tuteja N.Cloning and characterization of CBL-CIPK signalling components from a legume(Pisum sativum)[J].FEBS J,2006,273:907-925.
[8]Luan S,Kudla J,Rodriguez-Concepcion M,et al.Calmodulins and calcineurin B-like proteins:Calcium sensors for specific signal response coupling in plants[J].Plant Cell,2002,14:389-400.
[9]Batistic O,Sorek N,Schultke S,et al.Dual fatty acyl modification determines the localization and plasma membrane targeting of CBL/CIPK Ca2+signaling complexes inArabidopsis[J].Plant Cell,2008,20:1346-1362.
[10]Shi J,Kim K N,Ritz O,et al.Novel protein kinases associated with calcineurin B-like calcium sensors inArabidopsis[J].Plant Cell,1999,11:2393-2406.
[11]Hrabak E M,Chan C W,Gribskov M,et al.TheArabidopsisCDPK-SnRK superfamily of protein kinases[J].Plant Physiol,2003,132:666-680.
[12]Gong D,Guo Y,Schumaker K S,et al.The SOS3 family of calcium sensors and SOS2 family of protein kinases inArabidopsis[J].Plant Physiol,2004,134:919-926.
[13]Batistic O,Kudla J.Plant calcineurin B-like proteins and their interacting protein kinases[J].Biochim Biophys Acta,2009,1793:985-992.
[14]Weinl S,Kudla J.The CBL-CIPK Ca2+-decoding signaling network:Function and perspectives[J].New Phytol,2009,184:517-528.
[15]Yu Y,Xia X,Yin W,et al.Comparative genomics analysis of CIPK genefamily inArabidopsisandPopulus[J].Plant Growth Regul,2007,52:101-110.
[16]Gong D,Guo Y,Jagendorf A T,et al.Biochemical characterization of theArabidopsisprotein kinase SOS2 that functions in salt tolerance[J].Plant Physiol,2002,130:256-264.
[17]Guo Y,Qiu Q S,Quintero F J,et al.Transgenic evaluation of activated mutant alleles of SOS2 reveals a critical requirement of its kinase activity and C-terminal regulatory domain for salt tolerance inArabidopsis[J].Plant Cell,2004,16:435-449.
[18]Batistic O,Waadt R,Steinhorst L,et al.CBL-mediated targeting of CIPKs facilitates the decoding of calcium signals emanating from distinct cellular stores[J].Plant J,2010,61:211-222.
[19]D'Angelo C,Weinl S,Batistic O,et al.Alternative complex formation of the Ca2+-regulated protein kinase CIPK1 controls abscisic acid-dependent and independent stress responses inArabidopsis[J].Plant J,2006,48:857-872.
[20]Waadt R,Schmidt L K,Lohse M,et al.Multicolor bimolecular fluorescence complementation reveals simultaneous formation of alternative CBL/CIPK complexes in planta[J].Plant J,2008,56:505-516.
[21]Lin H,Yang Y,Quan R,et al.Phosphorylation of SOS3-LIKE CALCIUM BINDING PROTEIN8 by SOS2 protein kinase stabilizestheirprotein complexand regulates salt tolerance inArabidopsis[J].Plant Cell,2009,21:1607-1619.
[22]Kudla J,Batistic O,Hashimoto K.Calcium signals:The lead currency of plant information processing[J].Plant Cell,2010,22:541-563.
[23]Kim K N,Cheong Y H,Gupta R,et al.Interaction specificity ofArabidopsiscalcineurin B-like calcium sensors and their target kinases[J].Plant Physiol,2000,124:1844-1853.
[24]Halfter U,Ishitani M,Zhu J K.TheArabidopsisSOS2 protein kinase physically interacts with and is activated by the calciumbinding protein SOS3[J].Proc Natl Acad Sci USA,2000,97:3735-3740.
[25]Xiang Y,Huang Y,Xiong L.Characterization of stress-responsive CIPK genes in rice for stress tolerance improvement[J].Plant Physiol,2007,144:1416-1428.
[26]Gao P,Zhao P M,Wang J,et al.Co-expression and preferential interaction between two calcineurin B-like proteins and a CBL-interacting protein kinase from cotton[J].Plant Physiol Bioch,2008,46:935-940.
[27]Wu S J,Lei D,Zhu J K.SOS1,a genetic locus essential for salt tolerance and potassium acquisition[J].Plant Cell,1996(8):617-627.
[28]Zhu J K,Liu J,Xiong L.Genetic analysis of salt tolerance inArabidopsis:Evidence for a critical role of potassium nutrition[J].Plant Cell,1998,10:1181-1191.
[29]Zhu J K.Salt and drought stress signal transduction in plants[J].Annu Rev Plant Biol,2002,53:247-273.
[30]Quan R,Lin H,Mendoza I,et al.SCABP8/CBL10,a putative calcium sensor,interacts with the protein kinase SOS2 to protectArabidopsisshoots from salt stress[J].Plant Cell,2007,19:1415-1431.
[31]Li L,Kim B G,Cheong Y H,et al.A Ca2+signaling pathway regulates a K+channel for low-K response inArabidopsis[J].Proc Natl Acad Sci USA,2006,103:12625-12630.
[32]Lee S C,Lan W Z,Kim B G,et al.A protein phosphorylation/dephosphorylation network regulates a plant potassium channel[J].Proc Natl Acad Sci USA,2007,104:15959-15964.
[33]Fuglsang A T,Guo Y,Cuin T A,et al.Arabidopsis protein kinase PKS5 inhibits the plasma membrane H+-ATPase by preventing interaction with 14-3-3 protein[J].Plant Cell,2007,19:1617-1634.
[34]Yang Y,Qin Y,Xie C,et al.TheArabidopsischaperone J3 regulates the plasma membrane H+-ATPase through interaction with the PKS5 kinase[J].Plant Cell,2010,22:1313-1332.
[35]Redinbangh M G,Campbell W H.Higher plant responses to environmental nitrate[J].Plant Physiol,1991,82:640-650.
[36]Tsay Y F,Schroeder J I,Feldmann K A,et al.The herbicide sensitivity gene CHL1 ofArabidopsisencodes a nitrate-inducible nitrate transporter[J].Cell,1993,72:705-713.
[37]Liu K H,Huang C Y,Tsay Y F.CHL1 is a dual-affinity nitrate transporter ofArabidopsisinvolved in multiple phases of nitrate uptake[J].Plant Cell,1999,11:865-874.
[38]Remans T,Nacry P,Pervent M,et al.TheArabidopsisNRT1.1 transporter participates in the signaling pathway triggering root colonization of nitrate-rich patches[J].Proc Natl Acad Sci USA,2006,103:19206-19211.
[39]Ho C H,Lin S H,Hu H C,et al.CHL1 functions as a nitrate sensor in plants[J].Cell,2009,138:1184-1194.
[40]Hu H C,Wang Y Y,Tsay Y F.AtCIPK8,a CBL-interacting protein kinase,regulates the low-affinity phase of the primary nitrate response[J].Plant J,2009,57:264-278.
[41]Cheong Y H,Kim K N,Pandey G K,et al.CBL1,a calcium sensor that differentially regulates salt,drought,and cold responses inArabidopsis[J].Plant Cell,2003,15:1833-1845.
[42]Pandey G K,Cheong Y H,Kim K N,et al.The calcium sensor calcineurin B-like 9 modulates abscisic acid sensitivity and biosynthesis inArabidopsis[J].Plant Cell,2004,16:1912-1924.
[43]Kim K N,Cheong Y H,Grant J J,et al.CIPK3,a calcium sensor-associated protein kinase that regulates abscisic acid and cold signal transduction inArabidopsis[J].Plant Cell,2003,15:411-423.
[44]Lee K W,Chen P W,Lu C A,et al.Coordinated responses to oxygen and sugar deficiency allow rice seedlings to tolerate flooding[J].Sci Signal,2009(2):61.
[45]Tripathi V,Parasuraman B,Laxmi A,et al.CIPK6,a CBL-interacting protein kinase is required for development and salt tolerance in plant[J].Plant J,2009,58:778-790.

