癸氧喹酯对意蜂工蜂中微孢子虫的抑制作用研究
王 博 吴丽丽 黄少康 罗 瑶 滕小羊 游信毅
(福建农林大学蜂学学院,福州 350002)
蜜蜂是最重要的授粉昆虫之一,为农业生产和自然界植物繁衍带来了巨大效益。同时,蜜蜂也受多种病原的侵袭,蜜蜂微孢子虫就是最广泛感染成年蜂的一种传染性病原。蜜蜂微孢子虫主要侵染中肠组织,感染对中肠功能有显著影响,感染工蜂的中肠凝乳蛋白酶(trypsin)、胰凝乳蛋白酶(chymotrypsin)(Malone and Gatehouse,1998),谷胱苷肽还原酶(glutathione reductase),碱性磷酸酶(Alkaline phosphatase)均会显著下降,而谷苷胱肽S转移酶(Glutathione-S-transferase)显著上升(Dussaubatet al.,2012)。感染会造成工蜂个体免疫力下降,寿命缩短,群势和生产力下降(黄少康等,2006;Chaimaneeet al.,2012);它还与病毒等其他病因共同造成蜂群衰竭(Higeset al.,2008;vanEngeldorpet al.,2009)。自1996发现东方蜜蜂微孢子虫(Nosema ceranae)至今,在西方蜜蜂中,它已经逐渐替代了西方蜜蜂微孢子虫(N. apis)而成为侵染蜜蜂的主要微孢子虫种类(Fries et al.,1996;Chenet al.,2008;刘峰等,2008)。
烟曲霉素(Fumigillin)和阿苯达唑(albendazole)是人和动物微孢子虫病治疗中最常用,最有效的两种药物(Costaet al.,2000)。在北美及欧洲的西班 牙,烟曲霉素允许在蜂群中使用(Williamset al.,2011)。 酸饲料也曾用于蜂群治疗,但结果并不理想(Forsgren and Fries,2005);天然植物提取物也是人们热衷尝试的对象,室内试验显示,百里酚(thymol)和白黎芦醇(vesveratrol)均能显著抑制孢子数量,延长工蜂寿命(黄文诚,2009;Maistrelloet al.,2008;Costaet al.,2010),但在蜂群中的使用效果尚未得到广泛确认。
癸氧喹酯(decoquinate)是一种喹啉(quinolone)类广谱抗球虫药物,又名地考喹啉酯、敌球素,化学名为6-癸氧基-7-乙氧基-4-羟基喹啉-3-羧基乙酯。癸氧喹酯是1967年英国May-Baker公司研制,对预防和治疗禽类球虫,家畜的孢子虫、隐孢子虫等病原有良好的效果(陈晓荣等,2010)。对人畜安全,无遗传毒性、致畸性和繁殖毒性,据亚急性试验推算,人可每日允许摄入癸氧喹酯的量(ADI)为0.075mg/kg体重(聂月美等,2011)。癸氧喹酯在美国、日本,及欧洲许多国家使用于已有几十年的历史,但到近年才引进中国,用于禽类球虫病治疗,效果明显(Guoet al.,2007)。由于蜜蜂微孢子虫与畜禽类孢子虫有许多相似的生物学特征,本试验的目的是测试该药物是否对蜜蜂微孢子虫有抑制或治疗作用。室内测试表明,癸氧喹酯对意蜂工蜂中微孢子虫的感染有明显的抑制作用,同时对工蜂中肠功能无明显不良影响,现报道如下。
1 材料与方法
1.1 微孢子虫悬液制备
微孢子虫提纯方法参文献(黄少康等,2007)。简要过程为:从意蜂蜂群巢门口抓取一定数量的外勤蜂,拉取中肠,经多次差速离心纯化后,获得微孢子虫悬液。将纯化所得的微孢子虫经镜检计数后,再用质量分数50%蔗糖液(文中所使用的糖液均同)稀释到4.4×106 spore/mL的浓度用于接种用。
1.2 意蜂工蜂接种与饲养
意蜂群由福建农林大学蜂学学院教学蜂场提供。从健壮的蜂群中挑取老熟意蜂封盖子脾,放入恒温恒湿箱中(35℃、75%±15%RH)羽化,收集24h内出房的工蜂用于试验。
用微量进样针吸的微孢子虫悬液,逐只给工蜂经口饲喂1μL,再放入成年工蜂室内饲养盒中,放入30℃,70%±15%RH的恒温恒湿箱内饲养。每盒30只工蜂,共12盒。12盒蜂均分4组,每组3盒;3组为饲药组,1组为对照组,对照组试验全程均只喂质量分数50%的蔗糖液。
从接种的第1天至第4天, 均供以蔗糖液,以促使微孢子虫与工蜂建立感染关系。将浓度分别为2×1 0-6、1×10-5、5×10-5g/mL的癸氧喹酯(原液为2.5%,济南 深华生物有限公司生产)蔗糖液作为3试验组的饲药糖浆,从第5至第11天连续供给含药糖浆一周,供工蜂自由取食。第12至第14天,全部改喂蔗糖液。
每天饲喂一次,每日记录取食量和死蜂数。取食量测定方法:将装好糖浆的饲料管用电子天平(精度0.0001mg)称重,24h后取出再称重,重量差除以每天的蜂数即为日均单只取食量。
1.3 中肠酶液制备及微孢子虫检查
室内饲养14天后,将活蜂的中肠拉出,放入1.5mL离心管中,加入0.1mol/L乙酸钠(pH5.0)缓冲液0.1mL,冰浴研磨,10000 r/min 4℃离心15min,上清液-70保存,用 于蛋白浓度及酶活性检测。
离心沉淀加入100μL蒸馏水,混匀,吸取少量于400倍显微镜下观察,记录视野下微孢子虫数,然后按每视野内微孢子虫数量的多少对感染严重程度的进行分级:每视野内孢子数少于10个时定为Ⅰ级,>10~30个为Ⅱ级;>30~10 0个为Ⅲ级;>100为Ⅳ级。
1.4 中肠蛋白浓度的比较
以Bradford法测定中肠蛋白浓度(汪家政等,2000)。以牛血清白蛋白为标准蛋白,配制标准溶液,在595 nm下用酶标仪测定其光吸收值,根据标准曲线换算成浓度。具体地:吸取5μL中肠上清液、95μL乙酸钠缓冲液、1mL Bradford工作液,在1.5mL管中混匀。吸250 μL于酶标板中,用酶标仪测定吸光值,记录样品蛋白浓度。每样品2个重复。
1.5 意蜂工蜂中肠α-葡萄糖苷酶相对活性比较
根据镜检分级结果将感染程度的不同中肠上清液分成三组:未感染、轻度感染(Ⅰ-Ⅱ级)、严重感染(Ⅲ-Ⅳ级),每组随机取15个样品。按以下方法检测中肠葡萄糖苷酶活性:吸酶液5μL于1.5mL小管中,加入200μL 0.2mmol/L的α-pNPG溶液,40温浴30min后。加入6 0μL的Tris 缓冲液(1.5mol/L,pH10.0)终止,冷却至室温,吸200μL于酶标板中,405nm处测吸光值。相对酶活以产物pNPG的吸光值与蛋白量的比值计。每样本3个重复。
1.6 数据处理
使用SPSS软件进行数据分析。为统计方便,将Ⅰ和Ⅱ级的感染合计为轻度感染,Ⅲ级和Ⅳ级合计为重度感染。感染率和感染严重程度的比较使用卡方检验;多重比较用方差分析(one-way ANOVA,LSD)进行两两比较。
2 结果与分析
2.1 癸氧喹酯蔗糖液对工蜂取食量的比较
在试验期内,单只工蜂日均取食量的变化规律见图1。
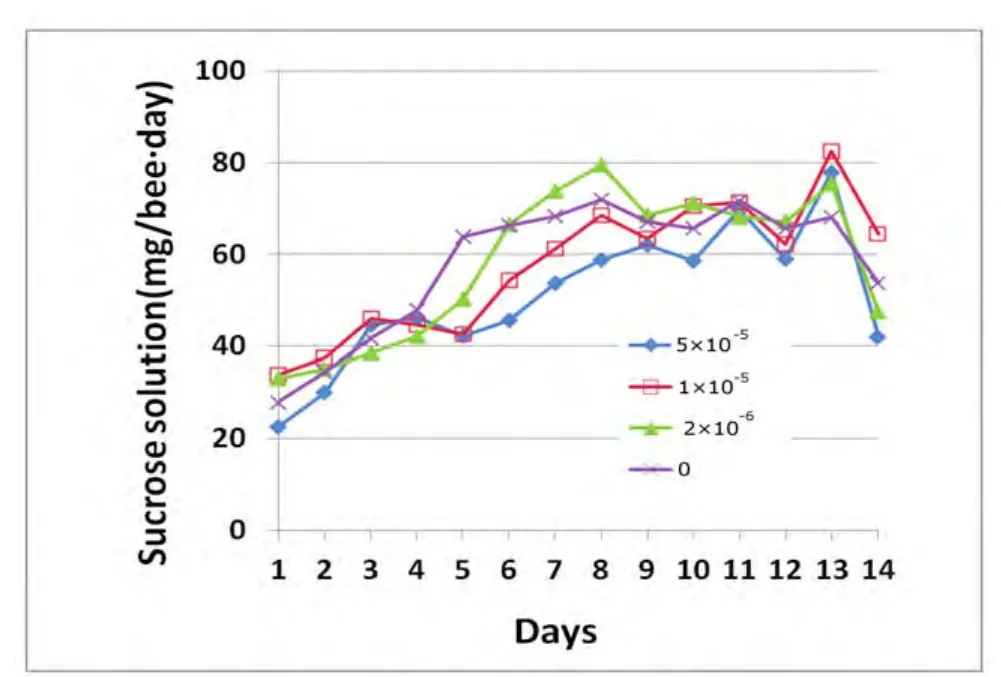
图1 工蜂对不同浓度癸氧喹酯蔗糖液的取食量比较Fig.1 The amount of sugar water consumed by individual worker daily in different treatment of decoquinate
从图1可知,第1天至第8天,各组蜂的日均取食量均呈现逐渐上升的趋势,这与工蜂日龄增长,活动增加,部分组织器官发育,新陈代谢加强,能量需求增大的状况相符。第8至13天,取食量较为稳定,略有小幅度的波动。第14日时,略有下降。方差分析表明,自第1至14天,各组之间日均取食量间均无显著差异(P>0.05),说明,5×10-5、1×10-5、2×10-6g/mL的癸氧喹酯蔗糖糖浆对工蜂的取食量无显著影响。
2.2 癸氧喹酯对意蜂工蜂死亡率的影响
工蜂自由取食3种浓度的癸氧喹酯蔗糖浆后,累计死亡率分别为7.8%,4.4%,2.2%,均小于10%,对照组累计死亡率为3.3%(图2)。卡方检验表明,试验组死亡率与对照组间均无显著差异(P>0.05)。说明,所用药液浓度对工蜂无明显毒性。
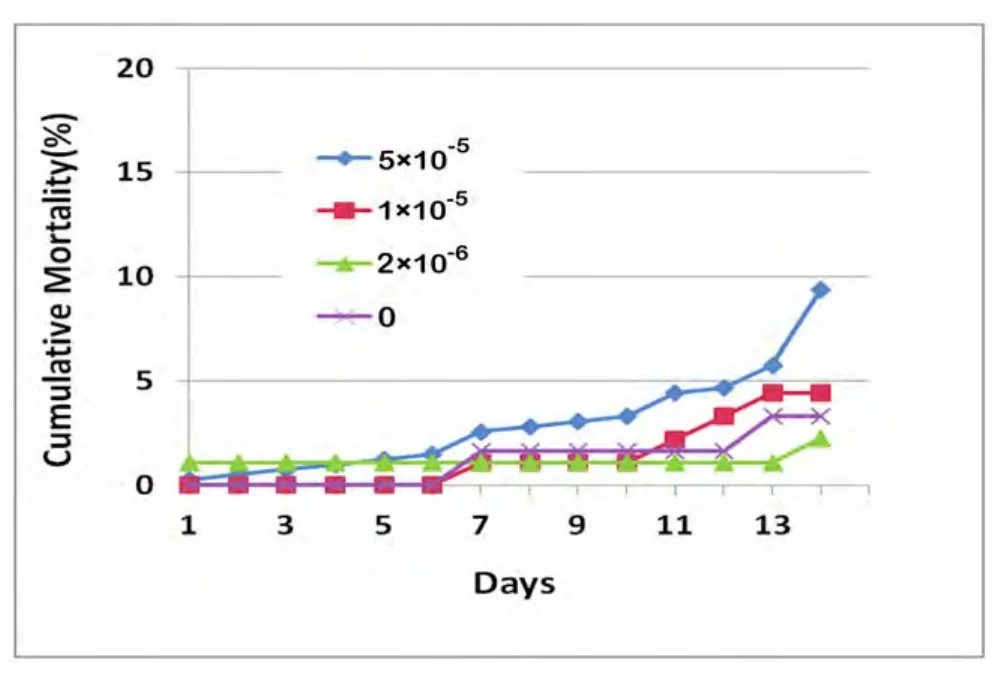
图2 癸氧喹酯对意蜂工蜂累计死亡率的影响Fig. 2 Cumulative mortality of workers after fed with Decoquinate
2.3 癸氧喹酯对意蜂工蜂微孢子虫感染的 影响
新羽化工蜂接种微孢子虫(4400spore/bee),4天后再分别喂3种不同浓度的癸氧喹酯7天,逐只检查工蜂中肠有无微孢子虫感染,结果见图3。
卡方检验表明,饲喂了5×10-5g/mL癸氧喹酯的工蜂,微孢子虫感染的工蜂数量显著低于对照组(χ2=4.133,P=0.042),说明,此浓度药物可显著降低工蜂感染率。而2×10-6、1×10-5g/mL两浓度与对照组的感染数量无显著差异(P>0.05),对降低感染率方面无明显效果。
我们知道,在不同的感染蜂中,感染程度可能存在明显的差异,有的感染重些,有的感染轻些。因此,我们进一步对感染蜂中感染程度差异进行了比较,结果表明(图4),5×10-5、1×10-5、2×10-6g/mL药物组与对照之间均有极显著差异(χ2=27.848,P=0.000 ;,P=0.000,χ2=7.523,P=0.006)。说明,3种浓度的癸氧喹酯均能显著降低工蜂的感染程度,并且随药物浓度的增高,微孢子虫感染程度极显著减轻,抑制效果显著。3种药物效果之间比较显示,5×10-5与1×10-5g/mL试验组之间无显著差异(χ2=0.997,P=0.318),5×10-5、1×10-5g/mL 分别与2×10-6g/mL均有极显著差异(χ2=8.467,P=0.004;χ2=3.903,P=0.048),说明,3种浓度的药物糖浆,浓度越高,抑制效果越好。

图3 癸氧喹酯对西方蜜蜂工蜂中微孢子虫感染的 抑制作用Fig.3 Inhi bition effects of Decoquinate on the infection of Nosema ceranae in honeybee worker(Apis mellifera ligustica)
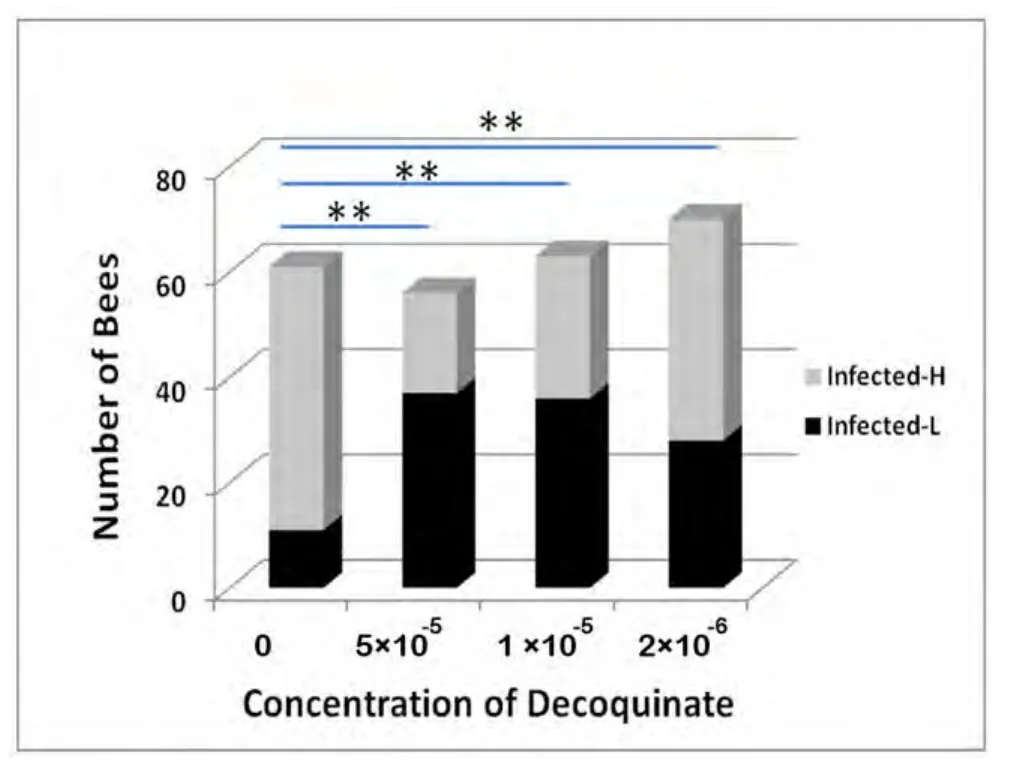
图4 癸氧喹酯对西方蜜蜂工蜂中微孢子虫感染严重程度的抑制作用Fig.4 Inhibitive effect of Decoquinate on the intensity of Nosema ceranae infection in honeybee worker(Apis mellifera ligustica)
2.4 癸氧喹酯对意蜂工蜂中肠蛋白质浓度的影响
对应工蜂中肠微孢子虫感染程度,逐只对中肠蛋白质浓度进行测定,结果见表1。
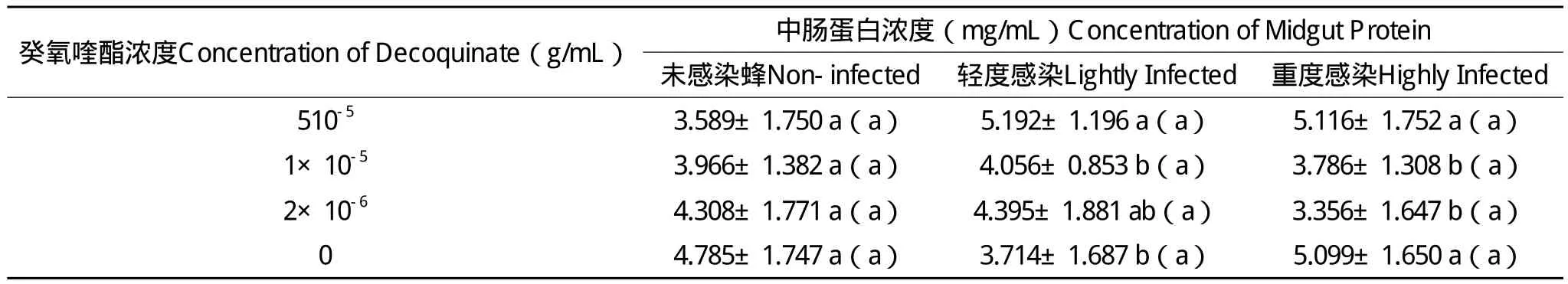
表1 癸氧喹酯对意蜂工蜂中肠蛋白浓度的影响Table 1 Effect of d ecoquinate on the concentration of midgut protein of worker honey bee(Apis mellifera ligustica)
方差分析(one-way ANOVA)表明,在未感染蜂中,4个试验组之间,工蜂中肠蛋白质浓度无显著性差异(P>0.05),说明在未感染蜂中,所喂 药物对中肠蛋白浓度无显著影响。但在轻度感染蜂中,5×10-5g/mL药物组的中肠蛋白浓 度比对照显著的高(P<0.05);在重度感染蜂中,5×1 0-5g/mL药物组与对照无显著差异,但比1×10-5g/mL和2×10-6g/mL的浓度都显著高(P<0.05)。在相同药物浓度下,不同感染程度之间(未感染、轻度感染、重度感染)的中肠蛋白浓度无显著性差异(P>0.05)。说明,感染程度有差异的情 形下,不同浓度的药物对中肠蛋白浓度的影响与感染严重程度差异有关。
2.5 癸氧喹酯对意蜂工蜂中肠 相对活性的影响
花蜜或蜂蜜等糖类是蜜蜂的主要能源食物,葡萄糖苷酶则是由中肠细胞分泌用于分解糖的主要酶类,中肠是蜜蜂微孢子虫最主要的侵染场所。为考查试验药物对工蜂中肠功能的影响,对中肠α-葡萄糖苷酶相对活性进行了检测。结果表明(表2),在无药物的对照组中,轻度感染蜂的相对酶活显著高于重度感染蜂(P<0.05);也高于无感染蜂,但两者之间未见显著差异(P>0.05)。推测微孢子虫感染会导致相对酶活增高,但不同感染程度对酶活影响程度不同。Dussaubat et al.(2012)也曾报道,微孢子虫感染会导致中肠α-葡萄糖苷酶表达上调。推测这种变化可能是由于中肠细胞损伤导致,但对于中肠感染或损伤程度,与酶活变化之间的关系还不清楚。在重度感染蜂中,取食5×10-5g/mL药物后,酶活与对照无显著差异,可能是由于药物抑制了微孢子虫的感染,而使中肠细胞的损伤减轻,酶值恢复正常,而与对照无显著差异。而在1×10-5和2×10-6g/mL两饲喂组中,药物虽然对微孢子虫有一定的抑制作用,但与5×10-5g/mL浓度组相比,仍有显著差异,相对酶活仍高于5×10-5g/mL试验组。
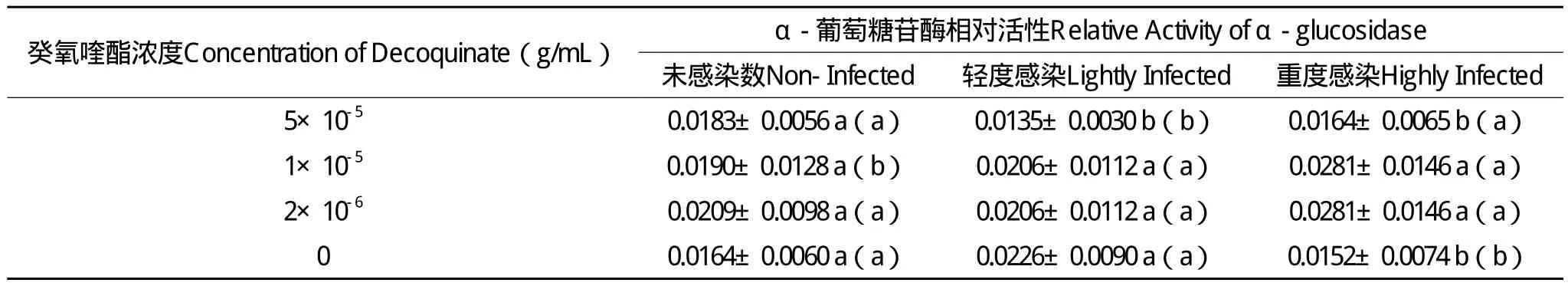
表2 癸氧喹酯对意蜂工蜂中肠α-葡萄糖苷酶相对活性的影响Table 2 Effect of decoquinate on the α-glucosidase relative activity of the midgut in worker honey bee(A. m.ligustica)
3 讨论
本试验表明,短期(7天)饲喂2×10-6、1×10-5、5×10-5g/mL的癸氧喹酯对抑制笼养意蜂工蜂中东方蜜蜂微孢子虫的感染有显著的抑制作用。但对其作用原理并不清楚。据报道:在球虫无性繁殖阶段,癸氧喹酯作用于球虫的囊合子孢子和第一期裂殖体,通过阻断细胞色素系统中的电子传递,即从辅酶Q到细胞色 素C的传递过程而抑制进入子孢子的发育。而且药物在球虫生活史的早期即开始发挥作用(栾明娜等,2009;聂月美等,2011)。药物能引起柔嫩艾美耳球虫(Eimeria tenella)染色体的异常重排,使染色体畸变而导致孢子囊的减少(Del Cachoet al.,2006)。
药物治疗蜂病一直是一个两难的问题。一方面,长期用药可能会导致病原抗药性产生,同时也有药物残留的风险,使得允许在蜂群中使用的抗微孢子虫药物种类极为有限;另一方面,微孢子虫的广泛感染不仅直接造成蜂群损失和产量下降,也损害了蜜蜂为作物授粉的农业效益。因此,许多国家制定了相关规定,仅允许个别药物在蜂群中的使用,同时又制定严格的药残限量来控制药物使用。从目前的防治水平来看,科学合理地使用蜂药,如非生产期用药,合理的停药期,提高蜂群抗病力等综合防治措施,仍是解决重要蜜蜂病害的重要方法。
随着科技水平的发展,一些新兴技术也不断涌现。如RNAi的技术也被应用于蜜蜂微孢子虫的研究中,2010年,基于N.ceranaeADP/ATP transporter基因设计的dsRNA,经口饲喂后,显示了抑制效果,为防治蜜蜂微孢子虫,乃至其他动物微孢子虫病带来了新的曙光(Paldiet al.,2010)。也许在不久的将来,人们能找到更为经济、安全而有效的方式防治微孢子虫病。
[1] Chaimanee V,Chantawannakul P,Chen YP,Evans JD,Pettis JS. Differential expression of immune genes of adult honey bee(Apis mellifera)after inoculated byNosema ceranae. J Insect Physiol.2012,58(8):1090-1095.
[2] Chen YP,Evans JD,Smith IB,Pettis JS.Nosema ceranaeis a long-present and wide-spread microsporidian infection of the European honey bee(Apis mellifera)in the United States. Journal of Invertebrate Pathology.2008,97:186-188.
[3] Costa C,Lodesani M,Maistrello L. Effect of thymol and resveratrol administered with candy or syrup on the development ofNosema ceranaeand on the longevity of honeybees(Apis melliferaL.)in laboratory conditions. Apidologie,2010. 41:141-150.
[4] Costa SF,Weiss LM. Drug treatment of microsporidiosis. Drug Resistance Updates.2000,(3):384-399.
[5]Del Cacho E,Gallego M,Pages M,Monteagudo L.,Sánchez-Acedo C. Effects of the quinolone coccidiostat decoquinate on the r earrangement of chromosomes of Eimeria tenella. International Journal for Parasitology,2006,36:1515-1520.
[6] Dussaubat C,Brunet JL,Higes M,Colbourne JK,Lopez J,Choi JH,Martin-Hernandez R,Botıas C,C ousin M,McDonnell C,Bonnet M,Belzunces LP,Moritz RFA,Le Conte Y,Alaux C. Gut pathology and responses to the microsporidium Nosema ceranae in the honey bee Apis mellifera. PLoS One. 2012,7(5):e37017.
[7] Forsgren E,Fries I. Acidic-benzoic feed and Nosema disease.Journal of Apicultural science. 2005,49(2):81-87.
[8] Fries I,Feng F,da Silva A,Slemenda SB,Pieniazek NJ.Nosema ceranaen. sp.(Microspora,Nosematidae),beeApis cerana(Hymenoptera,Apidae). European Journal of Protistology.1996,32(3):356-365.
[9] Guo FC.,Suo X,Zhang GZ,Shen JZ. Efficacy of decoquinate against drug sensitive laborat ory strains ofEimeria tenellaand field isolates ofEimeriaspp. in broiler chickens in China. Veterinary Parasitology.2007,147:239-245.
[10] Higes M.,Martín-Herná ndez R,Botías C,Bailón EG,González-Porto AV,Barrios L,del Nozal MJ,Bernal JL,Jiménez JJ,Palencia PG,Meana A. How natural infection byNosema ceranaecauses honeybee colony collapse. Environmental Microbiology.2008,10(10):2659-2669.
[11] Maistrello L,Lodesani M,Costa C,Leonardi F,Marani G,Caldo n M, Mutinelli F,Granato A. Screening of natural compounds for the control of nosema disease in honeybees(Apismellifera). Apidologie. 2008,39:436-445.
[12] Paldi N,Glick E,Oliva M,Zilberberg Y,Aubin L,Pettis J,Chen YP,Evens JD. Effective gene silencing in a microsporidian parasite associated with honeybe e(Apis mellifera)colony declines. Appl. Environ. Microbiol. 2010,76(17):5960-5964.
[13] vanEngelsdorp D,Evans JD,Saegerman C,Mullin C,Haubruge E,Nguyen BK,Frazier M,Frazier J,Cox-Foster D,Chen YP,Underwood R,Tarpy DR,Pettis JS,Colony collapse disorder:A descriptive study. PLOSone,2009,4(8):e6481.
[14] Williams GR.,Shutler D,Little CM,Burgher-Maclellan KL,Rogers REL. The microsporidian Nosema ceranae,the antibiotic Fumagilin-B,and western honey bee(Apis mellifera)colony strength.Apidologie.2011,42:15-22.
[15] 陈晓荣,胡积清,方凯,桂淦,戴靖. 抗球虫药—癸氧喹酯的研究进展.安徽农学通报,2010,16(7):184.
[16] 黄少康,董捷,张招荣,洪松涛,马超. 中、意外勤蜂微孢子虫的自然感染率调查.蜜蜂杂志.2006,(8):3-4.
[17] 黄少康,杨守深,王丽华,付中民.中蜂来源的微孢子虫对意蜂工蜂的侵染性研究.中国蜂业.2007,58(1):7-8,12.
[18 ] 黄文诚.防治蜜蜂微孢子虫病的药剂.蜜蜂杂志.2009,(12):22-25.
[19] 刘锋,王强,代平礼,吴艳艳,宋怀磊,周婷. 蜜蜂微孢子虫在中国的自然种系构成初探. 昆虫知识,2008,45(1):963-966.
[20] 栾明娜,周玉武,王慧珍,徐福亮,孙永学,沈祥广,何燕.癸氧喹酯溶液在寄 鸡体内的药动学研究. 兽药与饲料添加剂,2009,14(4):3.
[21] 聂月美,王丽. 新型抗球虫药癸氧喹酯研究进展. 饲料工业,2011,32(18) :60.
[22] 汪家政,范明. 蛋白质技术手册. 北京:科学出版社,2000,42-47.

