俄罗斯蜜蜂保种群的遗传标识码:基因组微卫星标记谱图
Brandorf A Ivoilova M 李兴安 薛运波( Russian Agricultural Academy North-East Agricultural Research Institute named after N.V.Rudnitsky,Kirov 60007; 吉林省养蜂科学研究所,吉林 308)
俄罗斯远东地区位于俄罗斯最东部,属于寒带气候,具备原始、完整的植物生态系统,并且拥有山区森林植物种源基地。大约在十九世纪中期,欧洲人在向俄罗斯符拉迪沃斯托克及其周边海冰边疆(Coastal Primorski region around Vladivostok,Asian Far East;即,俄罗斯远东地区)移居时带入了西方蜜蜂(但是没有资料显示引入蜜蜂究竟是哪一个西方蜜蜂亚种或地理生态型)[1]。国内、外相关文献所描述的俄罗斯蜜蜂(Russia honeybee)就是指分布于这个地区的西方蜜蜂[2-4]。由于这个地区位于东方蜜蜂分布地域的最北端[5],俄罗斯蜜蜂与当地东方蜜蜂共同形成了同域物种,并且在适应寒冷冬季气温和经历漫长越冬期的基础之上具备了抗寒特性。虽然东、西方蜜蜂之间存在生殖隔离机制,但是俄罗斯蜜蜂在同当地东方蜜蜂生存竞争中演变成为螨虫(特别是大满虫)的寄生宿主。这可能是低温驯化(cold acclimation)在长达一百五十多年的进程中,通过诱导蜜蜂行为基因的表达,使俄罗斯蜜蜂进化成为具有抵抗螨虫侵袭的西方蜜蜂[6-9]。因此,俄罗斯蜜蜂既保留了西方蜜蜂所具有的蜂蜜高产这个农艺性状,同时获得了东方蜜蜂所具有的抵御气候寒冷和螨虫侵袭的生物学特征。
二十世纪后期,螨虫侵袭蜜蜂所致的蜂群生产力下降开始成为威胁养蜂生产的主要病虫害;迄今为止,螨虫侵袭蜜蜂所致的蜜蜂消失已经成为蜂群崩溃综合征的一个主要原因[10]。基于上述现状,各国养蜂研究人员推测俄罗斯蜜蜂可能成为培育抗病蜜蜂的育种素材[11]。1997年,俄罗斯蜜蜂首次被引入美国;2005年,美国通过闭锁繁育技术体系在中南部和西部建立了多个俄罗斯蜜蜂保种场;2009年,美国俄罗斯蜜蜂保种群供应商协会开始在全国范围内推广含有部分俄罗斯蜜蜂血统的商业用种蜂王[12]。尽管通过杂交选育方法生产的杂交种不能够将目的基因稳定地传递给后代,但是那些含有俄罗斯蜜蜂部分血统的商业用种蜂王明显地表现了抵抗螨虫侵袭的能力(相对于当地其它商业用种蜂王)[11]。而且,作为俄罗斯蜜蜂保种场建设的一项基础工作,基因组微卫星标记技术作为一项辅助育种手段被用来诊断俄罗斯蜜蜂保种群[12]。Bourgeois等(2010)通过11对西方蜜蜂基因组微卫星引物引发的体外聚合酶链反应(polymerase chain reaction,PCR)方法,将引入美国的俄罗斯蜜蜂与当地的非俄罗斯蜜蜂(包括意大利蜜蜂、卡尼额拉蜜蜂、高加索蜜蜂和一些具备抗病性状的意大利蜜蜂杂交种)鉴别出来。
然而,俄罗斯也是欧洲黑蜂在欧洲的一个主产地[13,14]。现有资料显示,欧洲黑蜂在欧洲向东方向的地理分布极限地域是位于俄罗斯西部平原(欧洲部分)与东部高原、山地(亚洲部分)之间的乌拉尔山脉,即俄罗斯中部地区[15]。为了初步揭示俄罗斯蜜蜂与欧洲黑蜂之间的遗传关系,本研究通过聚合酶链反应体外扩增基因组微卫星标记的方法,对俄罗斯远东地区符拉迪沃斯托克及其周边海冰边疆采样点的俄罗斯蜜蜂(俄罗斯当地人称之为俄罗斯远东黑蜂)和俄罗斯中部地区乌拉尔山脉采样点的欧洲黑蜂(俄罗斯当地人称之为俄罗斯中部蜜蜂)进行了比对分析。
1 材料与方法
1.1 试验时间、地点
本研究野外试验和室内试验均于2012年6月至12月在俄罗斯国家农业科学院东北科研中心东北区罗德尼茨农业科研所(Russian Agricultural Academy North-East Agricultural Research Institute Named after N.V.Rudnitsky)进行;统计学分析于2013年4月至6月在吉林省养蜂科学研究所进行;双方共同参与了论文撰写工作。
1.2 试验材料
通过选择采样方法,分别从俄罗斯远东地区符拉迪沃斯托克及其周边海冰边疆采样点和俄罗斯中部地区乌拉尔山脉采样点的蜜蜂保种场各选择50群蜜蜂,并且从每一群蜜蜂中采集50只体色、大小一致的工蜂,浸泡于盛有无水乙醇或70~75%乙醇溶液的标本瓶。在进行室内试验时,从每一个标本瓶中选取其中的1~2只蜜蜂,并且记录为1个实验样本。
1.3 试验方法
1.3.1 分析样本的制备
这部分操作包括蜜蜂组织的解剖和粉碎2个流程。在生物安全柜工作条件下,从单个蜜蜂个体中分离出头部、胸部。解剖方法是首先用眼科剪刀将蜜蜂腹部去掉,用纸巾吸干蜜蜂剩余组织内的浸泡液;其次,将蜜蜂组织置于2.0-ml塑料离心管中,在离心管内用眼科剪刀将蜜蜂组织剪成碎屑状物质,放入4粒钢珠;最后,将离心管置于-80 ℃冰箱冷冻30 min,从冰箱中取出离心管并且放入组织粉碎仪指定位置,设置粉碎仪的工作参数(频率为27 HZ,时间为30 s),启动组织粉碎仪。
1.3.2 分析样本的消化
待粉碎操作完毕后,取出离心管,放入离心机并且离心(8000 rpm)1 min,在离心管内依次加入1000 μl裂解液(0.03 mol/L 3-羟甲基-氨基甲烷;0.2 mol/L乙二胺四乙酸钠;0.25 mol/L氯化钠;0.1%十二烷基硫酸钠)和20 μl蛋白酶K(10 mg/ml),将离心管放入混匀仪,旋转混匀(50 rpm)10 min。将离心管插入样品管消化架,置于水浴锅(50~55 ℃)消化6~8 h。
1.3.3 基因组的提取
从水浴锅中取出离心管,放入混匀仪并且旋转混匀10 min,离心(5000 rpm)10 min,将上清液转移入另外一个离心管,加入20 μl 核糖核酸酶A(10 mg/ml),将离心管插入样品管消化架,放入水浴锅(37 ℃)消化1 h。从水浴锅中取出离心管,离心(5000 rpm)10 min,将上清液转移入另外一个离心管,加入等体积苯酚,放入混匀仪,旋转混匀10 min,离心(8000 rpm)10 min;取上清液并且转移入另外一个离心管,加入等体积苯酚、氯仿、异戊醇混合液(体积比为25:24:1),放入混匀仪,旋转混匀10 min,离心(8000 rpm)10 min;取出离心管,取上清液并且转移入另外一个离心管,加入等体积氯仿、异戊醇(体积比为24:1)混合液,放入混匀仪并且旋转混匀10 min,离心(8000 rpm)10 min;取出离心管,取上清液并且转移入另外一个离心管,加入二分之一体积异丙醇,混匀后置于4 ℃冰箱1 h以上。放入离心机,离心(12000 rpm)10min,弃上清液而保留沉淀,加入1 ml 75%乙醇;放入离心机并且离心(12000 rpm)5 min,弃上清液而保留沉淀;放入离心机并且离心(12000 rpm)1 min。用10-μl移液尖吸去沉淀周围的残留液体,离心管平放于纸巾上并且暴露2 min,根据沉淀大小在每一离心管内加入10~30 μl T10E1缓冲液(10 mmol/L 3-羟甲基-氨基甲烷,1 mmol/L乙二胺四乙酸钠),于4 ℃冰箱放置1h以上,待完全溶解后贮存于-40 ℃冰箱。
1.3.4 基因组纯度的鉴定
称取1 μl基因组提取物,加入4 ml去离子水,以等量去离子水为对照,分别在可见光波长为260 nm和280 nm条件下测定光密度值。
1.3.5 基因组浓度的鉴定
称取1 μl基因组提取物,加入4 ml去离子水,以等量去离子水为对照,在可见光波长为260 nm条件下测定光密度值,以噬菌体λDNA为阳性标准,通过分光光度计的光密度值与浓度值换算程序模块测定基因组浓度。
1.3.6 基因组完整性的鉴定
称取2 g琼脂糖,加入200 ml 1×TBE溶液(0.1 mmol/L 3-羟甲基-氨基甲烷,0.1 mmol/L硼酸,2 mmol/L乙二胺四乙酸钠),电炉加热直至溶质完全溶解,加入2 μl溴化已锭溶液(10 mg/ml)并且于室温放置1 min,待琼脂糖溶液稍微冷却后缓慢灌入凝胶制胶板,室温放置30 min,待琼脂糖凝固后从凝胶中缓慢拔下梳子,将凝胶放入电泳槽指定位置,加入1×TBE溶液直至液面没过凝胶表面。分别取1 μl基因组提取物、4 μl T10E1和1 μl 上样缓冲液[称取95 g甲酰胺,0.05 g二甲苯青,0.05 g溴酚蓝,0.2 ml氢氧化钠(5 mmol/L),依次放入预先称取的80 ml去离子水中,放入搅拌仔辅助溶解直至溶质完全溶解,加去离子水直至100 ml,分次转移入1.5-ml塑料离心管,-20 ℃保存],并且于1.5-ml离心管内混合,将混合物加入凝胶加样孔。设定电泳参数(电压:100伏特,时间:60 min),启动电泳程序。
1.3.7 扩增基因组微卫星等位序列的引物、PCR反应体系和反应条件
本研究通过参考Bourgeois等的报道借用了其中的PCR扩增基因组微卫星等位序列的引物、反应体系和反应条件[12]。
1.3.8 PCR扩增产物的分离
1.3.8.1 聚丙烯酰胺凝胶的制作
这部分操作包括制备凝胶溶液、安装凝胶制胶板以及灌注凝胶3个流程。
制备凝胶溶液的操作过程如下:称取33.6 g尿素,依次加入10 ml 40%聚丙烯储存液(交联度为5.5%)、8 ml 10×TBE和20 ml去离子水,放入搅拌仔辅助溶解直至溶质完全溶解。
安装凝胶制胶板的操作过程如下:将大、小两块玻璃板用自来水冲洗干净,室温晾干,用95%乙醇彻底擦洗玻璃板工作面(不得遗漏任何残留物),室温放置2 min。在5-ml离心管内配制亲和硅烷溶液(亲和硅烷、冰乙酸和95%乙醇的体积分别为2 μl,10 μl和2000 μl),将其涂布于大玻璃板工作面上,手持单层纸巾,在玻璃板工作面上沿一个方向往返涂抹亲和硅烷溶液约1 min(目的是将亲和硅烷均匀地覆盖于大玻璃板的工作面);将2 ml剥离硅烷涂布于小玻璃板的工作面,手持单层纸巾,在小玻璃板的工作面沿一个方向往返涂抹剥离硅烷约1 min。之后,手持单层纸巾,在大玻璃板的工作面沿一个方向往返涂抹剥离硅烷约1 min(目的是擦掉多余未结合于玻璃板的亲和硅烷);手持单层纸巾,在小玻璃板的工作面沿一个方向往返涂抹剥离硅烷约1 min。上述操作过程大约需要10 min。之后,将2个塑料边条置于大玻璃板的两个侧边,将小玻璃板的工作面对准大玻璃板的工作面并且将它们扣合在一起,用医用胶带填补大、小玻璃在底部的缝隙,用几个铁制夹子固定大、小玻璃的两个侧面,在大、小玻璃板之间的指定位置插人鲨鱼齿梳子以确定大、小玻璃板之间的缝隙宽度,待大、小玻璃板之间的缝隙宽度确定之后,暂时取出鲨鱼齿梳子。
灌注凝胶的操作过程如下:将溶解的凝胶溶液转移入一个100-ml量筒,添加去离子水直至80 ml,在短时间内依次加入80 μl四甲基乙二胺和320 μl过硫酸铵(10 mg/ml),将凝胶溶液转移入一个200-ml三角烧瓶,于靠近大、小玻璃之间安置鲨鱼齿梳子的一侧,缓慢灌注凝胶溶液,大、小玻璃板与水平支持物之间的倾斜度约为45°(在灌注凝胶溶液过程中不得出现气泡)。将大、小玻璃板水平放置于支持物上,在大、小玻璃板之间的指定位置插入鲨鱼齿梳子,将剩余凝胶溶液添加到鲨鱼齿梳子的上表面,用一次性PE手套覆盖鲨鱼齿梳子的上表面,于室温放置,直至过夜。
1.3.8.2 聚丙烯酰胺凝胶的电泳
这部分操作包括预电泳和电泳2个流程。将凝胶板安装入电泳槽指定部位,安装时确保凝胶板大玻璃侧面朝向操作者而小玻璃侧面背离操作者,在电泳槽上、下端加入1×TBE缓冲液直至凝胶板上、下端的凝胶完全浸入液体中。设置预电泳条件(电位:2000伏,电流:200毫安,功率:80瓦,时间:1 h),启动预电泳程序,在电泳过程中待凝胶板玻璃面渐渐变热后暂停预电泳,从凝胶板中拔出鲨鱼齿梳子,左手将鱼尾式移液尖远端缓慢伸入凝胶加样孔,右手将吸耳球插入鱼尾式移液尖近端,借此向凝胶加样孔吹入空气以去除沉积于凝胶加样孔的尿素结晶。在PCR产物中加入3 μl上样缓冲液,混匀后加入凝胶加样孔。设置电泳条件(电位:2000伏,电流:200毫安,功率:55瓦,时间:1.5 h),启动电泳程序。
1.3.9 PCR产物的显影
这部分操作包括凝胶固定、凝胶染色和凝胶显色3个流程。从电泳槽中取出凝胶板,从凝胶板中取出小玻璃板,将大玻璃板及其所负载的凝胶浸入固定液(10%冰乙酸),振荡浸泡30 min。从固定液中取出凝胶板,用去离子水清洗凝胶10 min,将凝胶板浸入染色液(称取2 g硝酸银和3 ml甲醛,依次放入2000 ml去离子水中,混匀直至溶质完全溶解,-20 ℃预冷1h),振荡浸泡30 min。从染色液中快速取出凝胶板,短暂地浸入去离子水中(浸泡约10 s),将凝胶板快速浸入显影液[称取60 g无水硫酸钠,放入2000 ml去离子水,混匀直至溶质完全溶解,-20 ℃预冷1 h。在染色前,将3 ml甲醛和400 μl硫代硫酸钠(10 mg/ml)分别加入显影液,混匀],振荡浸泡直至凝胶中出现清晰的红棕色条带,加入适量固定液,终止显色反应。
2 结果与讨论
从生物样品中制备基因组的前提条件是确保基因组提取具有一定的提取效率,反映基因组提取效率的主要技术指标是测定基因组提取物的基因组纯度、浓度和完整性[16]。在本研究中,蜜蜂样本在实验之前被浸泡于蛋白质变性剂乙醇或70~75%乙醇溶液中,蜜蜂样本在浸泡液中伴随保存时间的延长逐渐从新鲜组织转变为陈旧组织,蜜蜂样本在实验过程中经历了机械粉碎、苯酚萃取等的剧烈操作,它们通过改变基因组纯度、浓度和完整性影响DNA提取效率。蜜蜂基因组纯度的鉴定结果显示,对于每一个蜜蜂样本的基因组,260 nm光密度值与280 nm光密度值的比值均大于2.0(结果未给出);基因组浓度的鉴定结果显示,对于每一个蜜蜂样本的基因组,DNA在基因组提取物的浓度大于阳性标准噬菌体λDNA的浓度(结果未给出);基因组完整性的鉴定结果显示,基因组提取物在1%琼脂糖凝胶电泳谱图中表现为单一条带,它们的位置完全相同并且接近于阳性标准噬菌体λDNA在电泳谱图中的位置(结果未给出)。这提示,在本研究中,基因组的提取具有高的提取效率。鉴于西方蜜蜂微卫星广泛地分布于其基因组;而且,在几个模式昆虫中它的分布密度最高[17],因此,在本研究中,建立在上述结果之上的后续研究是可靠的。
5%聚丙烯酰胺凝胶电泳的结果显示,对于俄罗斯蜜蜂样本(和欧洲黑蜂样本),在A064、K0457B位点(和在UN099位点)出现的不同微卫星等位序列条带的样本数量最大,而在K0725、UN333B位点(和在SV220位点)出现的不同微卫星等位序列条带的样本数量最少(表1)。尽管如此,绝大多数俄罗斯蜜蜂样本(和绝大多数欧洲黑蜂样本)在11个基因组微卫星位点均出现不同微卫星等位序列条带(表1)。这提示,在本研究中,俄罗斯蜜蜂样本(和欧洲黑蜂样本)均在11个基因组微卫星等位序列座位存在微卫星复等位序列。而且,俄罗斯蜜蜂在上述基因组微卫星位点出现的微卫星等位序列条带数基本上与Bourgeois等(2010)的研究结果相一致[12]。这提示,本研究复制了Bourgeois等的研究结果,这为诊断俄罗斯蜜蜂保种群积累了参考数据。
5%聚丙烯酰胺凝胶电泳的结果进一步显示,俄罗斯蜜蜂样本在11个基因组微卫星位点出现的微卫星等位序列条带数构成了特有的基因组微卫星标记谱图,这提示,在本研究中,俄罗斯蜜蜂样本的基因组微卫星DNA等位序列标记谱图明显地不同于欧洲黑蜂样本的基因组微卫星DNA等位序列标记谱图。
通过上述分析并且结合Bourgeois等(2010)的研究结果,本文认为,俄罗斯蜜蜂样本的基因组微卫星DNA等位序列标记谱图作为俄罗斯蜜蜂保种群的遗传标识码,很可能具有特异性(相对于欧洲黑蜂样本的基因组微卫星DNA等位序列标记谱图)。
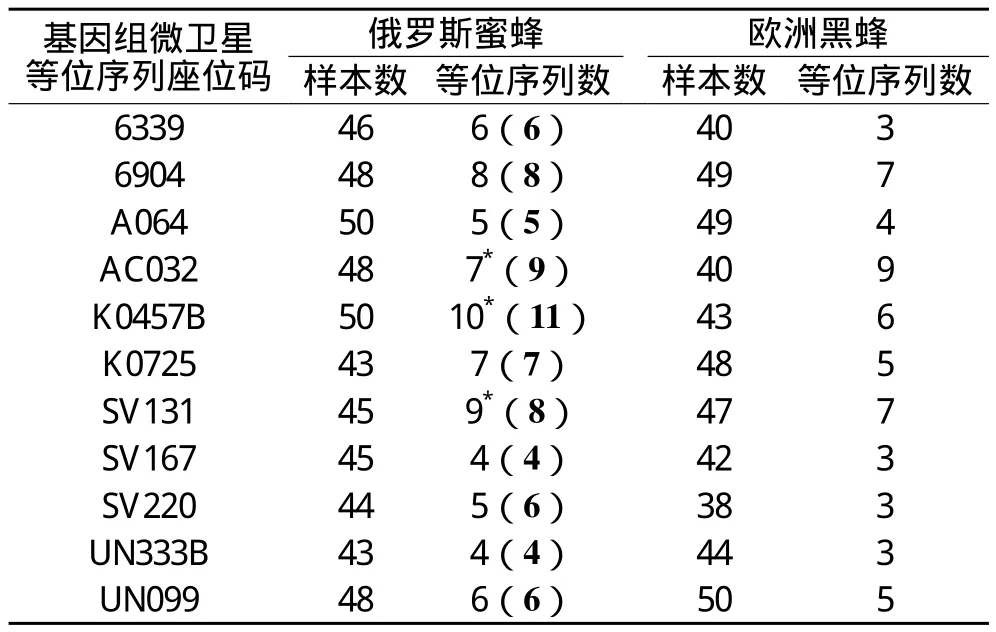
表1 俄罗斯蜜蜂、欧洲黑蜂在11个基因组微卫星等位序列座位的等位序列数统计表
[1] Rinderer TE,de Guzman LI,Kuznetsov V,et al. Resistance to the parasitic mite Varroa destructor in honey bees from far-eastern Russia [J]. Apidologie,2001,32:381-394.
[2] Danka RG,Beaman LD. Flight Activity of USDA-ARS Russian Honey Bees(Hymenoptera:Apidae)During Pollination of Lowbush Blueberries in Maine [J]. Journal of Economic Entomology,2007,100(2):267-272.
[3] Frake AM,De Guzman LI,Rinderer TE. Comparative Resistance of Russian and Italian Honey Bees(Hymenoptera:Apidae)to Small Hive Beetles(Coleoptera:Nitidulidae)[J]. Journal of Economic Entomology,2009,120(1):13-19.
[4] Danka RG,Sylvester H A,Boykin D. Environmental influences on flight activity of USDA-ARS Russian and Italian stocks of honey bees(Hymenoptera:Apidae)during almond pollination [J]. Journal of Economic Entomology,2006,99(5):1565-1570.
[5] Radloff Sarah E,Hepburn C,Hepburn HR,et al. Population structure and classification of Apis cerana [J]. Apidologie,2010,41:589-601.
[6] Vesala L,Salminen TS,Laiho A,et al. Cold tolerance and coldinduced modulation of gene expression in two Drosophila virilis group species with different distributions [J]. Insect Mol Biol,2012,21(1):107-118
[7] Gregory PG,Evans JD,Rinderer T,et al. Conditional immunegene suppression of honeybees parasitized by Varroa mites [J]. J Insect Sci,2005,5:7.
[8] Schoning C,Gisder S,Geiselhardt S,et al. Evidence for damagedependent hygienic behaviour towards Varroa destructor-parasitised brood in the western honey bee,Apis mellifera [J]. J Exp Biol.2012,215(Pt 2):264-271.
[9] Le Conte Y,Navajas M. Climate change:impact on honey bee populations and diseases [J]. Rev Sci Tech,08(2):485-497.
[10] Dainat B,Evans JD,Chen YP,et al. Predictive markers of honey bee colony collapse [J]. PLoS One,2012,7(2):e32151.
[11] Bourgeois AL,Rinderer TE. Genetic characterization of Russian honey bee stock selected for improved resistance to Varroa destructor [J]. J Econ Entomol. 2009,102(3):1233-1238.
[12] Bourgeois L,Sheppard WS,Sylvester HA,et al. Genetic stock identification of Russian honey bees [J]. J Econ Entomol,2010,103(3):917-924.
[13] Miguel I,Iriondo M,Garnery L,et al. Gene flow within the M evolutionary lineage of Apis mellifera:role of the Pyrenees,isolation by distance and post-glacial re-colonization routes in the western Europe [J]. Apidologie,2007,38:141-155.
[14] Meixner MD,Worobik M,Wilde J,et al. Apis mellifera mellifera in eastern Europe-morphometric variation and determination of its range limits [J].Apidologie,2007,38:191-197.
[15] Il'iasov RA,Petukhov AV,Poskriakov AV,et al. Local honeybee(Apis mellifera mellifera L.)populations in the Urals [J].Genetika,2007,43(6):855-858.
[16] Mygind T,Qstergaard L,Birkelund S,et al. Evaluation of five DNA extraction methods for purification of DNA from atherosclerotic tissue and estimation of prevalence of Chlamydia pneumoniae in tissue from a Danish population undergoing vascular repair [J]. BMC Microbiol,2003,3:19.
[17] 朱玉,薛运波,李兴安(通讯作者).基于基因组微卫星的西方蜜蜂遗传谱图和西方蜜蜂地方类群[J].中国蜂业,2012,63(12):12-16.

