鲑鱼皮明胶水解物的抗氧化活性及其对细胞氧化损伤的保护作用
付 余,赵新淮
(乳品科学教育部重点实验室,东北农业大学,黑龙江哈尔滨 150030)
自由基和活性氧可以攻击生物体内的糖蛋白、核酸和脂质,从而加速衰老并诱发癌症、动脉粥样硬化等一系列退行性疾病[1]。寻找天然抗氧化剂预防机体氧化损伤,受到国内外学者的广泛关注。大量的水解物和肽类被发现具有抗氧化性质,这些抗氧化肽源自植物或动物蛋白,包括米糠[2],酪蛋白[3],蛋黄蛋白[4],鱼肉蛋白[5]。明胶作为胶原的衍生产物,是从动物的结缔组织或表皮组织中的胶原经变性转化,再经适当温度提取出来的水溶性物质,它的主要结构与胶原相近[6]。明胶水解物是通过明胶的限制酶水解而得到的,大量研究已证实其具有良好的抗氧化活性[7-11]。然而,由于疯牛病、口蹄疫等动物疾病以及宗教禁忌等原因,人们对陆上动物明胶产品的安全性产生忧虑[12]。因此,寻找明胶的新来源成为一个迫切的课题。本研究利用具有黑龙江特色的鲑鱼(俗称大麻哈鱼)鱼皮明胶,经蛋白酶水解后获得具有抗氧化活性的明胶水解物,并研究其对H2O2诱导的BRL大鼠肝细胞氧化损伤的保护的影响,从而为鲑鱼明胶的开发利用、明胶水解物抗氧化作用机制揭示提供依据。
1 材料与方法
1.1 材料与仪器
鲑鱼(Oncorhynchus keta)鱼皮明胶 金箭明胶有限公司;碱性蛋白酶Alcalase(118kU/mL)、中性蛋白酶(54kU/mL)、木瓜蛋白酶(28kU/g) 购自诺维信公司和国药化学试剂公司;邻苯二甲醛 中国医药上海化学试剂公司;邻二氮菲、邻苯三酚 天津科密欧化学试剂公司;Triton X-100、噻唑蓝(MTT)北京索莱宝科技有限公司;1,1-二苯基-2-苦基苯肼(DPPH)、4-L-羟脯氨酸和DMEM培养基 Sigma公司;BRL大鼠肝细胞 中国科学院上海细胞库。LDH、MDA、GSH试剂盒 碧云天生物工程研究所;其他所有试剂 均为分析纯;水 双蒸水或超纯水。
UV-2401PC紫外可见分光光度计 岛津公司;HF-90 CO2培养箱 力康公司;VD-1320洁净工作台 北京东联哈尔仪器公司;Model 680酶标仪 Bio-Rad公司。
1.2 实验方法
1.2.1 鲑鱼皮明胶基本成分测定 蛋白质,水分,脂肪和灰分测定分别参考GB 50010.3-2011《食品中水分的测定》,GB50010.4-2011《食品中灰分的测定》,GB 50010.5-2011《食品中蛋白质的测定》和GB50010.7-2011《食品中脂肪的测定》。4-羟脯氨酸含量测定根据Edwards(1980)方法[13],略有修改。
1.2.2 明胶水解物的制备 配制浓度为5%(w/w)的明胶溶液。每种蛋白酶的最适条件如下:碱性蛋白酶(pH8.5,55℃),添加量为 1(水解时间 1、7h)和10kU/g(水解时间7h)。木瓜蛋白酶(pH6.0,60℃),添加量为0.5(水解时间1h)和1kU/g(水解时间2、7h)。中性蛋白酶(pH7.0,45℃),添加量为10kU/g(水解时间7h)。反应结束后,迅速置于沸水浴15min。冷却至室温后,5000r/min离心20min,取上清液,真空冷冻干燥后于-20℃保存[7-11]。
1.2.3 明胶水解物的水解度(DH)测定
1.2.3.1 蛋白质含量测定 凯氏定氮法[14]。
1.2.3.2 游离氨基含量测定 邻苯二甲醛(OPA) 法[15]。
取3mL水解物溶液与同体积OPA试剂混合并开始计时,5min后在分光光度计上测定340nm下吸光值。计算公式如下:
DH(%)=[水解物游离氨基含量(μmol/mL)/(5.55×水解物氮含量(mg/mL)-0.39(mmol/g)]÷11.1(mmol/g)×100
其中,0.39mmol/g为测定出的明胶的游离氨基含量;11.1mmol/g为明胶的肽键含量;5.55为明胶氮含量换算系数。
1.2.4 抗氧化活性分析
1.2.4.1 DPPH自由基的清除活性 参考Nsimba等方法[16]。配制20μmol/L DPPH 乙醇溶液,存于暗处待用。1mL DPPH溶液与2mL的样品溶液混合,置于暗处,室温反应30min,517nm处测定吸光值。以无水乙醇作为空白对照,每组实验平行三次。计算公式如下:

其中,A0为空白样吸光值;A1为样品吸光值。
1.2.4.2 羟自由基清除活性 参考 Li等方法[17]。2mL溶于0.15mol/L pH7.4磷酸盐缓冲液的邻二氮菲(0.75mmol/L)与2mL溶于0.15mol/L pH7.4磷酸盐缓冲液的 FeSO4(0.75mmol/L)充分混合,加入1mL样品和1mL 0.01%的 H2O2。混合物在37℃反应60min,536nm下测定吸光值。计算公式如下:

其中,AS,样品吸光值;A1,邻二氮菲,FeSO4和H2O2的对照溶液的吸光值;A0,邻二氮菲和FeSO4的空白溶液的吸光值。
1.2.4.3 超氧阴离子清除活性 采用邻苯三酚自氧化方法[18]。1.0mL 样品与 1.8mL 50mmol/L Tris-HCl(pH8.2)缓冲液混合。25℃下反应 10min,加入0.1mL 10mmol/L的邻苯三酚。320nm处测定吸光值,每0.5min读一次数,读数4min。样品的邻苯三酚氧化速率由吸收率曲线的斜率(ΔA1)计算。空白邻苯三酚自氧化速率通过双蒸水代替样品(ΔA0)来测定。计算公式如下:
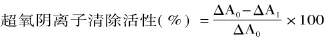
1.2.5 细胞培养 BRL大鼠肝细胞培养于含10%胎牛血清的DMEM培养液中(37℃,5%CO2)培养,细胞以1×104个/mL的密度种于96孔板(每孔200μL)、1×105个细胞/mL密度种于24孔板(每孔500μL),细胞贴壁后待用。
1.2.7 明胶水解物对BRL大鼠肝细胞损伤的保护作用(MTT法) 待细胞贴壁后,加入含不同浓度(0.5、1、2mg/mL)不同水解度的鲑鱼鱼皮明胶水解物。作用24h后,加入 H2O2诱导损伤,条件为5mmol/L,1.5h。结束后,每孔加入5mg/mL MTT溶液20μL,继续培养4h。弃上清液,每孔加入200μL DMSO,振荡混匀,酶标仪上检测光密度(OD)值,波长490nm[19]。加入明胶水解物组为处理组,未加入明胶水解物和H2O2组为阴性对照组,仅加入H2O2组为损伤模型组。计算公式为:

1.2.6 明胶水解物对BRL大鼠肝细胞内LDH、MDA和GSH的含量影响 使用碧云天生物工程研究所LDH、MDA、GSH试剂盒测定,方法参照试剂盒说明书。
1.3 数据的统计分析
采用Excel 2003软件处理实验数据,以Means±SD表示。采用SPSS13.0软件中One-way ANOVA及Duncan多重比较分析,相关性分析采用Pearson相关系数分析。
2 结果与分析
2.1 明胶水解物的制备
采用碱性蛋白酶和木瓜蛋白酶制备的明胶水解物,分别定义为AGH1-3或 PGH1-3,而采用中性蛋白酶制备的水解物定义为NGH。7个明胶水解物的水解度在4.7%~13.5%,制备条件如表1所示。由于蛋白水解物的抗氧化活性大小与水解度有关[7],因此,可以评价抗氧化活性不同的明胶水解物对大鼠肝细胞的氧化损伤保护作用,以及抗氧化活性与细胞保护作用之间的关联。
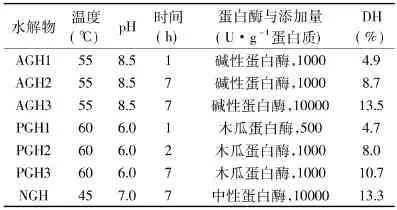
表1 7个明胶水解物的水解条件及水解度Table1 The conditions of hydrolysis and DH of seven hydrolysates
2.2 明胶水解物抗氧化活性
2.2.1 对DPPH自由基清除能力 明胶水解物对DPPH自由基有清除作用。它对DPPH自由基的清除率随浓度的增加而增强(图1),呈现明显的剂量-效应关系。木瓜酶水解物、碱性酶水解物和中性酶水解物在添加量为64mg/mL时达到最大清除率,分别为59.0%、56.8%、61.3%。在相同浓度下,对DPPH自由基的清除率随明胶水解物水解度的增高而逐渐增强。这一点与文献结果[20]一致。

图1 明胶水解物清除DPPH自由基的能力Fig.1 The ability of scanvaging DPPH radicals of gelatin hydrolysates
2.2.2 对羟自由基清除能力 羟自由基属于活性氧的一种,是最活泼的自由基,可以引起生物大分子损伤。因此,研究明胶水解物对羟自由基的清除能力对抗氧化性研究具有重要意义。图2数据表明,明胶水解物对羟自由基的清除率随浓度、水解度的增加而增强,并呈剂量依赖性关系。然而,水解度最大的明胶水解物AGH3在最大浓度时,其清除率仅为33.3%,这说明明胶水解物对羟自由基清除能力较弱。

图2 明胶水解物清除羟自由基的能力Fig.2 The ability of scanvaging hydroxyl free radical of gelatin hydrolysates
2.2.3 对超氧阴离子清除能力 超氧阴离子能加速脂肪氧化和生物体衰老,诱发炎症或癌症等疾病。邻苯三酚自氧化法常用于测定超氧阴离子的清除能力。由图3的数据可以看出,明胶水解物对超氧阴离子的清除率随质量浓度的增加和水解度的加大而呈现增强的趋势,并成显著的量效关系。当质量浓度为64mg/mL时,PGH3最大的清除率为96.5%。可见明胶水解物对超氧阴离子具有极强的清除能力。
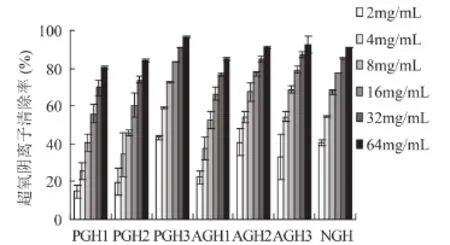
图3 明胶水解物清除超氧阴离子的能力Fig.3 The ability of scanvaging superoxide anion radicals of gelatin hydrolysates
2.3 明胶水解物对肝细胞氧化损伤的保护作用
线粒体是细胞内活性氧代谢的重要细胞器,H2O2诱导细胞氧化损伤,造成线粒体的破坏,最终导致细胞死亡[21]。表2数据显示,当肝细胞与H2O2作用2h后,细胞受到严重的氧化损伤,细胞存活率显著下降至29.0%(p<0.05)。处理组中,当AGH3在2mg/mL时,细胞存活率提高至56.3%,而PGH2在1mg/mL时,细胞存活率仅提高至30.8%。结果表明明胶水解物预先与细胞作用24h,再加入 H2O2氧化损伤2h后,细胞存活率总体上可显著提高(p<0.05)。
细胞由于氧化损伤,细胞膜的完整性受到破坏,乳酸脱氢酶(LDH)释放至培养液,其渗出量可间接反映细胞的损伤程度[22]。如表2所示,当肝细胞与H2O2作用2h后,培养液内的LDH含量达到575.0U/L,这表明细胞受到严重的氧化损伤。然而,明胶水解物预先作用24h后,可显著降低LDH的渗出量(p<0.05)。处理组中,添加AGH3在2mg/mL时,培养液中的LDH渗出量降低至375.7U/L(p<0.05)。
丙二醛(MDA)的生成量是细胞内脂质过氧化的敏感指标,MDA能够破坏蛋白质等生物大分子,造成机体多种疾病的发生[23]。因此,测定H2O2损伤的肝细胞内的MDA含量可以鉴定明胶水解物对细胞抗氧化的保护作用。表2数据显示,正常组细胞内MDA含量仅为9.1nmol/mg蛋白,而当H2O2损伤细胞2h后,MDA含量达到29.0nmol/mg蛋白(p<0.05)。当明胶水解物预先作用24h后,可以显著抑制细胞内的MDA生成量(p<0.05),添加AGH3为2mg/mL的培养液中的MDA含量达到17.6nmol/mg蛋白。

表2 不同浓度明胶水解物对H2O2诱导损伤肝细胞的影响Table2 The impacts of different gelatin hydrolysates on H2O2-induced the oxidative stress in BRL cells
谷胱甘肽(GSH)是细胞内氧化还原平衡主要的非酶调节剂,当细胞受到氧化胁迫时,GSH的含量迅速降低[24]。从表2结果可以看出,当BRL细胞与H2O2作用2h后,细胞内的GSH含量显著下降至56.8nmol/mg蛋白(p<0.05)。而BRL细胞与0.5mg/mL的明胶水解物作用2h后,细胞内的GSH含量升高不显著(p>0.05)。这可能是由于细胞在应对氧化损伤时,细胞内谷胱甘肽过氧化物酶的失活造成的[24]。
2.4 明胶水解物的抗氧化活性与细胞保护作用之间的相关性
由前述的结果可以发现,明胶水解物具有不同的抗氧化活性,而且对大鼠肝细胞显示出不同的保护作用。因此有必要进一步剖析明胶水解物抗氧化性质与细胞保护作用之间的关联性。表3的统计分析结果显示,细胞存活率、LDH渗出量和MDA生成量与明胶水解物的抗氧化活性大小之间具有明显的相关性。其中,LDH渗出量、MDA生成量与抗氧化活性大小呈负相关(r<0),细胞存活率与抗氧化活性大小呈正相关(r>0)。然而,当明胶水解物浓度为1.0mg/mL时,细胞内GSH含量水平与体外化学评价指标间不具有明显的相关性(p>0.05)。总体上,明胶水解物抗氧化性在细胞体系中评价结果与化学方法评价结果具有一致性。因此,鲑鱼皮明胶水解物对BRL大鼠肝细胞损伤的保护作用,与体外清除自由基能力存在一定的相关性。
3 结论
3.1 本研究利用碱性蛋白酶、木瓜蛋白酶和中性蛋白酶水解明胶,制备出水解度在4.7%到13.5%的7个明胶水解物。通过测定其对DPPH自由基、羟自由基和超氧阴离子指标的清除活性,表明明胶水解物具有较强的抗氧化活性,且抗氧化活性随着明胶水解物水解度的增大呈增强趋势。
3.2 通过大鼠BRL肝细胞损伤模型,证明明胶水解物对大鼠肝细胞的H2O2诱导损伤具有保护作用。可以显著的增加细胞存活率,降低LDH渗出量和胞内MDA生成量;不过,细胞内GSH含量变化不显著。明胶水解物对细胞内抗氧化酶活性的影响,还有待进一步研究。
3.3 统计分析结果表明,7个明胶水解物对H2O2诱导细胞损伤的保护作用(细胞存活率增加,以及LDH渗出量和MDA生成量降低),与水解物的体外抗氧化活性存在很好的相关性。因此可以推测,鲑鱼皮明胶水解物对H2O2诱导BRL大鼠肝细胞损伤的保护作用方式,与其清除自由基相关。
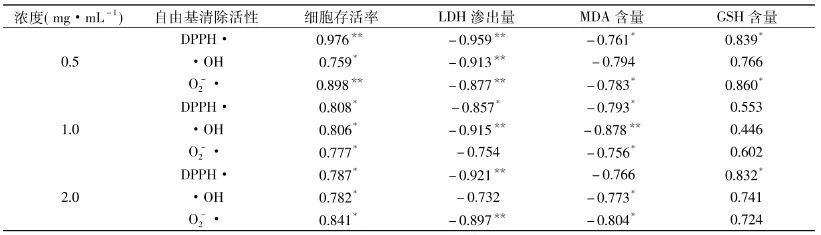
表3 氧化损伤体系中指标与体外化学评价指标间相关性Table3 Correlation between the celluar indices of oxidative stress and indices of chemical evaluation in vitro
[1]Moskovitz J,Yim KA,Choke PB.Free radicals and disease[J].Archives of Biochemistry and Biophysics,2002,397(2):354-359.
[2]Stadtman ER.Protein oxidation and aging[J].Free Radical Research,2006,40(12):1250-1258.
[3]Revilla E,Maria CS,Miramontes E,et al.Nutraceutical composition,antioxidant activity and hypocholesterolemic effect of a water- soluble enzymatic extract from rice bran[J].Food Research International,2009,42(3):387-393.
[4]Suetsuna K,Ukeda H,Ochi H.Isolation and characterization of free radical scavenging activities peptides derived from casein[J].Journal of Nutritional Biochemistry,2000,11(3):128-131.
[5]Sakanaka S,Tachibana Y.Active oxygen scavenging activity of egg-yolk protein hydrolysates and their effects on lipid oxidation in beef and tuna homogenates[J].Food Chemistry,2006,95(2):243-249.
[6]Schrieber R,Gareis H.Gelatine handbook.Theory and industrial practice[M].Germany:Wiley-VCH,2007.
[7]Wu HC,Chen HM,Shiau CY.Free amino acids and peptides as related to antioxidant properties in protein hydrolysates of mackerel(Scomber austriasicus) [J] .Food Research International,2003,36(9-10):949-957.
[8]Mendis E,Rajapakse N,Kim SK.Antioxidant properties of a radicals scavenging peptide purified from enzymatically prepared fish skin gelatin hydrolysate[J].Journal of Agriculture and Food Chemistry,2005,53(3):581-587.
[9]Giménez B,Alemán A,Montero P,et al.Antioxidant and functional properties of gelatin hydrolysates obtained from skin of sole and squid[J].Food Chemistry,2009,114(3):976-983.
[10]刘海英,李丁,李双祁,等.斑点叉尾鮰鱼皮明胶水解方法的研究[J].食品工业科技,2007,28(2):176-178.
[11]胡娟,李琳,胡松青.鱼鳞明胶酶解制备超氧阴离子清除活性肽的研究[J].食品工业科技,2010,31(4):293-295.
[12]Jonglareonrak A,Benjakul S,Visessanguan W,et al.Isolation and characterisation of acid and pepsin-solubilised collagens from the skin of Brownstripe red snapper(Lutjanus vitta) [J].Food Chemistry,2005,93(3):475-484.
[13]Edwards CA,O’Brien WD.Modified assay for determination of hydroxyproline in a tissue hydrolyzate[J].Clinica Chimica Acta,1980,104(2):161-167.
[14]《食品中蛋白质的测定》[S].GB 50010.5-2011.
[15]Spellman D,Mcevoy E,O’Cuinn,et al.Proteinase and exopeptidase hydrolysis of whey protein:comparison of the TNBS,OPA and pH stat methods for quantification of degree of hydrolysis[J].International Dairy Journal,2003,13(6):447-453.
[16]Nsimba R Y,KikuzakiH,Konishi Y.Antioxidant activity of various extracts and fractions ofChenopodium quinoa and Amaranthus spp.seeds[J].Food Chemistry,2008,106(2):760-766.
[17]Li YH,Jiang B,Zhang T,et al.Antioxidant and free radicalscavenging activities of chickpea protein hydrolysate(CPH)[J].Food Chemistry,2008,106(2):444-450.
[18]Tang XY,He ZY,Dai YF,et al.Peptide fractionation and free radical scavenging activity of zein hydrolysate[J].Journal of Agricultural and Food Chemistry,2010,58(1):587-593.
[19]Mosmann T.Rapid colorimetric assay for cellular growth and survival:Application to proliferation and cytotoxicity assays[J].Journal of Immunological Methods,1983,65(1-2):55-63.
[20]Wu HC,Chen HM,Shiau CY.Free amino acids and peptides as related to antioxidant properties in protein hydrolysates of mackerel(Scomber austriasicus) [J] .Food Research International,2003,36(9-10):949-957.
[21]Mronga T,Stahnke T,Goldbaum O.Mitochondrial pathway is involved in hydrogen-peroxide-induced apoptotic cell death of oligodendrocytes[J].Glia,2004,46(4):446-455.
[22]Ying HS,Gottron FJ,Choi DW.Assessment of cell viability in primary neuronal cultures.Current Protocols in Neuroscience[M].John Wiley & Sons,Inc.,2001.
[23]Farmer EE,Davoine C.Reactive electrophile species[J].Current Opinion in Plant Biology,2007,10(4):380-386.
[24] García - NebotMJ,Cilla A,Alegría A,etal.Caseinophosphopeptides exertpartialand site-specific cytoprotection against H2O2-induced oxidative stress in Caco-2 cells[J].Food Chemistry,2011,129(4):1495-1503.

