黑木耳天然黑色素理化性质及其抗氧化活性的研究
邹 宇,尹冬梅,胡文忠,姜爱丽,陈 晨,顾振新
(1.大连民族学院生命科学学院,辽宁大连 116600;2.上海应用技术学院生态技术与工程学院,上海 201418;3.南京农业大学食品科技学院,江苏南京 210095)
黑色素是广泛存在于生物体中的一类天然色素,通常是由多酚或吲哚化合物氧化聚合而形成,具有分子量高、结构复杂等特点[1]。许多研究证实,生物体内的黑色素具有抗氧化、抗辐射、抗病毒、提高免疫力等许多重要的生理功能,具有广泛的开发应用潜力[2]。黑木耳子实体是一种黑褐色可食用的大型真菌,其含有丰富的黑色素,是中国越来越流行的“黑色食品”之一。目前,有许多关于黑色素分离和特性研究的报道,并且黑色素被认为是这些黑色食品中最重要的功能成分之一[3]。然而,有关黑木耳子实体中黑色素的研究报道却很少见,且多数研究集中于色素的提取和初步的理化性质分析[4-5]。迄今为止,黑木耳黑色素的抗氧化等功能特性方面的研究尚未见报道。故本实验对黑木耳天然黑色素的理化性质和抗氧化活性进行较为全面的研究,旨在为天然功能性色素的开发利用提供参考。
1 材料与方法
1.1 材料与仪器
黑木耳子实体干品 黑龙江省东宁县市场,粉碎后过40目筛;亚油酸、2,2'-偶氮二异丁基脒二盐酸盐(AAPH) 美国sigma公司;羟自由基测定试剂盒 南京建成生物有限公司;其余试剂 均为国产分析纯。
CR-400色差计 日本柯尼克美能达公司;UV-2802紫外可见分光光度计 美国尤尼科公司;KQ250-DB超声波清洗器 昆山市超声仪器有限公司;TDL-40B离心机 上海安亭科学仪器厂;GHH-6型数显恒温水浴锅 国华电器有限公司。
1.2 黑木耳天然黑色素提取与纯化
参照Zou等[6]的提取与纯化方法。黑木耳子实体干粉加入蒸馏水(液固比为43∶1,mL/g),NaOH调pH为12,43℃超声(功率 250W)提取 36min,样品4000r/min离心 5min,HCl调 pH 为 2,4000r/min离心5min,得黑色素粗品。黑色素粗品用7mol/L HCl 100℃下水解 2h,离心(10000r/min,20min),沉淀先后用氯仿、乙酸乙酯和乙醇洗涤。纯化后的黑色素冻干并于-20℃保存。
1.3 黑木耳天然黑色素的理化性质
1.3.1 粉末颜色 黑色素粉末的外观颜色通过色差计测定,色差值采用L*、a*和b*表示。
1.3.2 溶解性 根据Wang等[7]的测定方法略作修改,100mg黑色素加入10mL水、酸(pH <3)、碱(pH>8)和常见的有机溶剂(乙醇、甲醇、氯仿、丙酮、乙醚、石油醚、苯、乙酸乙酯、正丁醇)中,搅拌1h,静置0.5h,观察黑色素的溶解情况。
1.3.3 热稳定性 将50mg/L的黑色素溶液(pH9.0)分别置于25、50、75和100℃的恒温水浴中保温4h,每隔1h取样,参考Wang等[7]的黑色素测定方法,测定样品400nm吸光度值。
1.3.4 光稳定性 将50mg/L的黑色素溶液(pH9.0)分别置于暗处(对照)、自然光和白炽灯光(300lx)下照射5d,在0、1、3和5d时分别取样,测定400nm 吸光度值[7]。
1.4 黑木耳天然黑色素的抗氧化活性
1.4.1 还原力 在 Oyaizu等[8]方法基础上适当调整。取黑色素溶液1mL,依次加入3.0mL 0.5mol/L磷酸盐缓冲液(pH6.6)和2.5mL 1%六氰合铁酸钾溶液,50℃保温20min,再加入2.5mL 10%三氯乙酸溶液,3000r/min离心10min,取上清液2.5mL,依次加入2.5mL蒸馏水,0.5mL 0.1%三氯化铁溶液,静置10min,700nm下测定吸光度值。
1.4.2 羟自由基清除能力 采用羟自由基测定试剂盒,Fenton反应产生羟自由基,H2O2的量与羟自由基量呈正比,当给予电子受体后,用griess试剂显色,形成红色物质,其呈色与羟自由基的量成正比关系。式中,A0为空白样品反应后吸光度值;A1为样品反应后吸光度值。
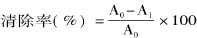
1.4.3 脂质过氧化抑制能力 参考Gabrielska等[9]的测定方法。取1mL样品溶液于10mL具塞试管中,依次加入2mL 2.51%亚油酸无水乙醇溶液,4mL 0.05mol/L的磷酸盐缓冲液(pH7.0),2mL蒸馏水,0.417mL 0.1mol/L AAPH,密闭后置于暗处,37℃保温200min。取0.1mL混合溶液,加入9.7mL 75%的乙醇和0.1mL 30%硫氰酸铁,再加入0.1mL 0.02mol/L氯化亚铁(溶解于3.5%盐酸中),混匀后反应5min,500nm测定吸光度值。

式中,A0为空白样品吸光度值;A1为样品反应后吸光度值。
2 结果与分析
2.1 黑木耳天然黑色素的理化性质
2.1.1 颜色 色差计测定结果中L*表示亮度,a*表示红/绿,b*表示黄/蓝。由表1可知,L*值较大,而a*值和b*较小,这表明黑木耳黑色素是趋近于黑色并略带红色和黄色的固体粉末。黑木耳子实体生长在自然环境中的固体培养基上,其黑色素包含了一些其它物质,如蛋白质、碳水化合物和金属离子等[10],这些物质已经成为黑木耳黑色素的一部分,因此表现出红色或黄色等多种颜色。

表1 黑木耳黑色素的外观颜色Table1 Color values of A.auricula melanin
2.1.2 溶解性 黑木耳黑色素不溶于水,也不溶于乙醇、甲醇、氯仿、丙酮、乙醚、石油醚、苯、乙酸乙酯、正丁醇等常见的有机溶剂,但极易溶解于碱性溶液(pH>8)中,而在pH小于3的酸性溶液中沉淀。黑木耳黑色素的溶解性与报道的乌骨鸡[10]、红茶叶[11]、山杏种皮[12]中黑色素的溶解性十分相似。
2.1.3 热稳定性 由表2可知,黑木耳黑色素在25℃加热4h仅损失4.7%,随着加热温度的升高和加热时间的延长,黑木耳色素的保存率有所下降,但在100℃加热4h后,色素保存率仍达到88.0%,这表明黑木耳黑色素较为耐热,具有一定的热稳定性,这与张金萍等[13]的研究结果相一致。
2.1.4 光稳定性 光照是对色素稳定性影响比较显著的因素之一。由表3可知,黑木耳黑色素在暗处保存5d,其损失率不超过1%。但是在自然光下存放仅1d,色素损失率就达到了16.0%,存放5d时残存的黑色素仅为25.3%。黑木耳黑色素在白炽灯照射下,具有与自然光照射时相似的变化规律,白炽灯照射5d时黑色素残存率为55.4%,这表明光照对黑色素的破坏作用随时间的延长而增强,且光照强度越高,破坏程度越大。这可能是由于黑木耳黑色素在光照过程中其结构发生了变化,导致稳定性降低[14]。
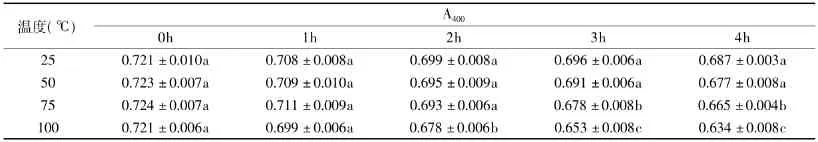
表2 温度对黑木耳黑色素稳定性的影响Table2 Effect of temperature on stability of A.auricula melanin

表3 光照对黑木耳黑色素稳定性的影响Table3 Effect of different light sources on stability of A.auricula melanin
2.2 黑木耳天然黑色素的抗氧化活性
2.2.1 还原力 测定还原力是为了检验样品的电子供应能力,还原力强表明样品可供应较多的电子。这些电子可使Fe3+还原为Fe2+,同时参与自由基反应,使自由基变成更加稳定的物质。从图1可以看出,黑木耳黑色素的还原力随着添加浓度的增大而成正比例上升趋势,这表明黑木耳黑色素是良好的电子供应者,能提供电子并将自由基转变为稳定的产物,从而终止自由基链式反应。

图1 黑木耳黑色素的还原力Fig.1 Reducing power of A.auricula melanin
2.2.2 羟自由基清除能力 羟自由基通常产生于抽氢反应和加成反应过程中,其可轻易通过细胞膜,并与细胞内的碳水化合物、蛋白质、DNA等生物大分子发生反应,从而导致细胞损伤。由图2可知,在0.2~1.0mg/mL浓度范围内,黑木耳黑色素对羟自由基的清除率在30%~50%之间,这与提取自红茶叶中黑色素的羟自由基清除率相同[15]。
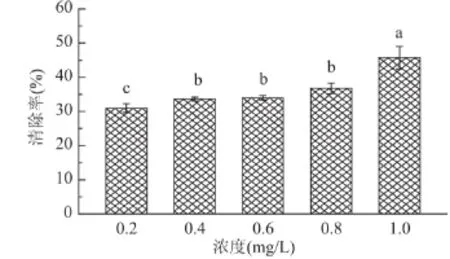
图2 黑木耳黑色素清除羟自由基能力Fig.2 Hydroxyl radical-scavenging activities of A.auricula melanin
2.2.3 脂质过氧化抑制能力 脂质过氧化可使细胞膜内的磷脂、酶、多不饱和脂肪酸和核酸等发生改变,降低细胞膜的流动性和通透性,最终导致细胞死亡。由图3可见,黑木耳色素浓度在0.6mg/mL以下时,脂质过氧化抑制率随添加浓度的增加而增大,但当浓度超过0.6mg/mL时,脂质过氧化的抑制率保持在43%左右不变,此抑制率略低于乌骨鸡黑色素的脂质过氧化抑制率[10]。
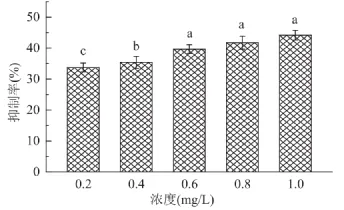
图3 黑木耳黑色素抑制脂质过氧化能力Fig.3 Lipid peroxidation-inhibiting activities of A.auricula melanin
3 结论
提取并纯化了黑木耳子实体中的天然黑色素,色差计测得黑色素粉末呈黑色,略带红色和黄色,不溶于水和有机溶剂,仅溶于碱性溶液;黑木耳黑色素具有较强的热稳定性,但对光照敏感,长时间强光照射可引起黑色素大量损失;黑木耳黑色素具有较强的抗氧化活性,还原力随添加浓度的增加而增大,1.0mg/mL浓度的黑色素溶液羟自由基清除率和脂质过氧化抑制率均在40%以上。
[1]Riley PA.Melanin[J].The InternationalJournalof Biochemistry and Cell Biology,1997,29(11):1235-1239.
[2]Tanm,Gan D,Wei L,et al.Isolation and characterization of pigment from‘Cinnamomum burmannii’peel[J].Food Research International,2011,44:2289-2294.
[3]Chen SR,Jiang B,Zheng JX,etal.Isolation and characterization of natural melanin derived from silky fowl(Gallus gallus domesticus Brisson) [J].Food Chemistry,2008,111:745-749.
[4]张莲姬,张敬爱.盐酸浸提木耳黑色素最佳工艺参数筛选研究[J].沈阳农业大学学报,2007,38(3):434-436.
[5]李琦,侯丽华,刘鑫,等.黑木耳黑色素鉴定及提取工艺优化[J].食品科学,2010,31(16):87-92.
[6]Zou Y,Xie C,Fang G,et al.Optimization of ultrasoundassisted extraction of melanin from Auricularia auricula fruit bodies[J].Innovative Food Science Emerging Technologies,2010,11:611-615.
[7]Wang H,Pan Y,Tang X,et al.Isolation and characterization of melanin from ‘Osmanthus fragrans’seeds[J].LWT- Food Science and Technology,2006,39:496-502.
[8]Oyaizu M.Studies on product of browning reaction prepared from glucose amine[J].Japanese Journal of Nutrition,1986,44:307-315.
[9]Gabrielska J,Oszmianski J.Antioxidant activity of anthocyanin glycoside derivatives evaluated by the inhibition of liposome oxidation[J].Journal of Biosciences,2005,60:399-407.
[10]Tu Y,Sun Y,Tian Y,et al.Physicochemical characterisation and antioxidant activity of melanin from the muscles of Taihe Black-bone silky fowl(Gallus gallus domesticus Brisson)[J].Food Chemistry,2009,114:1345-1350.
[11]Sava VM,Galkin BN,Hong MY,et al.A novel melanin-like pigment derived from black tea leaves with immuno-stimulating activity[J].Food Research International,2001,34:337-343.
[12]姚增玉,赵忠,李科友,等.山杏种皮黑色素理化性质研究[J].食品与发酵工业,2007,33(9):37-40.
[13]张金萍杜,孟浩,王敬文.酶法合成黑色素的稳定性研究[J].氨基酸和生物资源,2007,29(1):8-10.
[14]Geng J,Yu S,Wan X,et al.Protective action of bacterial melanin against DNA damage in full UV spectrums by a sensitive plasmid-based noncellular system[J].Journal Biochemical and Biophysical Methods,2008,70:1151-1155.
[15]Hung YC,Sava VM,Makan SY,et al.Antioxidant activity of melanins derived from tea:comparison between different oxidative states[J].Food Chemistry,2002,78:233-240.

