血氨在士兵体能训练监控中的应用
张建平,彭 朋,薄 海,张 磊,刁秋霞,王大宁,秦永生
在军事体能训练过程中,全面系统地对参训者进行运动医务监督,是科学安排训练方法、确定合理训练负荷、预防训练伤病不可或缺的一项工作[1],而探寻简便易行的生理生化指标是运动医务监督顺利开展的重要保证[2]。笔者前期的研究显示,血乳酸(blood lactic acid,Bla)[3]、肌酸激酶(creatine kinase,CK)[4]和血浆游离DNA(cell-free plasma DNA,cf-DNA)[5]可作为大强度无氧训练的监控指标,但在训练实践应用中均存在不足。本研究以90名武警某部战士为受试对象,分析武警战士无氧训练科目(100 m 跑、400 m 障碍和蛙跳)前后血氨(blood ammonia,BA)的变化及与其他生化指标的相关性,探讨BA 作为军事体能训练监控简便易行指标的可行性。
1 对象与方法
1.1 对象 随机选取武警某部战士90 名,男性,年龄(22.6 ±2. 7)岁,身高(1. 74 ± 0. 05)m,体重(73.1 ±4.2)kg,训练年限(2.5 ±0.7)年。受试者身体健康,无服药史,无心血管疾病、糖尿病、感染、骨关节及其他严重疾患病史和家族史。
1.2 分组及训练手段安排 受试者随机分为3组,每组30 人,分别进行100 m 跑、400 m 障碍和蛙跳训练。训练安排如下,100 m 跑组:100 m×4 次全力跑,共3 组,每次之间间歇90 s,组间间歇3 ~5 min;400 m 障碍组:进行2 次400 m 障碍跑,跑次间隔10 ~15 min;蛙跳组:30 m 蛙跳×4 次,每次间隔3 ~5 min。训练过程中所有受试者均佩戴遥测心率表(Polar FT1,芬兰)以记录心率(heart rate,HR)。
1.3 指标测试 所有受试者在实验前24 h 内均未进行过剧烈运动。各组训练前和训练后即刻分别取指尖血与静脉血测定各生化指标。取指尖血20 μl测定BA(日本产PA-4130 型便携式血氨分析仪)和Bla(日本产LT-1710 型便携式血乳酸仪)含量,单位分别为:μmol/L 和mmol/L。肘正中静脉取血3 ml,于上海产TGL-20M 型台式低温离心机中以3000 r/min 离心取血浆,测定血CK 和cf-DNA。CK 活性测定方法:取20 μl 血浆用酶动力学法测定血浆CK 活性,试剂盒购自南京建成生物工程研究所,仪器:半自动生化分析仪(A6,北京),单位:U/L。cf-DNA 含量测定方法[6]:用微量基因组DNA提取试剂盒(QIAamp DNA Blood Mini Kit,Qiagen,德国)提取cf-DNA,方法按试剂盒说明书进行。取20 μl cf-DNA 用Quant-iT dsDNA HS 试剂盒和Qubit 荧光仪测定cf-DNA 含量。
1.4 统计学处理 所有数据用SPSS 15.0 统计软件包进行处理。各组训练前后的指标比较使用配对t 检验,BA 与其他各生化指标的关系使用简单相关分析并计算Pearson 相关系数。以P <0.05 为差异有统计学意义。
2 结果
2.1 各组生化指标的变化 3 组各指标基础值(训练前水平)均无统计学差异(P >0.05)。训练后与训练前比较,100 m 跑组BA、CK、cf-DNA 和HR 均显著升高(P <0. 01),而Bla 无统计学变化(P >0.05);400 m 障碍组和蛙跳组所有指标均显著升高(P <0.01,表1)。
表1 各组体能训练后生化指标的变化(n=30;±s)

表1 各组体能训练后生化指标的变化(n=30;±s)
注:与本组训练前比较,①P <0.01
组别BA(μmol/L)Bla(mmol/L)CK(U/L)cf-DNA(pg/μl) HR(次/min)100 m 跑组训练前82.2 ±17.31.86 ±0.12175.3 ±56.565.5 ±8.668 ±5训练后239.1 ±18.5①2.19 ±0.67286.5 ±67.9①138.1 ±12.9①189 ±15①400 m 障碍组训练前75.3 ±15.21.75 ±0.16184.6 ±45.872.6 ±9.866 ±3训练后186.6 ±27.9①12.41 ±2.98①365.8 ±58.4①186.2 ±21.1192 ±17①蛙跳组训练前78.8 ±19.41.69 ±0.30194.3 ±64.375.0 ±12.670 ±8训练后194.6 ±30.1①7.71 ±1.25①415.2 ±85.0①285.7 ±32.6①185 ±14①
2.2 BA 与其他生化指标的相关分析 100 m 跑组BA 与CK、cf-DNA 均呈显著正相关(P <0.05 或P<0.01),而与Bla 无显著相关性(P >0.05);400 m障碍组和蛙跳组BA 与Bla、CK、cf-DNA 均呈显著正相关(均为P <0.01)。见表2。
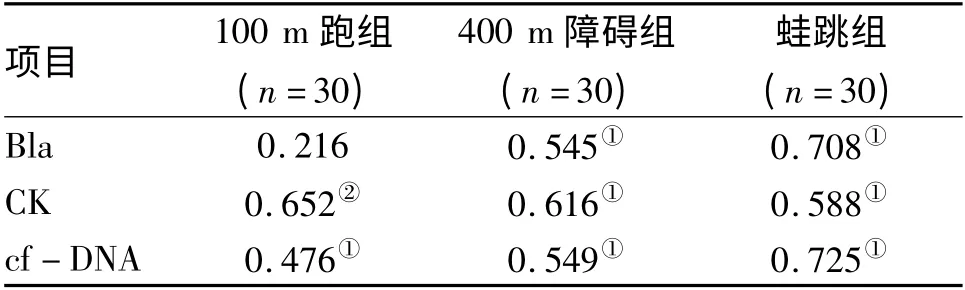
表2 体能训练后BA 与其他生化指标的相关分析
3 讨论
在士兵体能训练中,典型的无氧训练项目包括100 m 跑、400 m 障碍和力量训练(如蛙跳)。无氧训练中产生的主要代谢产物是Bla 和BA。通常情况下,以Bla 浓度评定糖酵解供能能力和功率,以BA 的浓度评定ATP-CP 系统供能能力和功率,对这两种物质的监测是无氧训练强度的主要生化监控手段[3]。本研究中,100 m 跑组训练后BA 显著升高,而Bla 变化不大,BA 与Bla 无显著相关性,说明100 m 跑属于典型磷酸原系统供能的无氧训练科目,BA 可用于监测其训练负荷。正常生理条件下,血液中氨主要以氨离子(NH4+)形式存在,游离形式的比例小于5%。BA 水平是氨进入血液和从中消除的综合反映。安静时人体内血氨保持相对较低的水平,肝可以有效的消除。短时间剧烈运动时,经氨基酸代谢过程产生的氨很少,骨骼肌中的氨主要由腺酐酸脱氨酶催化AMP 脱氨生成[7],氨进入血液引起体内氨的生成和消除平衡被破坏,使BA 水平升高。所以,短时间剧烈运动时BA 水平的变化,反映磷酸原系统的代谢平衡状况。400 m 障碍组和蛙跳组在训练后BA 和Bla 均显著升高,且BA 与Bla呈正相关,说明上述科目属于磷酸原与糖酵解混合供能的无氧训练方式,BA 与Bla 均可监测其运动负荷大小。由于便携式乳酸仪一次只能测试一个样品,测试时需要多个乳酸仪,而一台便携式血氨测试仪则可多个样品同时测试,因此,可用BA 代替Bla对此类科目进行机能监控。此外,有研究表明,BA水平随运动强度的递增明显升高,当运动强度高于BA 上升的临界强度(HR 处于180 次/min 左右)时,AMP 脱氨基作用显著增强[8]。本实验中,各科目训练后所有受试者HR 均高于180 次/min,因此可将BA 作为监测无氧训练运动强度的理想指标。
研究证实,CK[4]和cf-DNA[5]均是监测军事训练强度和肌肉损伤的重要指标。大强度剧烈运动通过机械牵拉及诱导肌细胞内能量代谢紊乱造成肌节降解、膜通透性增加,细胞内附于肌节的CK 漏出入血从而造成血CK 增高[9];同时伴有氧化应激导致肌细胞DNA 损伤甚至凋亡与坏死[10],DNA 片段释放入血形成cf-DNA[11,12]。在本研究中,CK 与cf-DNA 在各组训练后均显著升高,与本课题组前期的研究一致[3,5]。由于CK 和cf-DNA 测定只能在实验室内完成且需要较长时间,限制了其在军事训练中的应用。笔者发现,各训练科目前后BA 与CK、cf-DNA 均显著正相关,进一步提示BA 不仅可作为训练负荷监控的标志物,而且其检测设备具有便携、简单、经济、快捷、有效等特点,在训练过程中可迅速反馈机体生理变化的信息,以便教练员及时调整训练负荷,避免训练伤病的发生。
[1] 秦永生,彭 朋. 在武警战士体能训练中建立以医务监督为核心的科学施训方案[J]. 武警医学,2011,22(10):829-832.
[2] 彭 朋,薄 海,王大宁,等. 连续3 d 大负荷军事训练对武警战士淋巴细胞亚群的影响[J]. 武警医学,2012,23(11):941-943.
[3] 雷志勇,秦永生,吴志东,等. 一次大强度体能训练对战士某些生化指标的影响[J]. 解放军医学杂志,2007,32(8):877-878.
[4] 彭 朋,薄 海,陈 锋,等. 血清肌酸激酶在军事训练中的应用展望[J]. 中国急救复苏与灾害医学杂志,2011,6(4):355-357.
[5] 彭 朋,薄 海,张 磊,等. 长期军事训练对氧化应激水平和DNA 损伤的影响[J]. 中国急救复苏与灾害医学杂志,2011,6 (11):948-950.
[6] Kadam S K,Farmen M,Brandt J T. Quantitative measurement of cell-free plasma DNA and applications for detecting tumor genetic variation and promoter methylation in a clinical setting[J]. J Mol Diagn,2012,14(4):346-356.
[7] Yges C,Urena R,Leon C,et al. Blood ammonia response during incremental and steady-state exercise in military staff[J]. Aviat Space Environ Med,1999,70(10):1007-1011.
[8] Bassini-Cameron A,Monteiro A,Gomes A,et al.Glutamine protects against increases in blood ammonia in football players in an exercise intensity-dependent way[J]. Br J Sports Med,2008,42(4):260-266.
[9] Kenney K,Landau M E,Gonzalez R S,et al. Serum creatine kinase after exercise:drawing the line between physiological response and exertional rhabdomyolysis[J]. Muscle Nerve,2012,45(3):356-362.
[10] Kruger K,Frost S,Most E,et al. Exercise affects tissue lymphocyte apoptosis via redox-sensitive and Fasdependent signaling pathways[J]. Am J Physiol Regul Integr Comp Physiol,2009,296(5):R1518-1527.
[11] Fatouros I G,Jamurtas A Z,Nikolaidis M G,et al.Time of sampling is crucial for measurement of cell-free plasma DNA following acute aseptic inflammation induced by exercise[J]. Clin Biochem,2010,43(16-17):1368-1370.
[12] Beiter T,Fragasso A,Hudemann J,et al. Short-term treadmill running as a model for studying cell-free DNA kinetics in vivo[J]. Clin Chem,2011,57(4):633-636.

