大花蕙兰原球茎诱导与增殖研究*
龙雨跃,李国树、2* ,徐成东、2,赵仁升,李文荣
(1.楚雄师范学院化学与生命科学系,云南 楚雄 675000;2.滇中高原生物资源开发与利用研究所,云南 楚雄 675000)
大花蕙兰 (Cymbidium hybridum)是兰科兰属的多年生草本植物,其花葶长、花序大、花色丰富、花期长,花期多集中在春节前后[1],已经成为我国主要的年宵花之一。
大花蕙兰的繁育有种子繁殖、分株繁殖和组织培养三种。由于大花蕙兰多为杂交品种,种子繁殖无法保持其品种特性,结实率低,很难进行种子繁殖;大花蕙兰的分株能力弱、繁殖速度慢、系数低;因此多采用组织培养加快繁殖速度。而在大花蕙兰的组培快繁中最为关键的就是原球茎(Protocorm-Like body简称PLB)的诱导过程,大多数研究者主要是通过茎尖和侧芽来诱导大花蕙兰的原球茎[2—6]但其操作过程复杂、污染率高、褐化死亡严重。因此该研究采用大花蕙兰无菌苗茎段切块来诱导原球茎,并对原球茎增殖进行研究,为大花蕙兰无菌快繁提供参考依据。
1 材料与方法
1.1 材料
大花蕙兰无菌苗由楚雄师范学院化学与生命科学系植物组织培养室提供,供试品种为HERO。
1.2 原球茎诱导方法优化
1.2.1 原球茎诱导培养基的配制
以1/2MS为基本培养基,添加琼脂10g/L,蔗糖15g/L,活性炭1.5g/L(pH=5.8),通过调节不同浓度的6-BA和2,4-D来筛选诱导培养基。6-BA和2,4-D浓度配比见表1-1。

表1 —1 原球茎诱导培养基激素配比
1.2.2 外植体的选择与处理
取生长约7月、株高约7cm,生长健壮的大花蕙兰无菌苗,品种为HERO。在无菌条件下剪除根、叶、芽,只保留长约0.8cm的茎段,并将茎段切成长约0.4cm的小段后接种于各组培养基中。每瓶接种3段,每组接10瓶。培养观察,40天后对诱导情况进行统计分析。
1.2.3 诱导培养条件
接种后黑暗诱导30d后放于光照强度2500LX,光照时间12h/d;培养温度:27±2℃;相对湿度60%~80%的培养室中继续培养。
1.3 原球茎增殖培养基的优化
1.3.1 原球茎的处理
将桑椹状的原球茎随即切割成约8mm3的切块接种在不同的培养基上,每组10瓶,每瓶5-6块,每组重复3次试验。培养观察,40天后对增殖情况进行统计分析。
1.3.2 原球茎增殖培养基的配制
以1/2MS和MS两种培养基为基础,添加琼脂10g/L,蔗糖10g/L,活性炭1.5g/L,香蕉泥100g/L(PH=5.8),通过调节不同浓度6-BA和NAA来筛选增殖培养基。具体组合见表1-2。
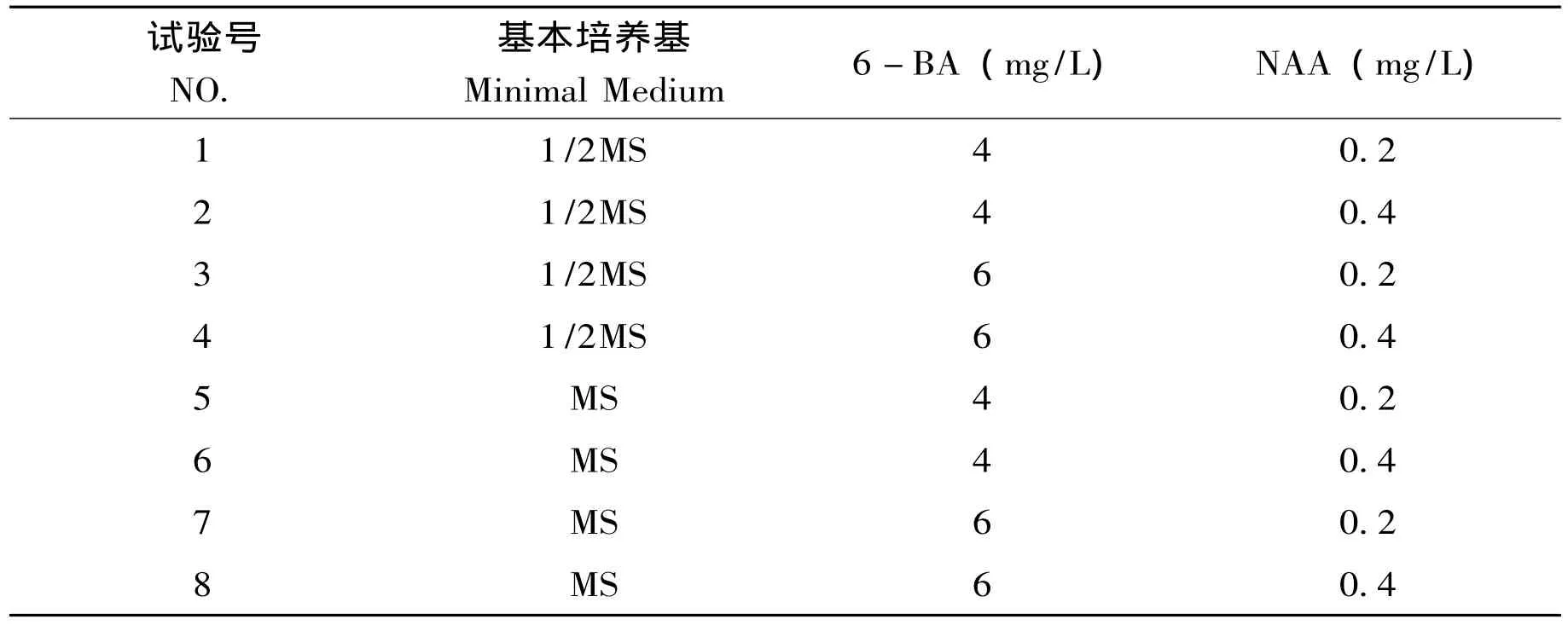
表1 —2 原球茎增殖培养基
1.3.3 原球茎增殖培养条件
接种后放于光照强度2500LX,光照时间12h/d;培养温度:27±2℃;相对湿度:60%~80%下继续培养。
1.4 原球茎增殖最佳切割方式研究
以增殖最优培养基为基本培养基。将原球茎采用随机切割、纵切,横切、碾压四种方法进行处理。每瓶5-6块,每组10瓶,每组重复3次试验。接种后放于光照强度2500LX,光照时间12h/d,温度27±2℃;相对湿度60% ~80%下继续培养。40天后对增殖情况进行统计分析。
1.5 数据计算方法[7,8]
PLB诱导率FOI(frequency ofinducement)=每组发生PLB的外植体数总数/每组接种外植体数总数×100%
原球茎增殖倍数 =每组新长出的原球茎总数/每组所消耗的原球茎总数
2 结果与分析
2.1 原球茎诱导优化结果
2.1.1 外植体伤口处是原球茎的形成和增殖的主要部位
外植体接种于诱导培养基上10d后在切口边缘开始长出直径约1mm乳白色的球状颗粒,有的形成单个球体,有的多个球体构成桑状体,即原球茎,用镊子轻轻拨动即可使其与茎段切块分离。15d后,外植体茎段的切口处就陆续长出原球茎,且每组均能长出原球茎,原球茎有单体原球茎和桑状原球茎两种。30d后将诱导出的原球茎放在照强度2500LX、光照时间12h/d,培养温度27±2℃,相对湿度60% ~80%的培养室中继续培养,原球茎陆续有白色转为浅绿。40d以后单体原球茎开始分化成苗,而桑状原球茎继续增殖略有分化。在进行原球茎增殖过程中发现:原球茎的形成主要是从外植体的伤口处开始生长,并实现增殖,因此,外植体伤口处是原球茎的形成和增殖的主要部位。其原球茎的形成和增殖过程见图2—1。

图2 —1 茎段外植体诱导出原球茎的过程图
2.1.2 不同激素组合对外植体茎段诱导原球茎的结果
外植体接种后放于暗培养箱进行培养诱导,10d后在切口边缘开始长出乳白色的球状颗粒,有的形成单个球体,有的多个球体构成桑状体,即原球茎;30d后将暗培养的材料放入光照强度2500LX、光照时间12h/d,培养温度27±2℃,相对湿度60% ~80%的培养室中继续培养。40d后对诱导情况进行统计,统计结果见下表:

表2 —1 不同激素组合对外植体茎段诱导原球茎的统计结果
从表2-1可知:反映了6-BA和2,4-D不同组合之间的平均诱导率。从原球茎平均诱导率来看第5组的诱导效果最好,诱导率高达77.78%(即:1/2MS+6-BA 8.0 mg/L+2,4-D 0.2 mg/L+蔗糖15g/L+活性炭1.5g/L);第2组的诱导效果最差,诱导率仅为11.11%。从诱导的原球茎生长状况上看:外植体诱导出原球茎的数量和质量与6-BA,2,4-D比值关系较大,6-BA和2,4-D比值越大,原球茎就趋向于浅绿色且原球茎小而多、成块状;6-BA和2,4-D比值越小,原球茎就趋向于浓绿色且原球茎大而少,分化生根。总体上看6-BA为8.0mg和2,4-D为0.2mg时的诱导效果最好,诱导率高达77.78%,且诱导出的原球茎为深绿色、小而多、质地疏松、诱导和生长最好。
2.2 原球茎增殖优化结果
将桑椹状的原球茎随即切割成绿豆大小的切块后接种于原球茎增殖培养基中培养,40天后统计、分析增殖结果。结果见表2—2。
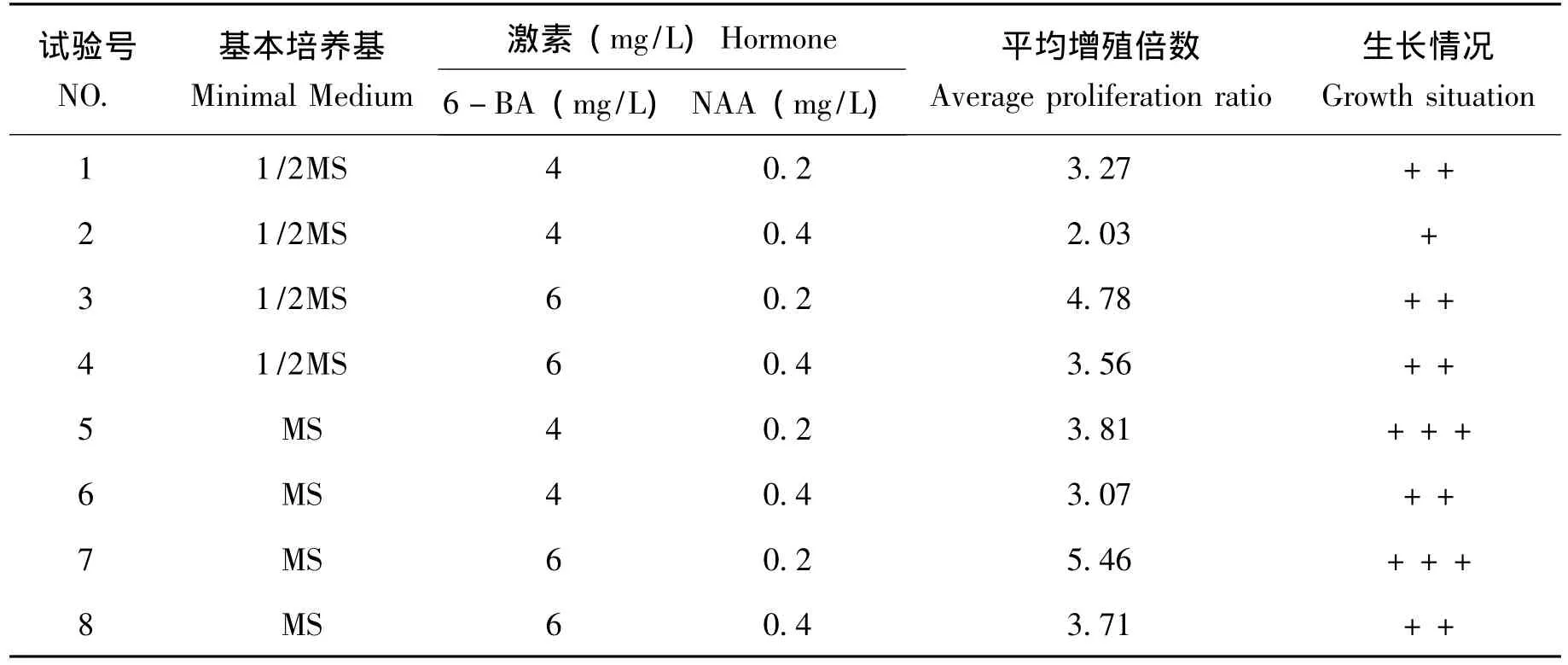
表2 —2 不同培养基和激素配比对原球茎增殖结果统计表
从表2-2可知:不同培养基及不同激素配比对原球茎的增殖影响不同,从平均增殖倍数上看,第2组的增殖倍数最低为2.03,第7组的增殖倍数最高为5.46,即在MS+BA(6.0mg/L)+NAA(0.2mg/L)增殖倍数最高。从原球茎的生长情况来看,生长最差的是第2组,生长最好的是第7组和第5组。从原球茎的增殖倍数和生长效果来说:MS+6-BA6.0mg/L+NAA0.2mg/L+琼脂10g/L+蔗糖10g/L+活性炭1.5g/L+香蕉泥100g/L(PH=5.8)培养基上原球茎增殖效果最佳,平均增殖倍数为5.46,增殖后生长情况最好。
3 讨论
大花蕙兰无菌茎段是诱导原球茎的较好材料,与常规的利用茎尖和侧芽诱导相比,它具有操作简单、褐变率低、诱导率高、增殖速度快等优点。本次试验以株高约7cm的生长健壮的无菌苗茎段进行原球茎诱导,结果发现:外植体伤口处是原球茎的形成和增殖的主要部位;在1/2MS+6-BA8.0mg/L+2,4-D0.2mg/L+蔗糖10g/L+活性炭1.5g的培养基上诱导原球茎效果最佳,诱导率高达77.78%,且诱导出的原球茎为深绿色、大小均匀、质地疏松,诱导和生长效果最好。
在一定范围内,6-BA,2,4-D比值影响着外植体诱导原球茎的诱导率、增殖倍数。在试验研究中,外植体诱导出原球茎的数量和质量与6-BA,2,4-D比值关系较大,6-BA和2,4-D比值越大,原球茎就趋向于浅绿色且原球茎小而多、成块状;6-BA和2,4-D比值越小,原球茎就趋向于浓绿色且原球茎大而少,分化生根。较高的6-BA有利于原球茎诱导,但是当6-BA高到10mg时,原球茎的诱导率开始下降;而较低2,4-D利于无菌苗茎段诱导原球茎。从总体上看:6-BA为8.0mg和2,4-D为0.2mg时的诱导效果最好,原球茎为深绿色、大小均匀、质地疏松、生长最好;但从增殖效果看:6-BA为6.0 mg时,增殖倍数为5.46倍,增殖效果最佳,原球茎生长最好。
[1]谢为龙,谭群英,王爱萍.影响大花蕙兰试管苗培育因素的研究 [J].四川农业大学学报,1994,12(02):231—234.
[2]吴开云,黄敏仁,王明庥.大花蕙兰幼苗叶片诱导类原球茎 [J].分子植物育种学,2007,5(03):341—346.
[3]杨玉珍,孙天洲,孙廷,等.大花蕙兰组织培养和快速繁殖技术研究 [J].北京林业大学学报,2002,24(02):86—88.
[4]常美花.大花蕙兰组织培养的研究进展及应用 [J].北方园艺,2011, (07):41—46.
[5]魏琴,曾顿洪,王丽,等.大花蕙兰原球茎一步成苗快速繁殖研究 [J].安徽农业科学,2007,35(35):11392—11393.
[6]马华升,王伟科,王佳,等.培养基、激素和添加物对大花蕙兰原球茎诱导增殖的影响 [J].浙江农业科学,2005,(06):452—456.
[7]胡恒康,高永根,张启香.大花蕙兰原球茎的诱导、增殖及其解剖结构研究 [J],金陵科技学院学报,2005,21(04):85—87.
[8]李杰,黄敏仁,王明庥,等.植物外源激素对大花蕙兰体胚发生影响的研究[J].北京林业大学学报,2005,27(04):65—68.

