黄粉虫抗菌肽在大肠杆菌中表达条件优化及活性分析
热依汗古丽·阿里木,毛新芳,刘忠渊
新疆大学生命科学与技术学院新疆生物资源基因工程重点实验室,新疆乌鲁木齐 830046
1972年瑞典科学家Boman HG 等[1]研究果蝇免疫时首次发现抗菌肽以后,1981年Steiner H等[2]从天蚕蛹的免疫血淋巴中诱导分离得到最早的抗菌肽——天蚕素(Cecropin)。随后人们从细菌、真菌、昆虫、植物和脊椎动物中发现并分离了具有抗菌活性的多肽,是生物体免疫防御系统的重要成分[3]。抗菌肽具有广谱杀菌特性以外,具有特殊的抗菌作用机制,不易导致耐药性,而且对有些真菌、病毒和多种癌细胞及肿瘤有良好的杀伤作用,因此抗菌肽作为一种新型抗菌制剂倍受关注,成为了生命科学领域的热点[4-5]。
但天然抗菌肽资源有限,提取工艺复杂,化学合成难以产业化,基因工程获得的抗菌肽容易被蛋白酶水解,分离和纯化成本高,因此需要寻找一种成本低、生产效率高、活性高的抗菌肽的方法。
抗菌肽基因工程表达系统主要为原核表达系统和真核表达系统两种,虽然真核表达系统具有比大肠杆菌更完备的基因表达调控机制及对表达产物的加工修饰和分泌能力,较客观地表达天然蛋白质的结构并维持其生物学活性等优点,但酵母生长存在速度慢、表达效率低、提纯工艺复杂和成本高的缺点。大肠杆菌表达系统具有生长周期短、表达量高、成本低等特点,是生产抗菌肽最为经济有效的方法。但抗菌肽分子量小且对宿主菌有毒性,一般采用融合表达策略。融合蛋白可以减少对宿主菌产生的杀伤作用,且可以提高抗菌肽表达水平,同时表达出来的抗菌肽带上融合蛋白中含有的特异性标签,便于融合蛋白的分离纯化[6]。本研究将实验室构建好的重组质粒pET-30a-tmAMP1m 诱导表达,探索在不同诱导条件黄粉虫融合蛋白HIS-TmAMP1m 的高效表达,分析诱导条件的改变对蛋白表达量的影响,并将表达产物进行纯化和生物活性检测,为进一步利用基因工程方法大规模生产高活性重组抗菌肽奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
重组质粒pET-30a-tmAMP1m 为本实验室构建并保存。金黄色葡萄球菌 Staphylococcus aureus、葡萄球菌Staphylococcus sp.、谷氨酸棒状杆菌Corynebacterium glutamicum、苏云金杆菌Bacillus thuringiensis、棒状杆菌Corynebacterium sp.为本实验室保存,使用LB 培养基。
1.1.2 主要试剂
质粒提取试剂盒、蛋白质Marker 购自天根生化科技有限公司;感受态细胞BL21购自北京全式金公司;Fermentas 预染蛋白Marker 购自Thermo Scientific 公司;ECL Western blotting 检测试剂盒购自GE Healthcare 公司;抗His 标签鼠单克隆抗体、Anti-mouse IgG-HRP 二抗购自康为世纪公司;His 标签纯化树脂(Ni-NTA Resin)购自QIAGEN 公司;BSA、DTT、Glycine 等购自Sigma 公司;IPTG、卡那霉素购自TaKaRa 公司;透析袋、超滤膜、超滤管等购自美国Millipore公司;Bradford 法蛋白定量试剂盒购自北京百泰克生物技术有限公司;其余常用试剂均为国产或进口分析纯。
1.2 HIS-TmAMP1m 的原核表达
将重组质粒pET-30a-tmAMP1m 转化大肠杆菌BL21感受态细胞,挑取单菌落接种到含Kana的LB 培养基中,37℃、200 r/min 过夜培养。次日按1%比例接种到LB 培养基(含Kana)中,37℃、220 r/min 振荡培养菌液至 OD600为0.4~0.6,加入IPTG 至终浓度为0.1 mmol/L,37℃诱导4 h,4℃、10000 r/min 离心5 min,收集菌体。冰浴进行超声波破碎细胞(振幅设为300 W;超声循环为:超声5 s,间隔5 s,时间设为10 s),4℃、12000 r/min 离心10 min,分别取上清和沉淀煮沸30 min,4℃、12000 r/min 离心30 min,进行Tricine-SDS-PAGE 电泳检测(上层胶为5%,下层胶为10%)。
1.3 HIS-TmAMP1m 表达条件的优化
黄粉虫抗菌肽表达条件的优化分别在不同的温度、IPTG 浓度和诱导时间对黄粉虫抗菌肽进行诱导表达。取样进行Tricine-SDS-PAGE 电泳,然后用Bandscan 软件分析目的蛋白的表达量。采用琼脂孔穴扩散法[7]观察不同培养条件下表达的黄粉虫抗菌肽所形成的抑菌圈大小,计算不同培养条件下发酵液的抑菌圈直径。其中表达量最高的、抑菌圈最大的那组所对应的条件即为最适培养条件。
1.4 HIS-TmAMP1m 的亲和纯化及Western blotting 检测
将融合蛋白按QIAGEN 公司的NTA-Ni 亲和层析柱说明书进行纯化,纯化的蛋白用磷酸盐缓冲液(pH 7.2)透析,并超滤浓缩,取样进行Tricine-SDS-PAGE 分析。Tricine-SDS-PAGE 电泳结束后电转移到硝酸纤维素膜上,用5%的脱脂奶粉封闭过夜。次日,先用抗His 标签鼠单克隆抗体孵育2 h,后用带有辣根过氧化物酶的Anti-mouse IgG-HRP 二抗孵育1.5 h,然后用ECL 法进行曝光和显影。
1.5 HIS-TmAMP1m 的活性检测
1.5.1 HIS-TmAMP1m 表达对宿主菌生长影响
将含有pET-30a-tmAMP1m 质粒的大肠杆菌BL21及BL21空白菌接种LB,37℃振荡培养3 h,加IPTG 诱导,每隔0.5 h 取菌液测其OD600值并记录数据,并设未诱导的含pET-30a-tmAMP1m质粒BL21转化菌为对照。
1.5.2 HIS-TmAMP1m 的最小抑菌浓度测定
测定融合蛋白HIS-TmAMP1m 对金黄色葡萄球菌 Staphylococcus aureus 、葡萄球菌Staphylococcus sp.、谷氨酸棒状杆菌Corynebacterium glutamicum 、苏云金杆菌Bacillus thuringiensis、棒状杆菌Corynebacterium sp.等5种菌的抑菌活性并计算其最小抑菌浓度(MIC)[8-9]。将固体培养基融化并冷却至不烫手时(约45℃左右),将6 mL 培养基与10μL 菌液(OD600=0.5)混合,迅速倒入培养皿(直径为9 cm)中,最终培养基厚度为1 mm。在凝固的培养基上打孔,直径为2 mm,分别往孔洞中加入2μL 梯度稀释后的融合蛋白(分别稀释0、2、4、8倍,Bradford 法测定蛋白浓度),置于37℃细菌培养箱培养12~16 h,测量其抑菌圈直径。将蛋白浓度(nmol)转换为对数形式,抑菌圈直径(cm)转换为平方形式,作图获得直线图,最后根据公式:CL=2.93/(a k10m/k)计算融合蛋白最小抑菌浓度(CL)(其中:a 表示培养基厚度(cm);k 表示直线图斜率;m 表示直线图截距),实验重复3次。
1.6 HIS-TmAMP1理化性质稳定性检测
1.6.1 HIS-TmAMP1m 的热稳定性
将浓度为0.076 g/L 融合蛋白HIS-TmAMP1m 于100℃煮沸10 min、30 min、1 h、3 h、5 h、7 h、9 h、10 h 后,分别取样,4℃、12000 r/min 离心20 min,收集上清,测定对金黄色葡萄球菌的抑菌活性,以未经热处理的样品为对照,同时设PBS 缓冲液为阴性对照,实验重复3次。
1.6.2 HIS-TmAMP1m 的反复冻溶稳定性
将浓度为0.076 g/L 融合蛋白HIS-TmAMP1m 置于−20℃冰箱分别反复冻溶1、2、4、6、8和10次后,4℃、12000 r/min离心20 min,收集上清液,进行抗菌活性检测。以未经过冻溶处理的样品作为对照,同时设PBS缓冲液为阴性对照,实验重复3次。
1.6.3 HIS-TmAMP1m 的酸碱稳定性
将浓度为0.076 g/L 融合蛋白HIS-TmAMP1m 与pH 值分别为4、5、6、7、8、9、10、11和12缓冲液(磷酸氢二钠-柠檬酸缓冲液、磷酸盐缓冲液、碳酸钠-碳酸氢钠缓冲液)混合,静置10 min 后,4℃、12000 r/min 离心20 min,收集上清,进行抗菌活性检测,以未经处理的样品作为对照,同时设pH 4~12缓冲液为阴性对照,实验重复3次。
1.6.4 HIS-TmAMP1m 对有机溶剂的稳定性
将浓度为0.076 g/L,1 mL 融合蛋白HIS-TmAMP1m 进行冷冻干燥处理后,分别加入等体积的10%的甲醇、乙醇、异丙醇、氯仿、正丁醇,混匀,室温放置24 h 后检测抑菌活性。以未加任何有机溶剂处理的样品作对照,每个处理设3次重复。
1.6.5 HIS-TmAMP1m 对蛋白酶的稳定性
在37℃水浴条件下,用反应浓度均为l g/L的蛋白酶K、胰蛋白酶分别处理浓度为0.076 g/L融合蛋白30 min,测定各种酶处理液的抑菌活性。以不加酶处理的融合蛋白为对照,同时设PBS 缓冲液为阴性对照,实验重复3次。
1.7 数据统计与分析
利用Microsoft Excel 2010和GraphPad Prism 5 Demo 软件进行相关统计学分析,所得数据用均数±标准差(x ±s)表示,组间比较采用t 检验,实验重复3次。
2 结果与分析
2.1 HIS-TmAMP1m 氨基酸序列分析
将黄粉虫cDNA 序列推断出来其氨基酸序列为:FPLRRAATAEEIEQGEHIRVKRVTCDILS VEAKGVKLNDAACAAHCLFRGRSGGYCNGK RVCVCR,利用Expasy 中的InterPro Scan 对氨基酸序列与PROSITE.Pfam、PRINTS 和其他家族、结构域数据库进行搜索比对,TmAMP1m 包含防御素(Defensin)、脊椎动物/真菌中的Defensin、节肢动物Defersin-2、Knottin、gammathionin 功能域,具有一定的保守性。说明黄粉虫融合蛋白HIS-TmAMP1m 可能含有较多的二硫键,属于防御素(Defensin)家族。
2.2 HIS-TmAMP1m 表达条件的优化
2.2.1 诱导温度对蛋白表达的影响
融合蛋白HIS-TmAMP1m 分别在20℃、25℃、28℃、30℃和37℃下诱导表达。从图1可以看出,不同的培养温度对融合蛋白表达量和活性有较大的影响,当培养温度为25℃时融合蛋白表达量最高,利用Bandscan 软件分析,HIS-TmAMP1m 融合蛋白的表达量占菌体总蛋白相对含量37.8%,但随着温度的降低重组抗菌肽抑菌活性逐渐减弱,温度过低(≤28℃)影响融合蛋白的抑菌活性,在37℃培养,重组抗菌肽抑菌活性最好(结果未列出)。
2.2.2 诱导剂浓度对蛋白表达的影响
实验采用不同浓度IPTG (0.05、0.1、0.5、0.8、1.2 mmol/L)进行诱导表达,从图2中可以看出,不同的IPTG 浓度对融合蛋白表达量影响不大,当IPTG 浓度为0.1 mmol/L 时融合蛋白表达量最高,利用Bandscan 软件分析,HIS-TmAMP1m 融合蛋白的表达量占菌体总蛋白相对含量36.5%,同时随着IPTG 浓度的增加重组抗菌肽抑菌活性也增加,但没有明显差异(结果未列出)。
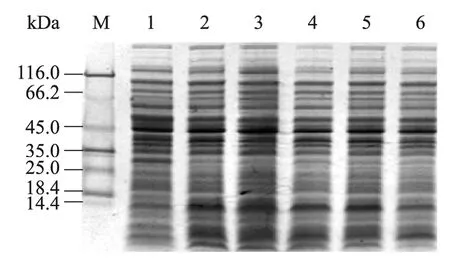
图1 诱导温度对HIS-TmAMP1m 表达的影响Fig.1 Influence of induction temperature on the expression of fusion protein HIS-TmAMP1m.M:protein molecular weight marker;1:cell extract of uninduced;2−6:crude cells extracts of E.coli induced,induction temperature 20°C,25°C,28°C,30°C,37°C,respectively.
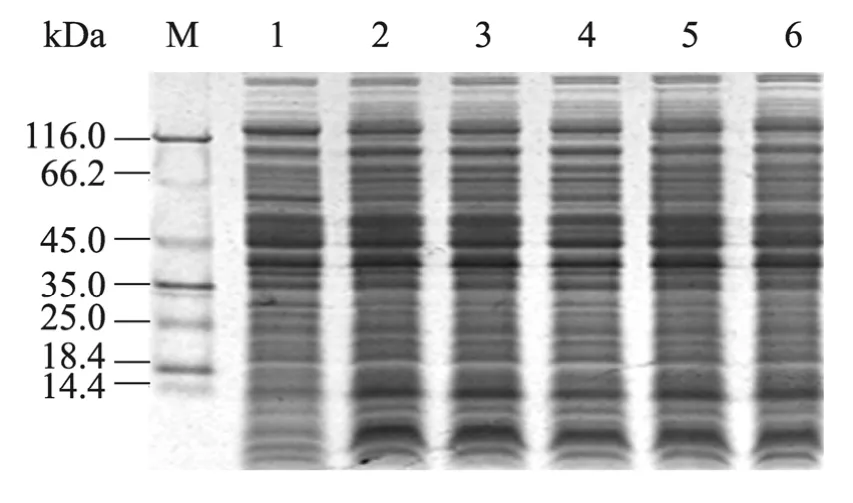
图2 IPTG 浓度对HIS-TmAMP1m 表达的影响Fig.2 Influence of inducer concentration on the expression of fusion protein HIS-TmAMP1m.M:protein molecular weight marker;1:cell extract of uninduced;2–6:crude cells extracts of E.coli induced,induction concentration 0.05 mmol/L,0.1 mmol/L,0.5 mmol/L,0.8 mmol/L,1.2 mmol/L,respectively.
2.2.3 诱导时间对蛋白表达的影响
融合蛋白HIS-TmAMP1m 诱导表达1 h、2 h、3 h、4 h、5 h、6 h、7 h 和8 h,从图3中可以看出,随着诱导时间的增加,融合蛋白表达量也逐步增加,之后蛋白表达量差异不明显,当诱导时间为4 h 时,融合蛋白表达量最高,利用Bandscan软件分析,HIS-TmAMP1m 融合蛋白的表达量占菌体总蛋白相对含量38.9%。同时,随着诱导时间的增加重组抗菌肽抑菌活性也增加,到第6 h开始融合蛋白抑菌活性逐渐降低(结果未列出)。当温度为37℃,IPTG 浓度为0.1 mmol/L,诱导时间为4 h 时融合蛋白HIS-TmAMP1m 表达量最高并抑菌活性最好。
2.3 HIS-TmAMP1m 的纯化及鉴定
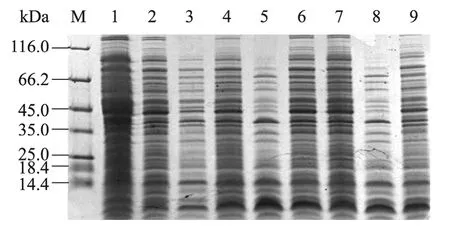
图3 诱导时间对HIS-TmAMP1m 表达的影响Fig.3 Influence of induction time on the expression of fusion protein HIS-TmAMP1m.M:protein molecular weight marker;1:cell extract of uninduced;2−9:crude cells extracts of E.coli induced,induction time 1 h,2 h,3 h,4 h,5 h,6 h,7 h,8 h,respectively.
将含有pET-30a-tmAMP1m 载体转化大肠杆菌BL21(DE3)感受态细胞,IPTG 诱导表达,裂解菌体提取总蛋白进行Tricine-SDS-PAGE 分析,结果显示,在相对分子量为14 kDa 处获得明显的表达蛋白条带,与预期大小相符(图4A,第2泳道)。经过超声破碎进行可溶性分析发现大部分融合蛋白存在于上清中(图4A,第3、4泳道)。
按照条件优化后,将可溶性形式表达的融合蛋白利用NTA-Ni 亲和层析柱进行纯化,获得较纯的HIS 融合蛋白(图4B,第2泳道)。利用HIS单克隆抗体Western blotting 检测获得了相应条带的融合蛋白(图4C,第1泳道),证实了诱导黄粉虫融合蛋白HIS-TmAMP1m 的正确表达。
2.4 HIS-TmAMP1m 表达对宿主菌生长影响
从图5可以看出加入IPTG 后BL21转化菌生长在一定程度上受到抑制,结果表明,融合蛋白HIS-TmAMP1m 的表达并末完全杀伤宿主本身,使宿主菌生长受到一定程度抑制。
2.5 HIS-TmAMP1m 的最小抑菌浓度检测
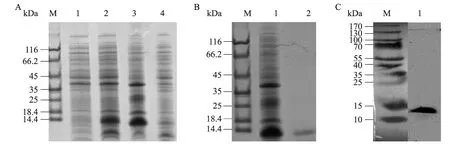
图4 融合蛋白HIS-TmAMP1m 的表达、纯化及鉴定Fig.4 Expression,purification and analysis of HIS-TmAMP1m fusion proteins.(A) Soluble expression of HIS-TmAMP1m proteins in E.coli BL21(DE3).M:protein molecular weight marker;1:cell extract of uninduced;2:cell extract of E.coli induced;3:supernatant of sonicated cells;4:pellet of sonicated cells.(B) Analysis of purified fusion protein HIS-TmAMP1m.M:protein molecular weight marker;1:soluble fraction of sonicated cells;2:purified fusion protein.(C) Western blotting analysis of HIS-TmAMP1m.M:protein molecular weight marker;1:fusion protein.
表1数据显示,黄粉虫抗菌肽 H I STmAMP1m 对金黄色葡萄球菌、葡萄球菌、谷氨酸棒状杆菌、苏云金杆菌、棒状杆菌等5种菌有不同程度的杀灭抑制作用,其中抗菌肽对谷氨酸棒状杆菌的抑菌作用最强,对金黄色葡萄球菌作用次之,对苏云金杆菌、葡萄球菌、棒状杆菌的抑菌作用稍弱一些,但还是有良好的抗菌效果。
2.6 HIS-TmAMP1理化性质稳定性检测
将浓度为0.076 g/L 融合蛋白HIS-TmAMP1m经100℃煮沸10 h后对金黄色葡萄球菌进行抗菌实验。结果显示(图6A 和6B),煮沸10 h 的抑菌圈与未煮沸的融合蛋白的抑菌圈大小不变,Tricine-SDS-PAGE 显示检测溶液中含有目的蛋白,表明融合蛋白具有很强的热稳定性。
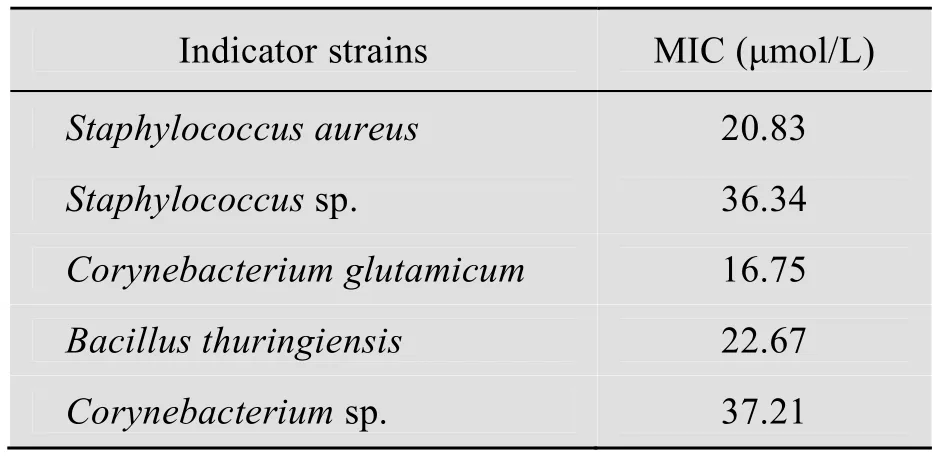
表1 融合蛋白 HIS-TmAMP1m 最小抑菌浓度(MIC)的测定Table 1 Minimum inhibitory concentrations of fusion protein HIS-TmAMP1m against five kinds of strains
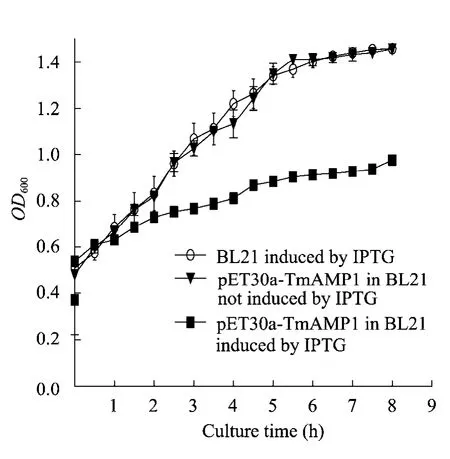
图5 IPTG 诱导后含有pET-30a-tmAMP1m 质粒的BL21生长曲线Fig.5 Growth curve of BL21 with pET-30a-tmAMP1m induced by IPTG.
浓度为0.076 g/L 融合蛋白HIS-TmAMP1m经反复冻融10次、与强酸强碱、不同有机溶剂和蛋白酶混合后,对金黄色葡萄球菌进行抗菌实验,仍然表现出良好的抑菌活性,而设立的对照组PBS 缓冲液,pH 4~12的缓冲液、5种有机溶剂和两种蛋白酶都未出现抑菌圈(照片未列出)。结果表明融合蛋白具有很强的反复冻融稳定性(图7A),酸碱稳定性(图7B),有机溶剂稳定性(图7C)和蛋白酶稳定性(图7D)。
3 讨论
抗生素的滥用所造成的细菌耐药性在临床抗感染治疗上产生了巨大的压力,迫切需要寻找一种全新抗菌制剂。抗菌肽凭借其分子量小、稳定性强、对革兰氏阳性菌和革兰氏阴性菌有光谱的杀菌活性等特性有望成为最有前景的抗菌候选药物[10-11]。抗菌肽还能选择性地杀死入侵的病原微生物,包括耐药性细菌,其抗菌作用独特。带正电荷的抗菌肽通过静电作用结合在靶细胞的细胞膜上并形成离子通道,破坏膜的完整性并产生穿孔现象,最后导致胞内物质泄露和细菌死亡而达到抑菌效果[12-13],因此细菌很难对抗菌肽产生抗性。董娜等[14]研究了人工合成的β-发卡抗菌肽对人红细胞的溶血作用,与蜂毒素相比β-发卡抗菌肽具有更高的细胞选择性毒性。虽然抗菌肽具有很大的研究开发潜力,但它的实际应用存在好多问题。首先是生物体内天然抗菌肽含量很低、化学合成过程繁琐、难以产业化、成本高;基因工程手段得到的抗菌肽分子量小并离子型强,因此容易被蛋白酶降解,而且抗菌肽本身的抗菌活性对宿主菌产生毒害作用[15]。此外,某些抗菌肽的生物学活性与传统抗生素相比不够理想,抗菌肽表达产物分离和纯化较困难。因此,如何提高抗菌肽的表达效率和抗菌活性,降低成本成为应用抗菌肽待解决的问题。

图6 HIS-TmAMP1m 热稳定性检测Fig.6 Thermal stability testing of fusion protein HIS-TmAMP1.(A) Antibacterial activity of fusion protein affected by boiling.1−9:fusion protein was boiled for different time 0 h,10 min,30 min,1 h,3 h,5 h,7 h,9 h,10 h respectively;c:PBS control.(B) Tricine-SDS-PAGE analysis of purified fusion protein affected by boiling.1−9:fusion protein was boiled for different time 0 h,10 min,30 min,1 h,3 h,5 h,7 h,9 h,10 h,respectively;M:protein molecular weight marker.
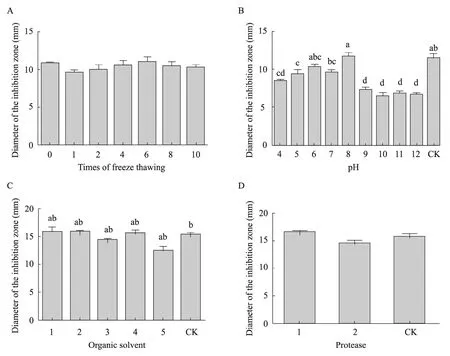
图7 融合蛋白HIS-TmAMP1其他稳定性检测Fig.7 Antibacterial activity of fusion protein HIS-TmAMP1m affected by different conditons.(A) Fusion protein affected by freeze thawing.(B) Fusion protein affected by different pH 4−12:fusion protein treated with buffer of pH 4 to 12;CK:untreated fusion protein.(C) Fusion protein treated with organic solvent.1−5:fusion protein treated with 10% ethanol,10% methanol,10% isopropanol,10% chlorofom,10% N-butanol respectively;CK:untreated fusion protein.(D) Fusion protein affected by protease.1:fusion protein treated with trypsin;2:fusion protein treated with Proteinase K;CK:untreated fusion protein.
利用大肠杆菌表达系统高效表达抗菌肽时,为获得表达量和活性高的抗菌肽,优化培养条件非常重要,如:诱导剂浓度、培养温度及诱导时间等。本研究通过改变影响外源目的基因的因素,如诱导温度、IPTG 浓度及诱导时间等,分析了HIS-TmAMP1m 融合蛋白诱导表达的最佳条件。研究表明,IPTG 浓度低和低温情况下可以提高可溶性蛋白的表达量[16]。本研究表明诱导温度为25℃时表达量最高,但活性低,培养温度为37℃时活性很好,温度过低会影响目的蛋白的抗菌活性;诱导剂IPTG 浓度对融合蛋白HIS-TmAMP1m 表达量及活性影响较少,低IPTG浓度下诱导目的蛋白经济有效,具备良好的工业生产前景;诱导表达4 h 融合蛋白表达量最高,诱导时间过短或过长都会影响蛋白表达量。综合表达条件优化的结果,确定融合蛋白HIS-TmAMP1m 在大肠杆菌中表达的最佳表达条件为37℃、加0.1 mmol/L IPTG 诱导表达4 h。
先前大量研究表明抗菌肽在大肠杆菌表达系统中直接表达会对宿主菌有抑制作用,会影响外源蛋白的表达量。一般采用以融合蛋白形式在大肠杆菌中表达抗菌肽,有助于保护重组蛋白免受胞外蛋白酶的降解,能够显著提高其稳定性和可溶性,减少对宿主菌的毒害作用,同时简化后续的分离纯化过程,降低生产成本[17]。周宇荀等[18]研究含抗菌肽Adenoregulin 基因的工程菌的生长曲线时,证实了融合蛋白的形式表达抗菌肽可以降低其对宿主菌的毒害作用,未明显增加宿主菌的代谢负担。毕重朋等[19]和冯志国等[20]采用融合表达策略,将抗菌肽基因构建到原核表达载体pET32a 上,成功表达具有抗菌活性的抗菌肽并利用其 His 标签进行纯化。本研究中Tricine-SDS-PAGE 显示融合蛋白大小约为14 kDa,以可溶性的形式表达,易操作。此外,我们利用融合蛋白中C-末端的6×His 标签进行亲和纯化,获得了较纯的目的蛋白,进行Western blotting 也出现分子量约14 kDa 的条带,进一步证实了诱导黄粉虫抗菌肽HIS-TmAMP1m 的正确表达。已有研究报道抗菌肽对大肠杆菌宿主菌有杀伤作用,如宋杰等[21]和王来城等[22]用大肠杆菌表达系统诱导表达抗菌肽,融合蛋白诱导表达后的细菌的生长受到明显抑制,而诱导后的空载质粒没有发生这种现象,表明抗菌肽对本身宿主菌产生“自杀现象”。但是,本研究结果表明黄粉虫抗菌肽HIS-TmAMP1m 对宿主菌毒害作用很少,加IPTG 诱导后含有抗菌肽基因的宿主菌的生长只是在一定程度上生长受到抑制并未完全杀伤宿主本身,还能稳定表达抗菌肽。
在工艺化生产过程中大量发酵抗菌肽时,要求抗菌肽不易失活,抗菌肽的稳定性很重要,因此,本研究对黄粉虫抗菌肽HIS-TmAMP1m 生物性质进行稳定性检测。将浓度为0.076 g/L 的融合蛋白经100℃煮沸10 h,在−20℃反复冻融10次,与强酸强碱缓冲液、不同的有机溶剂和蛋白酶混合后仍然有极强的抗菌活性,但是阴性对照组(分别为加强酸强碱缓冲液,有机溶剂,蛋白酶)没有出现抑菌活性。研究结果表明黄粉虫抗菌肽HIS-TmAMP1m 在高温、低温、酸碱、有机溶剂、蛋白酶环境中具有很强的稳定性。防御素是广泛存在于机体体内的的一类富含半胱氨酸的阳离子抗微生物肽,属内源性抗微生物肽家族,在机体免疫系统中起重要的作用[23]。本研究将蛋白TmAMP1m 氨基酸序列进行比对后发现,黄粉虫融合蛋白HIS-TmAMP1m 属于防御素家族(Defensin),含较多的二硫键,以稳定抗菌肽的结构[24],此结果与抗菌肽具有极强的稳定性是一致的。此外,本研究对5种细菌进行最小抑制浓度测定,研究结果表明黄粉虫抗菌肽HIS-TmAMP1m 对谷氨酸棒状杆菌的抑菌作用最强,对金黄色葡萄球菌作用次之,对苏云金杆菌、葡萄球菌、棒状杆菌的抑菌作用稍弱一些,但还是表现出良好的抗菌活性。
研究结果表明黄粉虫抗菌肽HIS-TmAMP1m 生物学性质稳定,对5种菌抑菌效果较好,利用融合蛋白的热稳定性,纯化之前将蛋白煮沸0.5 h,离心除去杂蛋白后上柱纯化,再用磷酸缓冲液透析并超滤浓缩得到较纯的目的蛋白,制备方法工艺简单,成本低,适合大规模生产,具有开发价值和市场应用前景,对抗菌肽进一步研究有重要的理论意义和实际应用价值,对于抗菌肽的结构、功能以及抗菌机理还有待深入研究。
[1]Boman HG,Nilsson I,Rasmuson B.Inducible antibacterial defence system in Drosophila.Nature,1972,237:232−235.
[2]Steiner H,Hultmark D,Engstrom A,et al.Sequence and specificity of two antibacterial proteins involved in insect immunity.Nature,1981,292:246−248.
[3]Guaní-Guerra E,Santos-Mendoza T,Lugo-Reyes SO,et al.Antimicrobial peptides:general overview and clinical implications in human health and disease.Clin Immunol,2010,135(1):1−11.
[4]Zasloff M.Antimicrobial peptides of multicellular organisms.Nature,2002,415:389−395.
[5]Hoskin DW,Ramamoorthy A.Sudies on anticancer activities of antimicrobial peptides.Biochim Biophys Acta,2008,1778:357−375.
[6]Zhang LF.Antimicrobial peptides prokaryotic expression strategy.Heilongjiang Sci Technol Infor,2010,6:1(in Chinese).张丽芳.抗菌肽原核表达策略.黑龙江科技信息,2010,6:1.
[7]Hultmark D,Steiner H,Rasmuson T,et al.Purification and properities of three inducible bactericidal proteins from hemo lymph of immunized pupae of Hyalophora cecropia.Eur J Biochem,1980,106:7−16.
[8]Hultmark D.Quantification of antimicrobial activity,using the inhibition-zone assay//Wiesner A,Dunphy GB,Marmaras VJ,et al,Eds.Techniques in Insect Immunology.Sweden:SOS Publications,Fair Haven Press,1998:103−107.
[9]Ekengren S,Hultmark D.Drosophila cecropin as an antifungal agent.Insect Biochem Molec,1999,29:965−972.
[10]Papagianni M.Ribosomally synthesized peptides with antimicrobial properties:biosynthesis,structure,function and applications.Biotechnol Adv,2003,21:465−499.
[11]Hancock RE.Cationic peptides:effectors in innate immunity and novel antimicrobials.Lancet Infect Dis,2001,1:156−164.
[12]Claire LT,Georgios M,Christopher JN,et al.Induction of cationic chicken liver-expressed antimicrobial peptide 2 in response to Salmonella enterica infection.Infect Immun,2004,72(12):6987−6993.
[13]Christtensen B,David M.Channel-formatting properties of cecropins and related model compounds incorporated into planar lipid membranes.Proc Natl Acad Sci USA,1988,85:5072−5076.
[14]Dong N,Ma QQ,Shan AS,et al.Design and biological activity of β-hairpin-like antimicrobial peptide.Chin J Biotech,2012,28(2):243−250(in Chinese).董娜,马清泉,单安山,等.β-发卡抗菌肽的全新设计及其生物学活性.生物工程学报,2012,28(2):243−250.
[15]Y Li.Recombinant production of antimicrobial peptides in Escherichia coli:a review.Protein Expres Purif,2011,80:260−267.
[16]Sørensen HP,Mortensen KK.Soluble expression of recombinant proteins in the cytoplasm of Escherichia coli.Microb Cell Fact,2005,4:1.
[17]Ma QS,Yu ZQ,Han B,et al.Research progress in fusion expression of antimicrobial peptides.Chin J Biotech,2011,27(10):1408−1416(in Chinese).马青山,余占桥,韩冰,等.抗菌肽融合表达研究进展.生物工程学报,2011,27(10):1408−1416.
[18]Zhou YX,Cao W,Wei DZ,et al.Optimization of cultural condition of genetic engineering strain for antibiotic peotide adenoregulin and research on its Fed-batch cultivation.Chin J Biotech,2005,21(4):615−621(in Chinese).周宇荀,曹巍,魏东芝,等.抗菌肽Adenoregulin基因工程菌培养条件的优化及分批发酵研究.生物工程学报,2005,21(4):615−621.
[19]Bi CP,Feng XJ,Shan AS,et al.Cloning and expression of a gene encoding shortened LfcinB(1-15)-Melittin(5-12) hybrid peptide in Escherichia coli BL21(DE3).Chin J Biotech,2009,25(7):975−981(in Chinese).毕重朋,冯兴军,单安山,等.牛乳铁蛋白素(1-15)-蜂毒素(5-12)杂合肽基因的合成及在大肠杆菌中的表达.生物工程学报,2009,25(7):975−981.
[20]Feng ZG,Lu J,Lang J,et al.Direct expression and purification of glycine-rich antibacterial peptide of Drosophila in Escherichia coli.Bullet Biotechnol,2009,3:88−90(in Chinese).冯志国,陆婕,郎君,等.富甘氨酸果蝇抗菌肽在大肠杆菌中的直接表达和纯化.生物技术通报,2009,3:88−90.
[21]Song J,Chen WC.Prokaryotic expression and antibacterial activity of Cecropin D from the common cutworm,Spodoptera litura.Acta Entomol Sin,2007,50(12):1207−1211(inChinese).宋杰,陈维春.斜纹夜蛾Cecropin D 成熟肽的原核表达及活性检测.昆虫学报,2007,50(12):1207−1211.
[22]Wang LC,Wang JX,Zhao XF,et al.Recombinant expression in E.coli,purification and polyclonal antibody preparation of a defensin from the huosefly.Acta Zool Sin,2005,51(2):327−334(in Chinese).王来城,王金星,赵小凡,等.家蝇防御素在大肠杆菌中的表达、纯化与抗体制备.动物学报,2005,51(2):327−334.
[23]Yu XB,Guo CL,Wu CL,et al.Advance in the research of defensins.Prog Vet Med,2006,27(8):47−51(in Chinese).余兴邦,郭锁链,乌翠兰,等.防御素研究进展.动物医学进展,2006,27(8):47−51.
[24]Zhang LT,Liu ZY,Zhang FC.Progresses of relationship between antimicrobial peptide structure and function as well as its molecular design.Biotechnol,2008,18(5):89−92(in Chinese).张兰廷,刘忠渊,张富春.抗菌肽结构与功能关系及分子改造研究进展.生物技术,2008,18(5):89−92.

