响应面法优化海洋微生物发酵产生纤溶化合物的培养条件
苏同伟,包斌,,严婷,张朝燕,3,卜永士,吴文惠,3
1 上海海洋大学食品学院,上海 201306
2 上海水产品加工与贮藏工程技术研究中心,上海 201306
3 上海海洋大学海洋科学研究院,上海 201306
海洋微生物因其种类多样性及所处的高压、低温、缺氧等独特的生态环境,常常能够产生优良生物活性且结构新颖的天然化合物[1],海洋微生物代谢产物已经成为创新药物发现的重要来源[2-3]。
海洋微生物长孢葡萄穗霉菌 FG216(Stachybotrys longispora FG216)是分离自东海海域的海洋真菌[4],其代谢产物 FGFC1(Fungi fibrinolytic compound 1)是具有溶血栓作用[5]的小分子生物活性化合物,FGFC1特异作用于纤溶酶原和单链尿激酶型纤溶酶原激活剂,可使生理的纤溶反应平稳进行,避免机体广泛出血风险及过敏反应,有可能成为安全而高效的溶血栓新药。
本实验通过Box-Behnken 模型[6-7]分析发酵温度、发酵时间、诱导物(鸟氨酸盐酸盐)添加量对FGFC1产量的影响,从而得出FG216发酵生产FGFC1的最佳培养条件。
1 材料与方法
1.1 菌株
长孢葡萄穗霉菌 FG216(Stachybotrys longispora FG216)为本实验室筛选获得。保藏号:CCTCC M 2012227,中国典型培养物保藏中心。
1.2 培养基
种子培养基:葡萄糖35 g,可溶性淀粉10 g,脱脂大豆粉20 g,细菌学蛋白胨5 g,牛肉膏蛋白胨5 g,酵母提取物3 g,氯化钠2 g,磷酸氢二钾0.5 g,硫酸镁0.05 g,加蒸馏水1000 mL,调pH至5.8,灭菌。
发酵培养基:蔗糖50 g,硝酸钠3 g,磷酸氢二钾0.1 g,硫酸镁0.5 g,氯化钾0.5 g ,酵母提取物1 g,氯化钴0.0025 g,硫酸亚铁0.015 g,氯化钙0.0065 g,鸟氨酸盐酸盐,加蒸馏水1000 mL,调pH 至5.8,灭菌。
1.3 FGFC1标准曲线及线性关系
精确称取FGFC1配制成甲醇标准液,并梯度稀释为1 mg/mL、0.5 mg/mL、0.1 mg/mL、0.05 mg/mL、0.01 mg/mL、0.005 mg/mL 的标准样品,用HPLC 进行检测,平行3次,以峰面积值为Y 轴,样品浓度为X 轴作图,得到FGFC1标准曲线方程为Y=9000000X,R2=0.9998。
1.4 单因素试验设计
1.4.1 诱导物添加量对FGFC1产量的影响
基础发酵培养基为除去诱导物的发酵培养基,分别添加0.5%、1%、1.5%、3%、5%的诱导物。取活化的种子液按1%接种到发酵培养基,考虑到海洋微生物大多为嗜冷微生物,其最适温度在20℃以下,因此设定培养温度为19℃,摇床转速为180 r/min,连续检测3~9 d 发酵液中的FGFC1产量,诱导剂添加量各水平组中FGFC1产量均在第8天达到最高,以该培养时间的FGFC1产量确定最优的诱导物添加量。
1.4.2 培养时间对FGFC1产量的影响
取活化的种子液按1%比例接种到最优诱导物添加量的发酵培养基中,因19℃时FGFC1产量较低,并初步探索FGFC1产量与培养温度之间的关系,尝试将培养温度升高为22℃,摇床转速为180 r/min,3~9 d 取发酵液进行FGFC1产量检测以确定最优发酵时间。
1.4.3 培养温度对FGFC1产量的影响
取活化的种子液按1%比例接种到最优诱导物添加量的发酵培养基,比较1.4.1与1.4.2试验中升高温度后FGFC1产量的变化趋势,将培养温度设定为19℃、22℃、25℃、28℃,摇床转速180 r/min,在最优的培养时间取发酵液对FGFC1产量检测以确定最优的培养温度。
1.5 响应面最优试验设计
根据单因素试验结果,通过Box-Behnken 模型以培养时间、诱导物添加量、培养温度为自变量,以FGFC1产量为响应值设计响应面试验拟合自变量与响应值之间的函数关系[8-9]。
2 结果与分析
2.1 单因素试验结果
单因素实验结果表明,最优的培养时间为8 d,最优的诱导物添加量为1.5%,最优的培养温度为25℃。但各个单因素最优条件简单的组合并不一定是发酵的最优条件[10-11],需要在单因素基础上进行响应面试验来确定最优的发酵培养条件。选择培养时间为7~9 d,诱导物添加量为0.5%~2.5%,培养温度为22℃~28℃作为响应面试验水平范围,FGFC1产量为响应值进行响应面试验。
2.2 三因素响应面试验分析
2.2.1 模型的建立及分析
以培养时间、诱导物添加量、培养温度为试验因素,FGFC1产出量为评价指标,按照二次项回归方程进行试验。试验设计及结果见表1。
针对表1应用Design-Expert V8.0.6软件进行多元回归拟合[12-13],可得培养时间(A)、诱导物添加量(B)、培养温度(C)与响应值FGFC1产量(Y)的关系,其方程式:Y=1251.96+71.17A−393.62B+472.83C−45.54AB+65.53AC−371.54BC−93.60A2−119.98B2−380.91C2。
根据响应面试验结果,回归模型的方差分析列入表2。
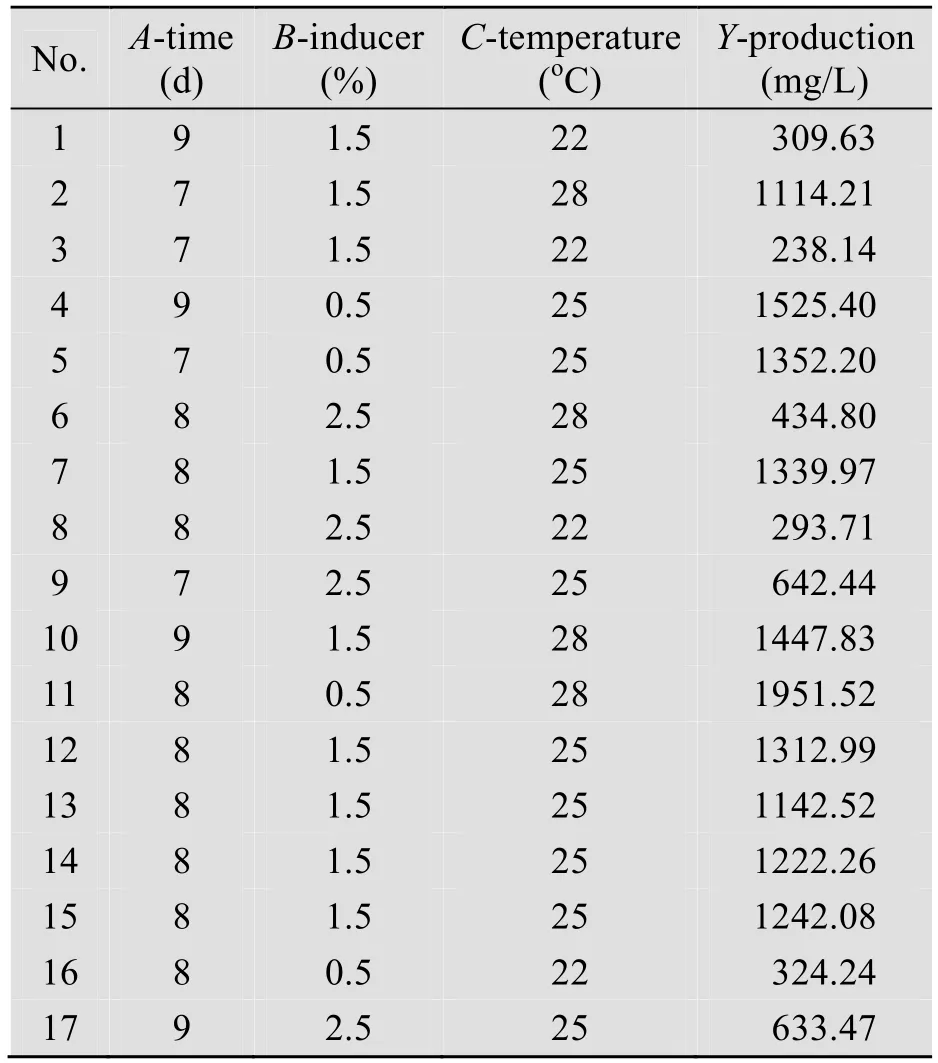
表1 培养时间、诱导物添加量、培养温度的响应面试验设计及各试验的FGFC1产出量Table 1 The design of response surface methodology concerning fermentation time,ornithine hydrochloride quantity and fermentation temperature and the volume of production of FGFC1 from every experiment
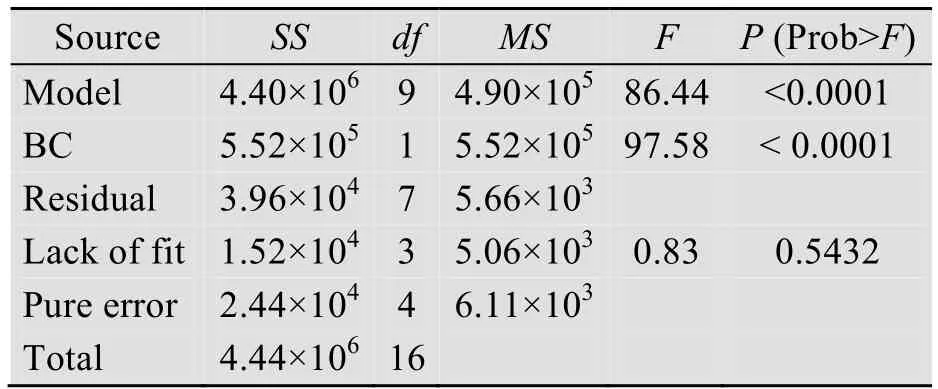
表2 回归模型方差分析Table 2 ANOVA of response surface model
根据表2可以看出,试验模型的P 值小于0.0001,模型极显著,失拟项P 值为0.5432,大于0.05,这表示试验数据与模型拟合良好。通过对P值检验可以看出,培养时间、诱导物添加量、培养温度以及它们的二次项对FGFC1产量的影响都是显著的,且诱导物与温度的交互作用对FGFC1产量的影响同样显著。同时,模型的复相关系数R2=0.9911,调整后R2=0.9796。从上述数据可以看出,此模型可以很好地反映FGFC1产量与培养时间、诱导物添加量、培养温度之间的关系,可以用来对FGFC1产量进行优化分析与预测。
2.2.2 培养条件优化及验证
在培养时间为8 d 时,诱导物添加量与培养温度对FGFC1产量的影响见图1。
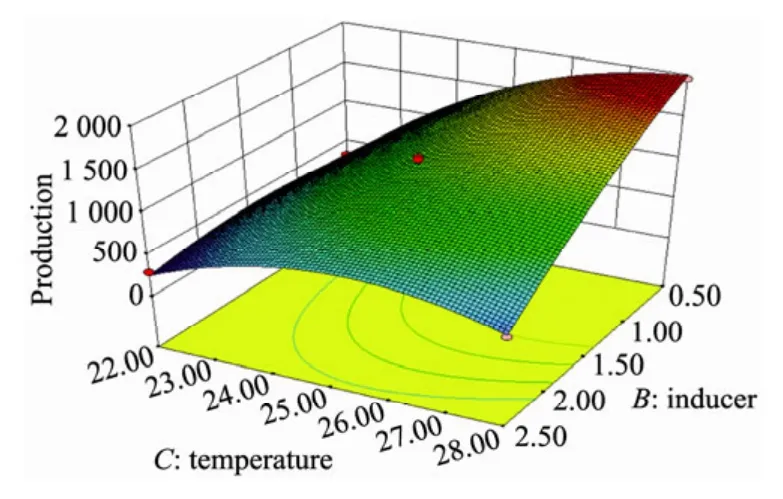
图1 诱导物添加量与培养温度对FGFC1产量的影响Fig.1 Effect of ornithine hydrochloride addition and culture temperature on FGFC1 production.
通过响应面结果分析,仅培养温度与诱导物添加量之间交互作用显著。培养温度接近28℃时FGFC1产量最大,当温度达到28℃时其产量有所下降。而诱导物添加量为0.5%时,FGFC1的产量最大,随后FGFC1的产量随着诱导物添加量的增加而减少。
利用Design-Expert V8.0.6软件对培养条件进行优化,得出最优培养条件为培养时间8.97 d,诱导物添加量0.5%,培养温度27.8℃,FGFC1产量理论值为2077.77 mg/L。根据实际情况将最优条件调整为培养时间9 d,诱导物添加量0.5%,培养温度28℃。通过多次验证实验得到FGFC1产量均值为1978.33 mg/L,相对偏差为4.8%,表明Box-Behnken 模型用于FG216发酵条件的优化是有效可靠的。
3 结论与讨论
本试验利用Box-Behnken 模型对FG216发酵产生FGFC1的培养条件进行优化,方差分析表明模型拟合度良好。最优的培养条件为培养时间9 d,诱导物添加量0.5%,培养温度28℃,通过培养条件优化,FGFC1产量由优化前的约700 mg/L 提高到1978.33 mg/L。结果表明,通过对培养时间、诱导物添加量和培养温度的响应面优化是成功有效的,为提高FGFC1的产量提供了技术支持,对保证后续的临床前试验需求及加快FGFC1作为新型溶栓药物出现具有重要意义。
长孢葡萄穗霉菌FG216是一种稀有真菌,自1975年被发现以来鲜有研究报道,其生物学特性尚未完全明确。相关研究[14-16]提示我们,可以从更多方面进一步提高FGFC1的产量。
[1]Molinski TF,Dalisay DS,Lievens SL,et al.Drug development from marine natural products.Nat Rev Drug Discov,2009,8(1):69−85.
[2]Wang X,Wu WH,Chen ZH,et al.Research progress on bioactive metabolites from marine microorganism and their structures.Chin J Nat Med,2010,8(4):309−320(in Chinese).王幸,吴文惠,陈志华,等.海洋微生物次生代谢产物的结构特征和生物活性的研究进展.中国天然药物,2010,8(4):309−320.
[3]Wang KM,Zhang YN,Zhang ZG,et al.Strategies for increacing the diversity of microbial secondary metabolites.Hubei Agri Sci,2010,49(12):3207−3210(in Chinese).王开梅,张亚妮,张志刚,等.提高微生物次生代谢产物多样性的策略.湖北农业科学,2010,49(12):3207−3210.
[4]Zhang Y,Wu WH,Zhou PG,et al.Screening and isolation of fibrinolytic active compound from marine microorganism.Chin J Mar Drugs,2008,27(6):39−43(in Chinese).张艳,吴文惠,周培根,等.海洋微生物来源纤溶活性化合物的筛选及其分离.中国海洋药物杂志,2008,27(6):39−43.
[5]Wang X,Wu WH,Sun LC,et al.Isolation of fibrinolytic active compound from marine fungi and initial identification of the strain.Nat Prod Res Dev,2012,24:57−61(in Chinese).王幸,吴文惠,孙立春,等.具有纤溶活性作用的海洋真菌代谢产物的分离与菌株鉴定.天然产物研究与开发,2012,24:57−64.
[6]Wang H,Zhang L,Li JL.Response surface optimization of tannase production by Aspergillus niger.J Cent South Univ Technol,2011,31(10):122−126(in Chinese).王挥,张蕾,黎继烈,等.响应面法优化黑曲霉发酵产单宁酶条件.中南林业科技大学学报,2011,31(10):122−126.
[7]Dong CH,Xie XQ,Wang XL,et al.Application of Box-Behnken design in optimisation for polysaccharides extraction from cultured mycelium of Cordyceps sinensis.Food Bioprod Process,2009,87(2):139−144.
[8]Zhang TR,Yu CQ.Optimization of mortierella isabellina culture conditions in fermentation of arachidonic acid by response surface methodology.Acad Period Farm Products Processing,2012(2):27−38(in Chinese).张天然,于长青.响应面法优化深黄被孢酶发酵生产花生四烯酸的培养条件.农产品加工学刊,2012(2):27−38.
[9]Niu GC,Yan BD,Zhu D,et al.Optimization of fermentation conditions for black currant fruit vinegar by response surface methodology.Food Sci,2012,33(1):157−160(in Chinese).牛广财,严宝冬,朱丹,等.响应面法优化黑加仑果醋的发酵条件.食品科学,2012,33(1):157−160.
[10]Tong ZY,Zhou LP,Chen XF.Enhance of Monacolin K production by response surface methodology of Monascus purpureus WX.J Zhejiang Univ Technol,2007,35(1):35−40(in Chinese).童振宇,周立平,陈旭峰.响应面法优化红曲霉菌株Monascus purpureus WX 液态发酵产Monacolin K 工艺条件.浙江工业大学学报,2007,35(1):35−40.
[11]Zhao C,Ye LJ.Optimization of fermentation medium for spinosad production through response surface methodology.Chin J Antibiot,2010,35(12):945−950(in Chinese).赵晨,叶丽娟.利用响应面方法优化多杀菌素发酵培养基.中国抗生素杂志,2010,35(12):945−950.
[12]Shen NK,Wang QY,Lu Y,et al.Enhancing ethanol production using thermophilic yeast by response surface methodology.Chin J Biotech,2010,26(1):42−47(in Chinese).申乃坤,王青艳,陆雁,等.响应面法优化耐高温酵母生产高浓度乙醇.生物工程学报,2010,26(1):42−47.
[13]Zuo AL,Zhang WG.Medium optimization of SHMT formation by response surface analysis.Biotechnology,2008,18(3):45−49(in Chinese).左爱连,张伟国.利用Design-Expert 软件优化丝氨酸羟甲基转移酶产酶培养基.生物技术,2008,18(3):45−49.
[14]Li XY,Liu ZQ,Chi ZM.Production of phytase by a marine yeast Kodamaea ohmeri BG3 in an oats medium:optimization by response surface methodology.Biores Technol,2008,99(14):6386−6390.
[15]Wang HM,Zu GR,Yin L,et al.Optimization of chitinase production conditons of a marine bacterium by response surface methodology.China Brewing,2012,31(2):103−106(in Chinese).王慧敏,祖国仁,尹璐,等.响应面法优化海洋细菌产几丁质酶培养条件.中国酿造,2012,31(2):103−106.
[16]Hong M,Diao QY,Yan GL,et al.Optimization of culture conditions for silage lactic acid bacteria via a response surface technique.Chin J Animal Nutrition,2010,22(5):1307−1313(in Chinese).洪梅,刁其玉,闫贵龙,等.响应面法优化青贮饲料乳酸菌的培养条件.动物营养学报,2010,22(5):1307−1313.

