Ⅱ型抗癌晶体蛋白抗肝癌作用的关键芳香族氨基酸
廖利民,林淑芳,田凌,陈爱明,林毅
华侨大学化工学院生物工程与技术系,福建厦门 361021
苏云金芽胞杆菌(Bacillus thuringiensis,简称Bt)是一种分布极其广泛的革兰氏阳性菌[1]。Bt 是目前研究最清楚、应用最广泛的微生物杀虫剂。自1901年发现Bt 到现在的100多年里,已经发现Bt 对鳞翅目、双翅目、鞘翅目、膜翅目、同翅目、直翅目、食毛目等的多种昆虫,以及线虫、螨类和原生动物等具有特异性毒杀活性[2-3]。因其具有广泛的杀虫活性,且对人畜安全、对环境无毒害,苏云金芽胞杆菌是目前世界上应用最广泛、产量最大的微生物杀虫剂。
Bt 在其形成芽胞的过程当中,会伴有蛋白晶体的形成,称伴胞晶体[4],伴胞晶体是毒杀昆虫的主要活性物质,并且是在Bt 芽胞形成期合成并累积而成。当Bt 芽胞成熟以后,细胞自溶,释放出芽胞和伴胞晶体,伴胞晶体在昆虫中肠内溶解被转化为δ-内毒素(也称晶体蛋白,Cry)。并与特异性受体高亲和性结合,快速而不可逆地插入细胞质膜,形成细胞穿孔,通过胶体渗透裂解将细胞膨胀并裂解,最后导致昆虫因败血症死亡[5-6]。
近年来研究人员通过深入研究发现自然界中分布更多的是没有杀虫活性的Bt 菌株[7]。因此,一些研究人员对伴胞晶体蛋白的非杀虫活性进行了研究,Yudina 等[8]发现有些Bt 菌株的伴胞晶体蛋白具有抗菌作用。1999年,日本学者Mizuki 等[9]首先发现没有杀虫活性的Bt 菌株A1190所含的81 kDa 伴胞晶体蛋白经蛋白酶处理激活后对体外培养的人白血病T 细胞MOLT-4以及人子宫颈癌细胞具有杀伤力而表现溶血作用。此类伴胞晶体蛋白,因其不会产生溶血作用但可优先杀死癌细胞,统称为Parasporin (简称PS)[10]。截止目前,已经分离、鉴定出了6种Parasporin 蛋白(Parasporin-1、Parasporin-2、Parasporin-3、 Parasporin-4、 Parasporin-5和Parasporin-6),分别从6种独立的 Bt 菌株(A1190、A1547、A1462、A1470、A1100和M019)分离纯化而来[11-13]。Kitada 等[14]对Parasporin-2抗人体肝癌细胞的机理进行了研究,发现Parasporin-2在作用于肿瘤细胞的时候,需要GPI锚定蛋白协助才能发挥其抗癌作用。Krishnan等[15]研究发现Parasoprin-2作用于肿瘤细胞时,肿瘤细胞质膜上的磷酸甘油酸脱氢酶(GAPDH)可能作为Parasporin-2的受体。Akiba 等[16]通过对Parasporin-2的结构研究发现,Parasporin-2的分子大小约为37 kDa,经蛋白激酶K 处理后具备有抗癌活性,此时Parasoprin-2分子从纵轴上可以分成3个结构域,且发现其第1个结构域上暴露出来的芳香族氨基酸残基很有可能是靶细胞质膜受体结合的位点,而这些受体可能是细胞质膜上面的膜蛋白糖链,也可能是细胞质膜上的脂筏所聚集的磷脂。为探讨Ⅱ型抗癌晶体蛋白的结构与其抗癌活性之间的内在联系,我们通过对Parasporin-2的人工诱变,产生不同的Parasporin-2的突变体,经表达分离纯化后测得其各自抗癌活性数据。本实验室之前通过突变体与其受体分子的对接研究,发现位于第49、51、52、55-60、194和205-212上的氨基酸残基特别是芳香族氨基酸在突变体和受体之间的相互作用中起着重要作用[17]。本研究在此基础上,通过人工模拟突变等方法进一步将Parasporin-2上与其抗肝癌活性密切相关的氨基酸定位于位点52、56、58和208上,从而为伴胞晶体蛋白抗肝癌活性的理性改造提供了理论支持。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
大肠杆菌JM110与大肠杆菌BL21(DE3)均由本实验室保存提供;含有Parasporin-2片段的XL10-gold-Parasporin-2的大肠杆菌由本实验室保存提供。大肠杆菌高效表达载体 pET-21b(Ampr)由本实验室保存提供。
1.1.2 细胞
本实验所用人肝癌细胞SMMC721、Bel7402以及人正常肝细胞Chang-liver 均由厦门华侨亚热带植物引种园保存提供。
1.1.3 培养基与抗生素
液体 LB 培养基、固体 LB 培养基;RPMI1640:10%小牛血清,PS 双抗100 U/mL,5% NaHCO3调节pH 至7.2;DMEM:10%小牛血清,PS 双抗100 U/mL,5% NaHCO3调节pH至7.2;抗生素:氨苄青霉素100 mg/mL。
1.1.4 酶与生化试剂
PCR 扩增剂购自广东东盛生物科技有限公司;限制性内切酶及DNA 连接酶购自Invitrogen、NEB 和TaKaRa 公司;PCR 产物回收试剂盒购自北京碧云天生物技术公司;Ni-Agarose His 标签蛋白纯化试剂盒购自北京康为生物技术公司;牛血清蛋白购自Roche 公司;RPMI1640与DEME购自GIBCO/BRL 公司;MTT 购自Promega 公司。
1.2 方法
1.2.1 引物设计与合成
根据pET-21b 质粒的限制性内切酶图谱和Parasporin-2基因序列,利用Primer5.0辅助设计引物,引物由厦门英骏生物技术公司合成:上游:5´-CGCGGATCC GATGGACGTTATTCG-3´(下划线部分为BamHⅠ位点);下游:5´-ACGCGTCG AC GGATTCCCCCATTTTG-3´(下划线部分为SalⅠ位点)。
1.2.2 PCR 模板制备与扩展
从37℃培养12~16 h 的平板上选取1个XL10-gold-Parasporin-2的单菌落,利用碱裂解法提取含有Parasporin-2基因的质粒XL10-gold,琼脂糖凝胶电泳检测。胶回收目标片段,以XL10-gold 为模板,PCR 大量扩增目标片段。
1.2.3 Ⅱ型抗癌晶体蛋白基因的突变
利用5-BU 诱导Parasporin-2基因的随机诱变PCR,PCR 体系与正常体系相比,添加了1%的5-BU,以XL10-gold 作为模板,进行第一轮扩增诱变。然后以第一轮扩增诱变产物的混合物稀释50倍作为模板,在含有5-BU 的PCR 体系中重复进行3次诱变。
1.2.4 重组质粒的构建、转化与测序
将利用5-BU 诱导的Parasporin-2基因的PCR 诱变得到的DNA 片段用内切酶BamHⅠ和SalⅠ进行双酶切,而后通过T4 DNA 连接酶在16℃、4 h 条件下将目标 DNA 连接到载体pET-21b 上,得到pET21b-P2M 融合重组表达载体。在适量的E.coli 感受态细胞中加入适量的连接产物,通过热击转化法将连接产物转导E.coli细胞内。长出单菌落后转接于含Amp 平板上,然后进行PCR 检测筛选阳性克隆;同时提取阳性转化子的质粒DNA,并通过酶切及PCR 鉴定阳性重组子。将含有阳性重组子质粒的E.coli JM110送至广州英潍捷基公司测序。
1.2.5 融合基因在E.coli BL21(DE3)中诱导表达
挑取新鲜的平板活化的阳性重组子接入5 mL 含有氨苄青霉素与氯霉素的LB 培养基中,同时加入终浓度为1%葡萄糖,37℃、230 r/min振荡培养至OD600为0.6~0.8,加入诱导物IPTG,20℃低温诱导8~12 h。12000 r/min、4℃离心2 min,收集菌体,超声破碎,12000 r/min、4℃离心20 min,分别收集上清与沉淀,进行SDS-PAGE 检测。
1.2.6 镍柱分离纯化蛋白
采用Ni-Agarose His 标签蛋白纯化试剂盒分离纯化Parasporin-2突变蛋白,实验操作按照试剂盒说明书进行。
1.2.7 Parasporin-2及其突变体的抗癌活性检测
采取MTT 法,收集对数期细胞,96孔板每孔加入100μL,铺板使待测细胞密度调至5000个/孔。5% CO2、37℃培养24 h 至细胞单层铺满孔底,加入浓度梯度的药物(0、6.25、12.5、25、50、75、100μg/mL),每孔100μL,设4个复孔,再培养24 h。培养后在每孔加入20μL MTT 溶液,继续培养4 h,之后弃去每孔内培养液,加入150μL DMSO,摇床低速振荡20 min。在酶联免疫检测仪在OD570处测量各孔吸光值。同时设置调零孔及对照孔。计算IC50值。
1.3 利用生物信息学分析突变体的氨基酸序列与其抗癌活性之间的关系
1.3.1 Ⅱ型抗癌晶体蛋白的同源建模
利用Discovery Studio 提供的一整套利用Homology Modeling 方法自动预测蛋白质的空间结构。DS 的 Homology Modeling 主要基于MODELER 程序。目前MODELER 已经成为学术上使用最为广泛、预测最为准确的同源建模工具之一。
1.3.2 Ⅱ型抗癌晶体蛋白突变氨基酸位点的多重响应分析
以P2M8氨基酸序列为模板,和其余的8个突变蛋白氨基酸序列进行比对,将有差异的氨基酸位点定义为一个变量,如果该氨基酸和P2M8对应的相同,那么这个变量的值就是1,否则变量的值为0。对Ⅱ型抗癌晶体蛋白突变氨基酸位点进行多重响应分析。多重相应参数设置表见表1(以检测出的抗肝癌活性大小由高到低排列)。
1.3.3 Ⅱ型抗癌晶体蛋白氨基酸能量贡献的因子分析
利用SPSS17.0软件,将ODA 预测出的不同氨基酸的数据进行Ⅱ型抗癌晶体蛋白突变氨基酸能量贡献因子分析。定义为数值变量,数值大小为ODA 值的绝对值。

表1 多重响应参数设置表Table 1 Variation setting of multiple responses
1.3.4 Ⅱ型抗癌晶体蛋白和磷酸甘油酸脱氢酶的ZDOCK 分子对接
利用ZDOCK 软件,对Ⅱ型抗癌晶体蛋白和磷酸甘油酸脱氢酶进行分子对接分析[17]。
1.3.5 Ⅱ型抗癌晶体模拟突变蛋白和磷酸甘油酸脱氢酶的分子对接
基本操作同前面的ZDOCK 分子对接,只是将参数“输入配体蛋白(Input Ligand Protein)”设定为“人工模拟突变蛋白:人工模拟突变蛋白”。
2 结果
2.1 Ⅱ型抗癌晶体蛋白基因的PCR 随机诱变
琼脂糖凝胶电泳结果表明得到一条约864 bp 的扩增带(图1),即为Parasporin-2诱变后活性区域基因片段,将其命名为P2M。经测序后得到9条Parasporin-2的突变基因,其各自的突变位点见表2。
2.2 pET21b-P2M 融合重组表达载体的构建
转化连接产物到大肠杆菌JM110感受态细胞中,过夜培养后挑取单克隆,培养提取质粒进行PCR 与酶切鉴定,结果表明Parasporin-2突变基因已正确克隆进了表达载体(图2)。
图1 Parasporin-2基因的PCR 诱变产物电泳分析Fig.1 Electrophoresis analysis of Parasporin-2 PCR mutant product.M:DNA marker;1:PCR mutant product of P2M amplified with PS2F and P2R primers.
2.3 突变蛋白的诱导表达及分离纯化
样品进行超声破碎后,取上清液进行SDS-PAGE 电泳检测(图3),结果表明,与未被诱导的对照菌相比,Parasporin-2突变基因能通过表达载体pET21b 在大肠杆菌BL21(DE3)中明显地表达37 kDa 左右相应的蛋白条带。因Parasporin-2突变基因表达的蛋白带有6个组氨酸标签,被镍柱纯化后进行SDS-PAGE 电泳检测(图4),结果得到与目标条带一致的37 kDa 左右的条带。
图2 重组表达载体pET21b-P2M 的电泳分析Fig.2 Electrophoresis analysis of recombinant plasmid pET21b-P2M.M:DNA marker;1:pET21b-P2M digested with BamHⅠand SalⅠ;2:PCR product of recombinant plasmid.

图3 pET21b-PS2A 诱导表达产物的电泳分析Fig.3 SDS-PAGE analysis of pET21b-PS2A expressed in E.coli BL21(DE3).M:protein marker;1:without IPTG induced protein of pET21b-P2M;2:IPTG induced protein of pET21b-P2M.
2.4 突变蛋白的抗癌活性检测
通过MTT法在体外检测Parasporin-2突变蛋白的细胞毒杀活性。结果表明不同的突变蛋白对人肝癌细胞的毒杀活性差异很大(表2),其中P2M1和P2M8对两种肝癌细胞均存在较强毒杀作用,而不影响正常的肝细胞(图5)。
2.5 P2M1、P2M8与P2Y 二级结构的比较
以Kabsch-Sander 分类方法进行分类所得到P2M1、P2M8、P2Y 的二级结构如图6所示。图中氨基酸序列从上到下依次是 P2Y、P2M1和P2M8,其中红色横条表示α螺旋,蓝色箭头表示β折叠,差异氨基酸残基用着色的方框显示。
从图中可以看出在某些位置存在着β折叠、β折叠变长或者是α螺旋的增加等这些二级构型的变化都会影响Ⅱ型抗癌晶体蛋白的理化性质,最终影响到Ⅱ型抗癌晶体蛋白的抗癌活性。

图4 镍柱分离纯化 pET21b-PS2A 表达产物的SDS-PAGE 分析Fig.4 SDS-PAGE analysis of pET21b-P2A purified by Ni-NTA-Agarose.
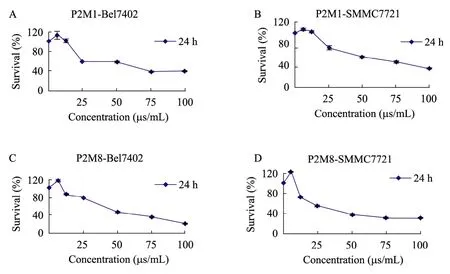
图5 P2M1和P2M8在体外对肝癌细胞增殖的作用Fig.5 Effect of P2M1 and P2M8 on the growth of liver cancer cells in vitro.(A,B) Bel7402 and SMMC7721 cells had been treated with different concentrations of P2M1 for 24 h.(C,D) Bel7402 and SMMC7721 cells had been treated with different concentrations of P2M8 for 24 h.The cell viability was determined by MTT assay.
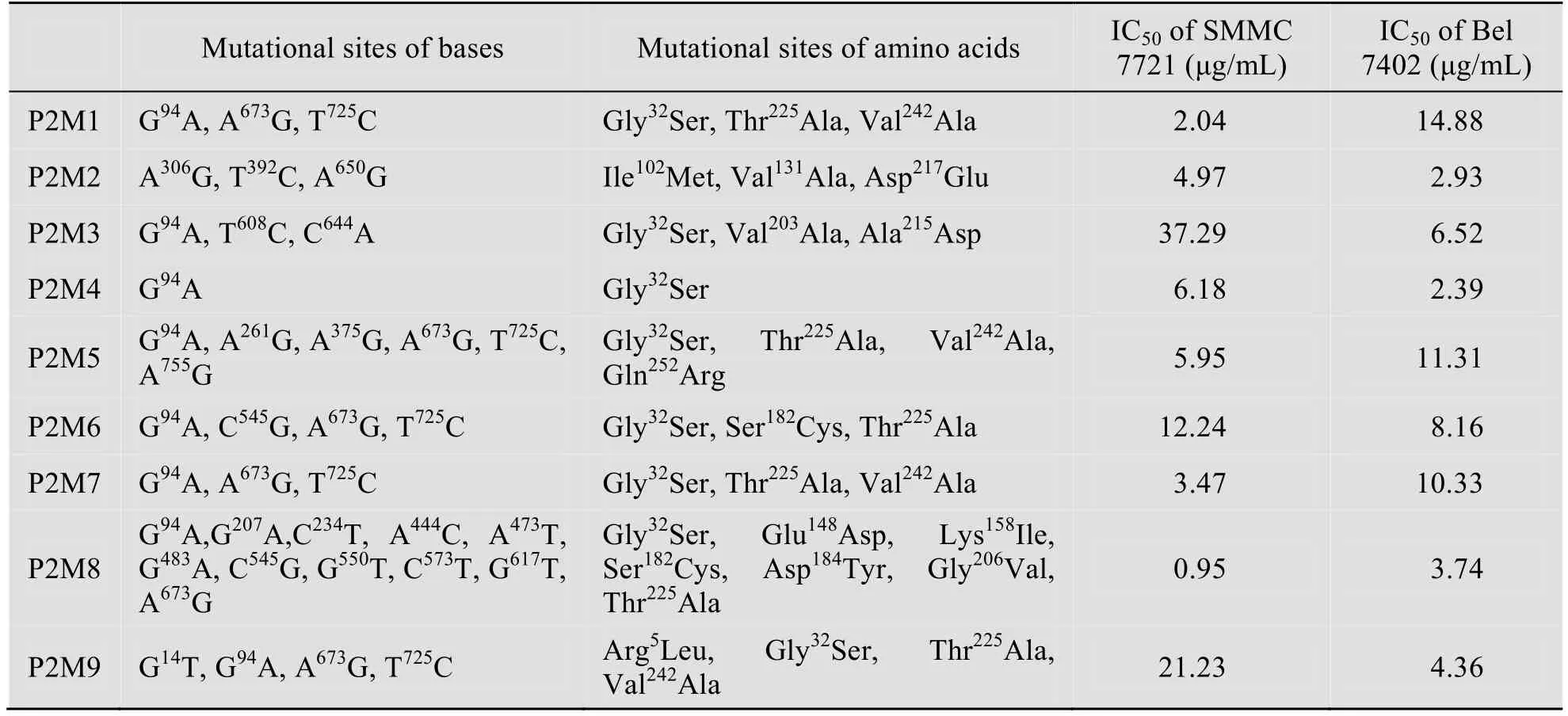
表2 突变蛋白的碱基、氨基酸突变位点及抗SMMC7721、Bel7402肿瘤细胞的IC50Table 2 Mutational sites of bases and amino acids of mutain and their IC50 of anti-SMMC7721 and anti-Bel7402
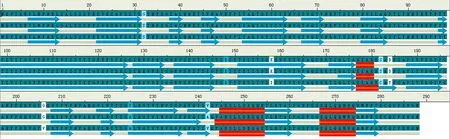
图6 P2M1、P2M8和P2Y 的二级结构图Fig.6 Secondary structure of P2M1,P2M8 and P2Y.
2.6 Ⅱ型抗癌晶体蛋白突变氨基酸位点的多重响应分析
表3给出了多重响应变量集位点中有效数据和缺失数据的基本统计情况,在9个例子中,没有缺失数据,数据的有效率是100%。
表4显示的是多重相应分析的频数表,其中N 表示的是对应位点与P2M8同一位点相比没有发生突变的个数,响应百分比表示对应位点未突变数占所有位点未突变数的百分比,个案百分比表示对应位点未突变数占对应位点个数的百分比;可以看出位点148、158、184和206对蛋白的活性有影响,同时参考变量值设置表,位点182、203和215对蛋白的活性也有影响。
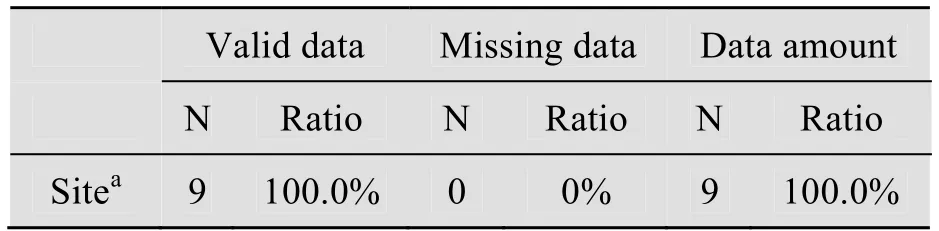
表3 多重响应变量频数分析个案摘要表Table 3 Case summary of multiple responses
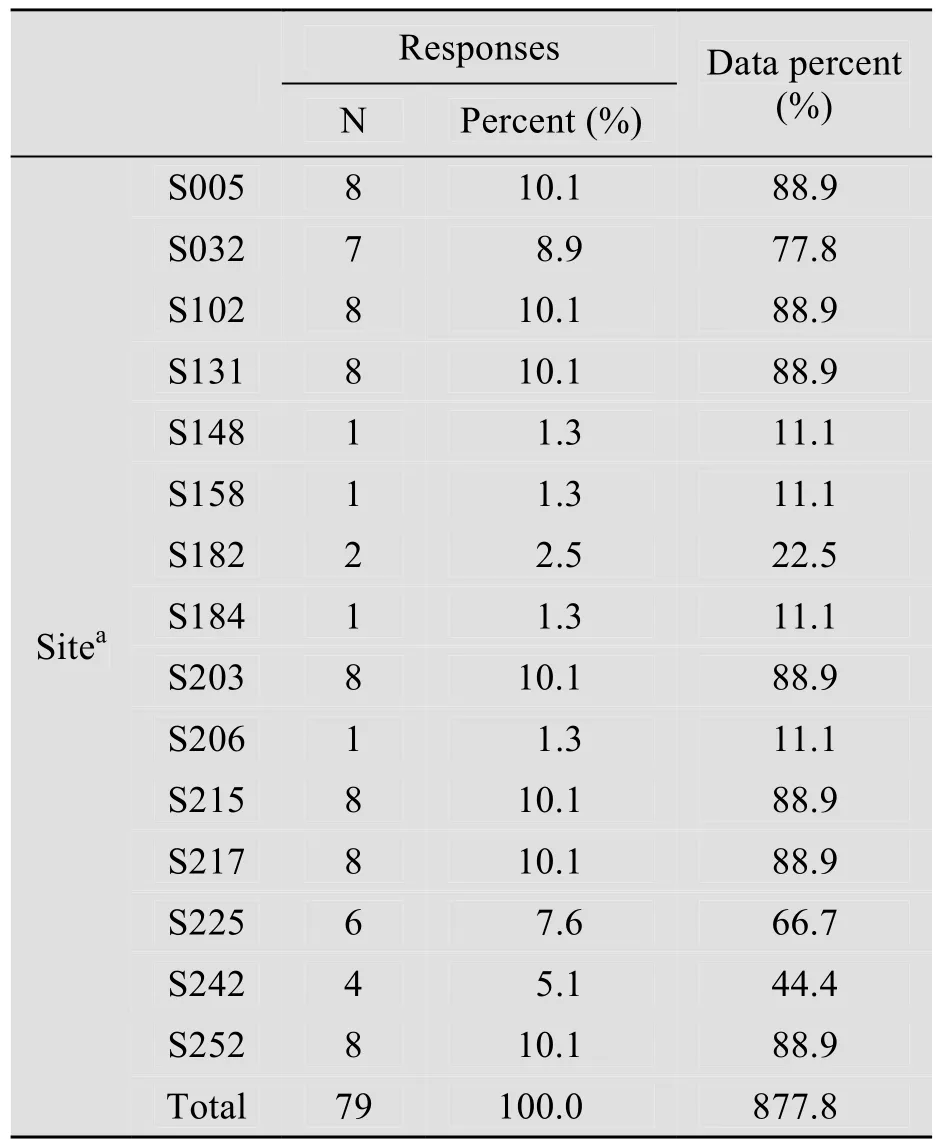
表4 多重响应变量分析频数表Table 4 Frequencies of multiple responses
2.7 Ⅱ型抗癌晶体蛋白突变氨基酸能量贡献因子分析
表5显示的是Kaiser-Meyer-Olkin (KMO)和Bartlett 的检验结果,其中KMO 值越接近于1越有适合进行因子分析,实验测得 KMO 值为0.216,表示比较适合做因子分析;Bartlett 球形度检验的原假设为相关系数矩阵为单位矩阵,Sig 值为0.000小于显著水平0.05,因此拒绝原假设,说明变量之间存在相关关系,适合进行因子分析。
表6显示的是每个变量的共同度的结果,可以看出因子分析的变量共同度都非常高,表明变量中的大部分信息均能够被因子所提取,说明因子分析的结果是有效的。

表5 KMO 和Bartlett 的检验表Table 5 KMO and Bartlett’s test
表7显示的是因子贡献结果,该表左侧部分为初始特征值,中间为取主因子结果,右侧为旋转后的主因子结果。“Total”是指因子的特征值,“Percent of variance”是指该因子的特征值占总特征值的百分比,“Cumulative percent”是指累积的百分比。从表中可以看出前3个因子的特征值大于1,并且前3个因子的特征值之和占总特征值的94.239%,因此提取这3个因子作为主因子。
图7是特征值的碎石图,通常碎石图显示的是大因子的陡峭斜率和剩余因子平缓的尾部,之间有明显的中断。一般选取主因子在非常陡峭的斜率上而处在平缓斜率上的因子对变异的解释非常小。从图中可以看出前3个因子都处在非常陡峭的斜率上,从第4个因子开始斜率变得越来越平缓,因此选择前3个因子作为主因子。
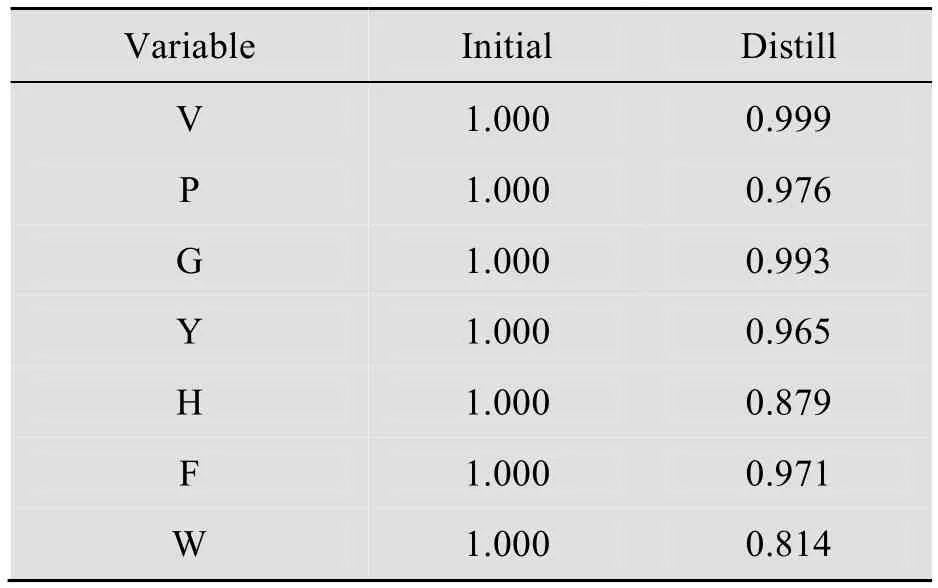
表6 变量共同度表Table 6 Communalities of variations
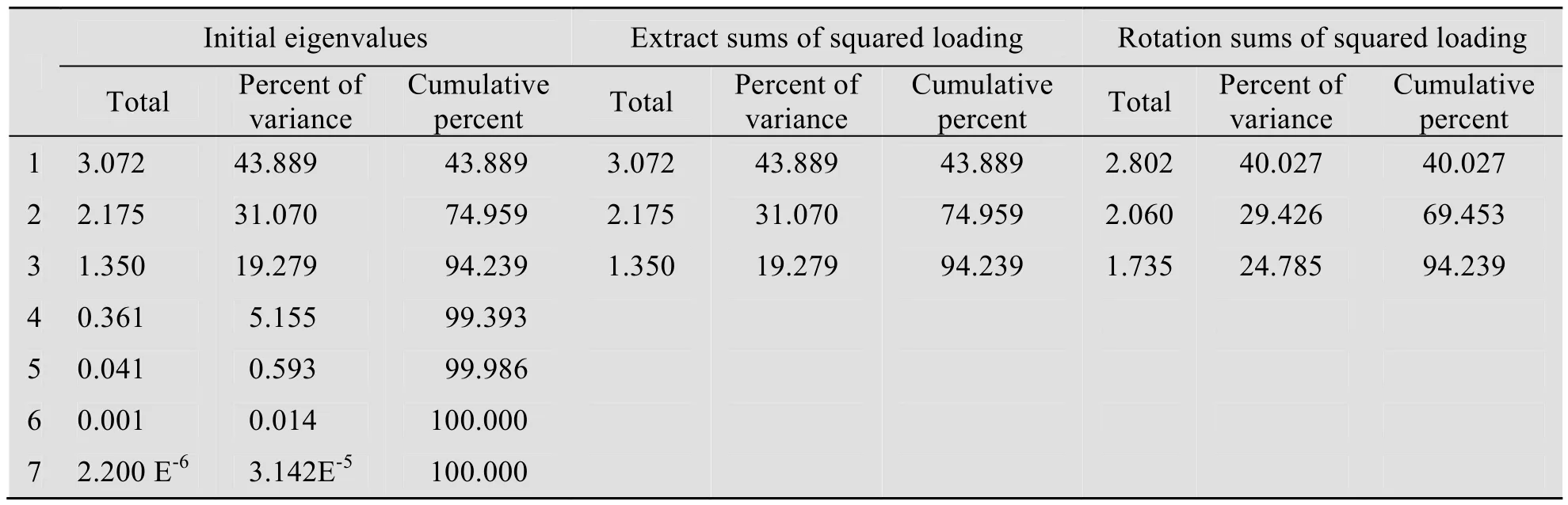
表7 解释的总方差表Table 7 Total variance explained
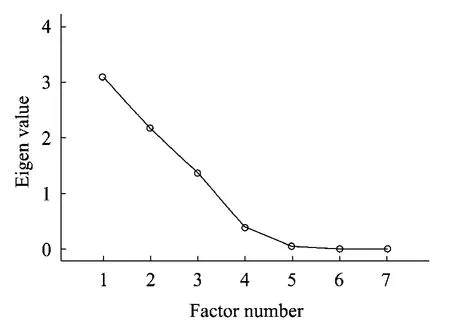
图7 碎石图Fig.7 Scree plot.
三个主因子包含的具体参数成分如表8所示,可以通过每个参数的系数值来判断分类参数的贡献。从表中可以看出,在第1个因子上,色氨酸(W)、组氨酸(H)和酪氨酸(Y)这3类氨基酸的载荷较大,这些氨基酸的支链含有苯环或杂环;在第2个因子上苯丙氨酸(F)、缬氨酸(V)和色氨酸(W)这3类氨基酸的载荷较大,这些氨基酸的支链含有苯环或甲基;在第3个因子上甘氨酸(G)和酪氨酸(Y)载荷较大,这些氨基酸要么没有支链要么支链含有苯环。可以看出这3个主因子中涉及到的氨基酸主要为芳香族氨基酸的色氨酸、苯丙氨酸和酪氨酸。这个结果和利用ODA 值的算数权重的结果一致,表明色氨酸、苯丙氨酸和酪氨酸在蛋白-蛋白识别过程中发挥了显著的作用,这些芳香族氨基酸可能对Parasporin-2的抗肝癌活性有重要的影响。

表8 成分得分系数表Table 8 Component score coefficient matrix
2.8 人工模拟Ⅱ型抗癌晶体蛋白突变的结果
通过ODA 预测蛋白-蛋白结合最佳识别位点、多重响应分析结果以及因子分析结果,发现芳香族氨基酸在蛋白相互识别过程中起着重要作用,同时通过突变体蛋白与Parasporin-2的受体蛋白进行分子对接,还确定在Parasporin-2突变蛋白P2M8上具有活性位点的具体位置分布在位点56、148、158、182、184、203、206和215附近[17]。为此我们进行了模拟突变实验来验证这些氨基酸位点及其对应的氨基酸。选择的活性位点附近(具体为53、56、58、208)用色氨酸(W)、苯丙氨酸(F)和酪氨酸(Y)替代原来的氨基酸进行模拟突变,得到的结果如图8所示。
1号是引入的非芳香族氨基酸,对接结果表明除了1号外其他的正向模拟突变都比P2M8的分数好,同时还进行了ODA 预测,除了1号外其余的模拟突变蛋白的某些氨基酸ODA 值均比对应位点的P2M8氨基酸ODA 值更低,表明在人工引入芳香族氨基酸后模拟突变蛋白更容易和受体蛋白结合。通过模拟突变实验可以看出Parasporin-2的第52、56、58和208位的氨基酸对其抗肝癌活性有很大的影响。
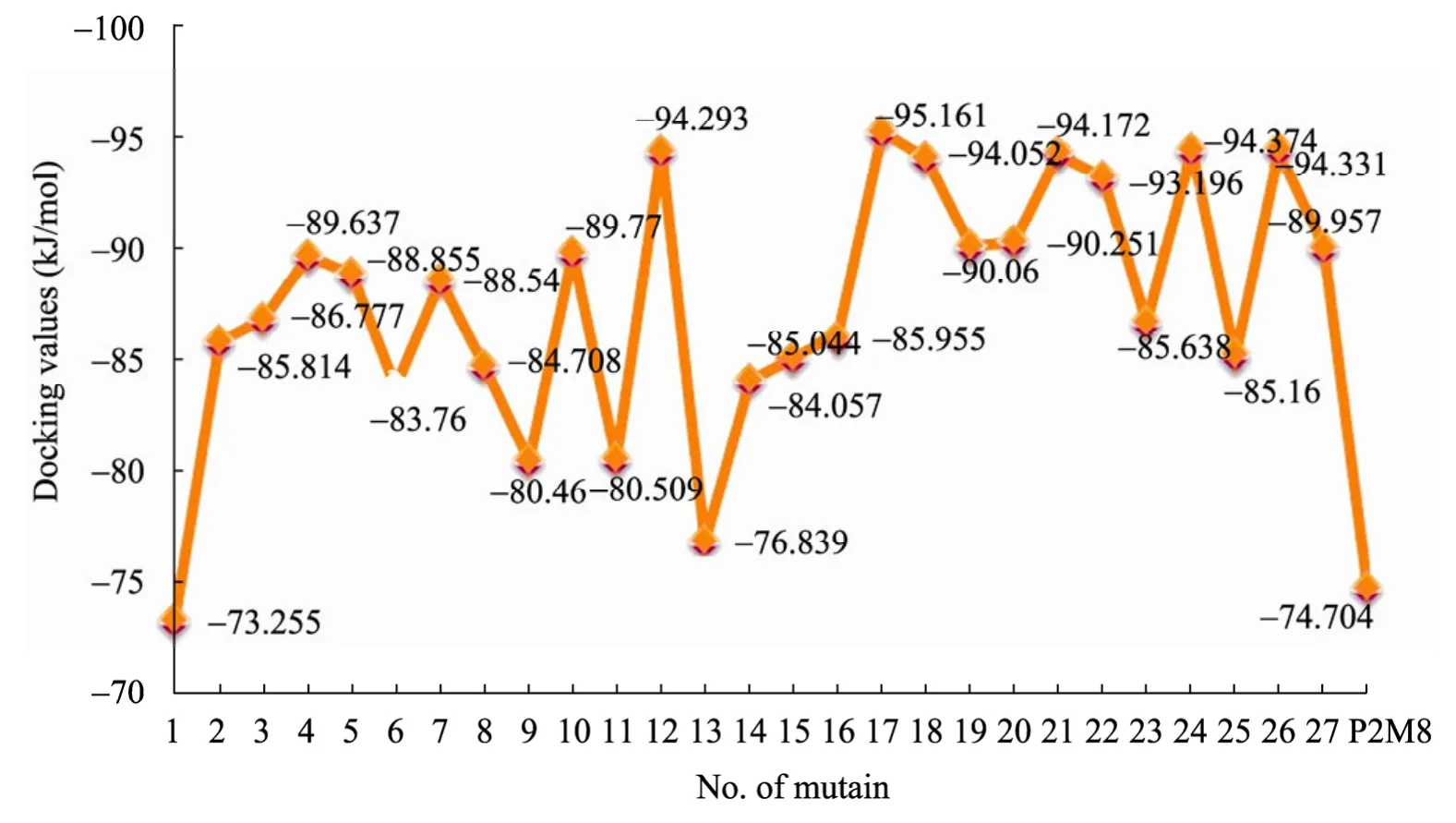
图8 模拟突变蛋白与受体的分子对接结果Fig.8 Docking results between virtual mutants and receptor.
3 讨论
本研究构建了9个Parasporin-2突变体,测定了其抗肝癌活性,并利用生物信息学软件进行了较为深入的分析,进而探讨了Parasporin-2上与抗肝癌作用相关的关键氨基酸。
多重响应分析结果表明Parasporin-2活性区的第148、158、182、184、203、206和215位氨基酸对其抗肝癌活性有影响,且这些氨基酸主要为色氨酸(W)、苯丙氨酸(F)和酪氨酸(Y)。ODA 预测结果表明位点49、51、52、55~60、194和205~212的氨基酸残基和含有苯环和/或者杂环的氨基酸对Parasporin-2与受体的结合中起到了很大的作用。人工模拟突变结果表明,在位点52、56、58和208位引入色氨酸(W)、苯丙氨酸(F)和酪氨酸(Y)对Parasporin-2的抗肝癌活性有正面的影响,上述位点及其附近很有可能是Parasporin-2的抗肝癌活性位点,而芳香族氨基酸色氨酸(W)、苯丙氨酸(F)和酪氨酸(Y)在Parasporin-2和受体的结合中起着重要作用。
本研究结果在一定程度上揭示了Parasporin-2一级结构与其抗肝癌活性之间的关系,为今后实施改造提供了依据。但这些信息对揭示Parasporin-2的结构与其抗肝癌活性之间的关系还远远不够。今后将测定若干个代表性突变体的晶体结构,深入探讨Parasporin-2空间结构上与其抗肝癌活性相关的特征,为将来实施Parasporin-2的全新设计提供指导。
[1]Buchanan RE,Gibbons NE.Bergey’s Manual of systematic Bacteriology.New York:Williams and Wilkin Press,1984.布坎南 RE,吉本斯 NE.伯杰氏细菌鉴定手册.中国科学院微生物研究所《伯杰氏细菌鉴定手册》翻译组,译.北京:科学出版社,1984.
[2]Schnepf E,Crickmore N,Van Rie J,et al.Bacillus thuringiensis and its pesticidal crystal protein.Microbiol Mol Biol Rev,1998,62(3):775−806.
[3]Crickmore N,Zeigler DR,Feitelson J,et al.Revision of the nomenclature for the Bacillus thurigiensis pesticidal crystal proteins.Microbiol Mol Biol Rev,1998,62(3):807−813.
[4]Ohba M,Mizuki E,Uemori A.Parasporin,a new anticancer protein group from Bacillus thuringiensis.Anticancer Res,2009,29:427−433.
[5]Bravo A,Soberón M,Gill SS.Bacillus thuringiensis mechanisms and use//Comprehensive Molecular Insect Science,Volume 6.Gilbert LI,Iatrou K,Gill SS,eds.New York:Elsevier,2005:175−206.
[6]Thomas WE,Ellar DJ.Mechanism of action of Bacillus thuringiensis var israelensis insecticidal δ-endotoxins.Febs Lett,1983,154(2):362−368.
[7]Roh JY,Park HW,Jin BR,et al.Charactererization of novel non-toxic Bacillus thuringiensis isoloates from Korea.Lett Appl Microbiol,1996,23(4):249−252.
[8]Yudina TG,Briukhanov AL,Netrusov AI.Susceptibility of archaea to the antibiotic effect of the parasporal inclusion proteins from different Bacillus thuringiensis subspecies.Mikrobiologiia,2004,73(1):25−30.
[9]Mizuki E,Park YS,Saitoh H,et al.Parasporin,a human leukemic cell-recognizing parasporal protein of Bacillus thuringiensis.J Appl Microbiol,1999,86:477−486.
[10]Akio I,Yasuyuki S,Sakae K,et al.A Bacillus thuringiensis crystal protein with selective cytocidal action to human cells.J Biol Chem,2004,279(20):21282−21286.
[11]Mizuki E,Ohba M,Akao T,et al.Unique activity associated with non-insecticidal Bacillus thuringiensis parasporal inclusions:in vitro cell-killing action on human cancer cells.J Appl Microbiol,1999,86:477−486.
[12]Kim HS,Yamashita S,Akao T,et al.In vitro cytotoxicity of non-Cyt inclusion proteins of a Bacillus thuringiensis isolate against human cells,including cancer cells.J Appl Microbiol,2000,89(1):16−23.
[13]Mizuki E,Park YS,Saitoh H,et al.Parasporin,a human leukemic cell-recognizing parasporal protein of Bacillus thuringiensis.Clin Diagn Lab Immunol,2000,7:625−634.
[14]Kitada S,Abe Y,Maeda T,et al.Parasporin-2 requires GPI-anchored proteins for the efficient cytocidal action to human hepatoma cells.Toxicol,2009,264(1/2):80−88.
[15]Krishnan K,Ker JE,Mohammed SM,et al.Identification of Glyceraldehyde-3-phosphate dehydrogenase (GAPDH) as a binding protein for a 68-kDa Bacillus thuringiensis parasporal protein cytotoxic against leukaemic cells.J Biomed Sci,2010,17(1):86.
[16]Akiba T,Abe Y,Kitada S,et al.Crystal structure of the parasporin-2 Bacillus thuringiensis toxin that recognizes cancer cells.J Mol Biol,2009,386(1):121−133.
[17]Chen AM,Lin Y.Relationship between aromatic amino acids of parasporin-2 and its anti-liver-cacner activity.J Huaqiao Univer,2012,33(4):408–411(in Chinese).陈爱明,林毅.Ⅱ型抗癌晶体蛋白的芳香族氨基酸及其与抗肝癌活性间的关系.华侨大学学报,2012,33(4):408–411.
[18]Nagamatsu Y,Okanura S,Saitou H,et al.Three cry toxins in two typs from Bacillus thuringiensis strainM019 preferentially kill human Hepatocyte cancer and Uterus cervix cells.Biosci Biotechnol Biochem,2010,74(3):494−498.
[19]Poornima K,Saranya V,Abirami P,et al.Phenotypic and genotypic characterization of B.t.LDC-391 strain that produce cytocidal proteins against human cancer cell.Bioinformatics,2012,8(10):461−465.

