自溶素(lytA)基因限制性片段长度多态性用于肺炎链球菌鉴定的实验研究
温玉兰陈 会邓林强胡锦辉张国强刘春风
(1 南昌市第三医院,江西 南昌 330000;2 江西省人民医院,江西 南昌 330000;3 南昌市第二医院,江西 南昌 330000)
自溶素(lytA)基因限制性片段长度多态性用于肺炎链球菌鉴定的实验研究
温玉兰1陈 会2邓林强2胡锦辉1张国强3刘春风1
(1 南昌市第三医院,江西 南昌 330000;2 江西省人民医院,江西 南昌 330000;3 南昌市第二医院,江西 南昌 330000)
目的 建立一种适用于临床的、操作简单的、高特异性的肺炎链球菌分子生物学鉴定技术。方法 选取临床分离的肺炎链球菌 102株及其他草绿色链球菌 51 株,分别采用 OPT 敏感试验、胆汁溶菌试验、商品化鉴定系统及自溶素基因片段长度多态性技术进行鉴定。结果 102 株肺炎链球菌中 101 株 OPT 抑菌环直径≥ 14mm,其中 17 株介于 14 ~ 19mm 之间,1 株为 OPT 耐药肺炎链球菌,抑菌环仅6mm;102 株胆汁溶菌试验结果均为阳性;自动化鉴定系统鉴定准确率为 93.1%。51 株草绿色链球菌中 19 株 OPT 出现抑菌环,其中 7 株抑菌环≥ 14mm;胆汁溶菌试验均为阴性。自溶素(lytA)基因限制性片段长度多态性对 102 株肺炎链球菌鉴定准确率为 100%,且能完全区分其它草绿色链球菌。结论 自溶素基因限制性片段长度多态性技术对肺炎链球菌鉴定具有很高的特异性和敏感性,临床可作为传统鉴定的方法学补充。
肺炎链球菌;自溶素;限制性片段长度多态性;鉴定
肺炎链球菌(streptococcus pneumoniae)是社区获得性肺炎的主要病原体,亦与菌血症、脑膜炎、中耳炎、鼻窦炎、角膜炎等相关,在世界上具有很高的发病率和病死率(尤其是老人和儿童)[1]。快速、准确的肺炎链球菌鉴定有助于于及时、有效的诊断治疗肺炎链球菌感染。本文采用PCR结合限制性内切酶酶切技术对肺炎链球菌及其他草绿色链球菌群的临床分离株进行研究,一方面试图建立一种适用于临床的、操作简单的、高特异性的肺炎链球菌分子生物学鉴定技术,弥补传统鉴定方法学及其他分子技术的不足,避免误诊误治及抗生素滥用;另一方面,也为进一步研究细菌感染性疾病的实验室分子诊断方法学打下基础。
1 材料与方法
1.1 实验菌株
①肺炎链球菌:共102株,其中100株为2009年1月至2010年12月间我院临床分离,分别编号sp1~sp102。②其他草绿色链球菌:共51株,包括49株草绿色链球菌和2株呈草绿色溶血的粪肠球菌,编号sv1~sv51。③菌株保存 所有实验菌株初次分离后,采用5%哥伦比亚羊血琼脂分纯,接种于专用菌种保存培养基(Microbank管),-70° C冻存备用。④质控菌株:ATCC49619肺炎链球菌。
1.2 OPT敏感实验
对所有实验菌株均进行OPT敏感试验,抑菌环直径>14mm为敏感。OPT纸片购自英国OXIOD公司。
1.3 胆汁溶菌实验
对所有实验菌株均采用试管法进行胆汁溶菌试验。分别取1mL 6麦氏单位菌液于2个试管中,于1管菌液中加0.1 mL10%胆盐溶液(去氧胆酸钠),另一管中加0.1 mL无菌生理盐水,混匀后,置35℃孵箱15 min取出,摇匀后观察结果。加盐水管菌液浊度不变(或基本不变),加胆盐溶液管菌液变澄清,判为胆汁溶解试验阳性。
1.4 自动化鉴定
采用美国BD公司phenix 100细菌全自动鉴定药敏系统对所有实验菌株进行鉴定,接种、孵育及结果判断均严格按试剂盒操作说明进行。
1.5 分子生物学鉴定
1.5.1 模板DNA提取(细菌染色体DNA)
商品化试剂盒购自X北京全式金生物技术有限公司,操作严格按照说明书进行。
1.5.2 引物设计
,选择一对引物[18],LA5-Ext:5'-AAGCTTTTTAGTCTG GGGTG-3';LA3-Ext:5'-AAGCTTTTTCAAGACCTAATAATATG-3',引物由北京全式金生物技术有限公司合成,每条引物合成后OD值均不<5.0。采用这对引物无论是对肺炎链球菌或其他Smit群模板DNA PCR扩增均可获取长1213bp的目的片段,且这一片段包含lytA基因(典型或不典型),见图1。
1.5.3 PCR扩增
总反应体系体积50μL,含0.5UTaq酶,250μM DdNTP,引物LA5-Ext及LA3-Ext各0.5μM,模板DNA0.5μg及标准缓冲液。预变性95°C 5mins,随后进行25个扩增循环,每个循环均为95°C变性30s-52°C退火30s-72°C延伸1min。取PCR扩增产物10μL,加3μL载样缓冲液混匀,2%琼脂糖凝胶电泳(90V,45mins),溴化乙锭染色,紫外灯下观察,结合DNA Marker判断目的片段。
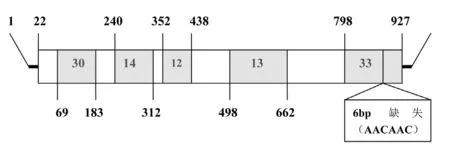
图1 lytA基因(典型和非典型序列):数字1指启动编码子ATG的第1位核苷酸;图下方条形框代表非典型lytA基因6bp缺失所在位置;上方条形框代表典型lytA基因和非典型lytA基因102不同位点所在位置(22~927);条形框内5个绿色区域及区域内数字分别代表不同位点集中区域及位点数
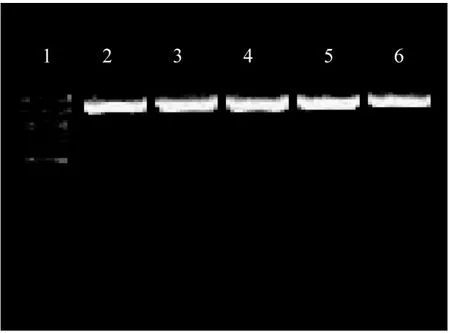
图2 1:DNA Marker;2:OPT敏感的缓症链球菌;3:口腔链球菌;4:肺炎链球菌ATCC 49619;5:OPT敏感株;6:OPT不敏感株
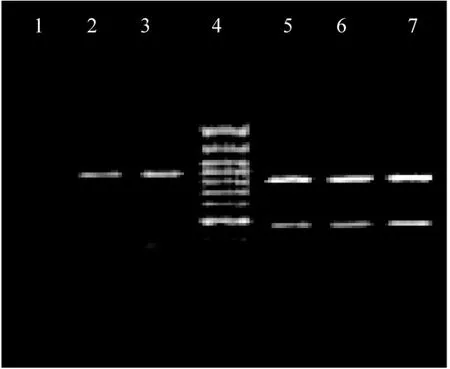
图3 1:粪肠球菌;2:口腔链球菌;3:OPT敏感的缓症链球菌;4:DNA Marker ;5:肺炎链球菌ATCC 49619;6:OPT敏感株;7:OPT不敏感株
图4 OPT耐药的肺炎链球菌
1.5.4 结果判断
出现1213bp条带为扩增阳性(该菌株包含lytA基因),不出现为扩增阴性(该菌株不含lytA基因)。见图2。
1.5.5 扩增阳性产物限制性内切酶分析
BsaAI酶及DNA Marker(分子量标准)均购自北京全式金生物技术有限公司。采用BsaAI 对PCR扩增产物进行消化,按试剂盒说明书进行。取酶切后产物10μL,2%琼脂糖凝胶电泳(90V,45mins),结合DNA Marker判断。若出现761bp、452bp两条带即为典型的肺炎链球菌lytA基因;若出现362bp、851bp两条带则为不典型lytA基因(图3所示)。
2 结 果
2.1 102株肺炎链球菌常规鉴定
2.1.1 102株肺炎链球菌OPT试验结果:肺炎链球菌sp1-sp101 OPT抑菌环均≥14mm,但其中有17株抑菌环介于14~19mm之间,sp102为OPT耐药肺炎链球菌,抑菌环仅6mm(图4)。
2.1.2 102株肺炎链球菌胆汁溶菌试验结果:102株肺炎链球菌胆汁溶菌试验均呈阳性。
2.1.3 102株肺炎链球菌自动化鉴定结果:102株肺炎链球菌,95株鉴定为肺炎链球菌,鉴定准确率为93.1%;3株鉴定错误,其中2株报告为缓症链球菌,1株为口腔链球菌;4株未能给出鉴定结果。
2.2 51株草绿色链球菌(含2株粪肠球菌)鉴定结果
2.2.1 51株草绿色链球菌OPT试验结果:51株草绿色链球菌有19株OPT出现抑菌环,其中7株抑菌环≥14mm。
2.2.2 51株草绿色链球菌胆汁溶菌试验结果:51株均呈现阴性。
2.2.3 51株草绿色链球菌自动化鉴定结果:51株菌中,缓症链球菌11株、口腔链球菌5株、血液链球菌8株、星座链球菌6株、唾液链球菌8株、咽峡炎链球菌4株、粪肠球菌2株、其它7株。
2.3 自溶素(lytA)基因限制性片段长度多态性鉴定
2.3.1 对102株肺炎链球菌临床分离株及肺炎链球菌ATCC49619,进行PCR扩增均可获取1213bp片段,进一步对所获片段进行BsaAI酶切,均可获取761bp、452bp目的片段(图3)。
2.3.2 对51株草绿色溶血链球菌进行上述相同PCR扩增,结果仅SMG群链球菌(缓症链球菌11株、口腔链球菌5株)出现1213bp目的片段,其余35株(包括2株粪肠球菌)均未能获取目的片段,对未能获取目的片段的菌株依据结果判断标准鉴定为非肺炎链球菌。对16株SMG群链球菌扩增所获片段进行BsaAI酶切,均获取362bp、851bp目的片段,依据结果判断标准,鉴定为非肺炎链球菌(图3)。
3 讨 论
目前临床实验室对肺炎链球菌鉴定主要依赖于其四个主要的表型特征[3]:血琼脂平板上菌落特点(脐窝状,草绿色溶血)、Optochin纸片敏感实验(OPT)、胆汁(去氧胆酸盐)溶菌实验(BS)、免疫学反应(型特异性抗血清反应、荚膜肿胀实验)及自动化鉴定系统。其中,前三种尤其是OPT实验为临床实验室鉴定肺炎链球菌常用手段。由于方法学局限及肺炎链球菌生物学变异,仅凭借上述方法可能使部分菌株的鉴定出现错误。
一些肺炎链球菌,如果培养时间不足或培养前抗生素的使用,则不具备典型的菌落形态,若分离有菌部位如呼吸道标本,很难与其它草绿色链球菌相区别;optochin试验,抑菌环直径≥14 mm 为敏感,肺炎链球菌的抑制环直径常在20mm以上。草绿色溶血性链球菌(约98%)<12mm。一般来说,通过optochin药敏试验,肺炎链球菌可得到准确鉴定。但optochin耐药的肺炎链球菌菌株已经出现[4],此外,optochin对草绿色溶血性链球菌部分菌种也呈现抑菌作用,抑菌环多在14~17mm,本研究中51株草绿色链球菌有16株OPT出现抑菌环,其中7株抑菌环≥14mm;胆汁溶菌试验,胆汁不溶的肺炎链球菌已有报道,一些肺炎链球菌菌落胆汁不溶甚至同时表现BS阴性和OPT耐药,而且即便是方法改进,BS实验的敏感性仅能达到98%[5];免疫学反应基于肺炎链球菌荚膜抗原与特异性抗血清之间的凝集反应,然而一些肺炎链球菌不存在荚膜,则可能导致假阴性,另外,抗血清可能与一些非肺炎链球菌的草绿色链球菌群存在交叉反应,从而导致假阳性结果[6];随着科技进步,细菌鉴定手段不断丰富,以生化表型为基础的自动、半自动鉴定系统已成为各级临床微生物学实验室常用手段。但是,由于方法学局限及一些技术原因,对于肺炎链球菌的鉴定,均未能达到满意效果,本研究中,102株肺炎链球菌,95株鉴定为肺炎链球菌,鉴定准确率为93.1%;3株鉴定错误,其中2株报告为缓症链球菌,1株为口腔链球菌;4株未能给出鉴定结果。
因此,上述问题的存在,一方面导致部分肺炎链球菌感染漏诊,耽误患者病情;另一方面,也可能将一些非肺炎链球菌的草绿色链球菌群错误地鉴定为肺炎链球菌,如此则可能误导临床用药,加重患者经济负担,同时导致出现不客观的相关流行病学统计资料[肺炎链球菌耐药率及PRSP(penicillin resistant streptococcus pneumonia,耐青霉素肺炎链球菌)的发生率]假性增高。因此,寻找一种快速准确的肺炎链球菌鉴定技术具有重要意义。
随着分子生物学技术尤其是聚合酶链式反应(polymerase chain reaction,PCR)技术的迅猛发展,肺炎链球菌遗传物质的特点逐渐被阐明,使得采用分子生物学手段对肺炎链球菌进行鉴定成为当前这一领域的研究热点。国内外研究者们采用多种分子手段进行了研究:①采用PCR手段扩增肺炎链球菌毒力因子自溶素(autolysin,lytA)、溶血素(pneomolysin,ply)和青霉素结合蛋白(penicillin binding protein,PBP)编码基因[7-9];②对肺炎链球菌16S rRNA 基因(16S rDNA )的特异性区域进行DNA探针杂交[10];③肺炎链球菌看家基因如xpt,recP,HexB,ddl以及锰依赖的超氧化物歧化酶基因(sodA)PCR扩增[11-14];④DNA-DNA reassociation,一种基于DNA杂交的鉴定技术,对于肺炎链球菌典型菌株,其DNA-DNA相似值超过70%,而其他Smit群如缓症链球菌、口腔链球菌与肺炎链球菌比较,基因组DNA-DNA之间相似值<60%[15]。这些分子技术用于肺炎链球菌鉴定都曾被认为是可靠的、充分的手段,但随着研究的深入,这些方法的局限性和不足亦越来越明确。首先,有报道[13,14]认为除肺炎链球菌外的其他Smit群成员也具有lytA基因或具有lytA基因相似的基因片段,因此,单纯依赖PCR扩增确定lytA基因存在与否鉴定肺炎链球菌会出现假阳性结果;其次,Kawamura等[15]和Whatmore 等[14]均报道一些缓症链球菌和口腔链球菌分离株基因组也包含ply基因,即便是检测到ply基因也无法准确区分肺炎链球菌和其他 Smit群成员;16S rRNA 基因序列用于肺炎链球菌鉴定也具有一定的局限性,Smit群内不同种之间具有遗传相似性,DNA-DNA同源性研究表明,Smit群内不同成员之间DNA相似性达40%~60%,且典型的缓症链球菌、口腔链球菌和肺炎链球菌菌株的16S rRNA基因之间的同源性高达99%以上,因此DNA探针杂交检测16S rRNA 基因也无法准确鉴定肺炎链球菌[10-14];此外,虽然DNA-DNAreassociation技术被认为是鉴定菌株至种的一种金标准,是区分Smit群内不同种的一种最为精准的手段,然而由于技术难度大,操作烦琐,不可能作为临床实验室的常用手段。
最近,Llull等[2]从EMBL数据库上公布的不同分离株的lytA基因序列数据中,选择一些完整或接近完整的序列(至少包含第22位核苷酸~第957位核苷酸[约占总基因长度95%])。共获取29株肺炎链球菌和22株其他Smit群细菌的lytA序列,并对其中19株肺炎链球菌和20株其他Smit群细菌的lytA序列进行详细的比较分析,得出如下结论:①证实了前人研究成果,即典型的lytA基因序列(肺炎链球菌)长度为957bp,而非典型的lytA基因序列(其他Smit群)长度为951bp,非典型lytA基因在第868位核苷酸~第873位核苷酸之间存在6bp的缺失(图1);②典型的lytA基因序列和非典型的lytA基因序列之间,共有102个位点(包括上述6bp 缺失)呈现不同,而且这些位点均集中在第22~927位核苷酸之间的5个不同区域内(图1)。进一步研究发现,典型的lytA基因序列中包含SnaBI酶切位点(酶切位置位于第561和562位核苷酸之间),而这一位点在非典型的lytA基因序列中并不存在(图1);相反,非典型lytA基因序列中包含XmnI酶切位点(酶切位置位于第290和291位核苷酸之间),而这一位点在典型的lytA基因序列中并不存在;此外由于SnaBI酶切位点(TAC↓GTA)同时也是BsaAI的酶切位点(PyAC↓GTPu),对非典型lytA基因序列分析发现,所有的序列均仅在160~165位核苷酸之间存在一个BsaAI的酶切位点。lytA基因序列(典型和非典型)限制性片段长度多态性特点的明确,使得采用PCR结合限制性酶切技术很容易将典型的lytA基因(肺炎链球菌)和非典型lytA基因(其他Smit群)区分开来。迄今为止,除Llull等外,国内外尚未见相关报道。
本研究利用这一研究成果,对分离自临床的102株肺炎链球菌及肺炎链球菌ATCC49619进行鉴定,所有菌株经过PCR扩增均能获取1213bp的DNA片段,选用BsaAI进行酶切,均能获取761bp、452bp两个DNA片段,依据结果判断标准,鉴定率为100%。对51株草绿色溶血性链球菌进行同样操作,其中35株(包括两株粪肠球菌)PCR未能获取目的片段,16株SMG群(11株缓症链球菌和5株口腔链球菌)PCR可获取1213bpDNA片段,但经过BsaAI进行酶切后获取的两个目的片段分别为362bp、851bp。依据结果判断标准,均为非肺炎链球菌。我们的研究结果进一步证实了Llull等的观点,并为将之广泛应用于临床打下了坚实的基础。
综上所述,自溶素基因限制性片段长度多态性技术对肺炎链球菌鉴定具有很高的特异性和敏感性,优于其他分子生物学鉴定技术。其操作相对简便,实验室技术及设备要求不高,临床可常规开展作为肺炎链球菌传统鉴定方法学的补充。
参考文献
[1]Advisory Committee on Immunization Practices.Prevention of pneumococcal disease: recommendations of the Advisory Committee on Immunization Practices (ACIP)[J].Morb Mortal Wkly Rep,1997,46(RR-08):1-24.
[2]Llull D,Lopez R,Garcia,et al.Characteristic signatures of the lytA gene provide a basis for rapid and reliable diagnosis of streptococcus pneumoniae infections [J].J Clin Microbiol,2006,44(4):1250-1256.
[3]Lund E,Henrichsen J..Laboratory diagnosis,serology and epidemiology of Streptococcus pneumoniae[J].Methods Microbiol, 1978,12(2):241-262.
[4]陈东科,程燕,张秀珍.对奥谱托欣耐药肺炎链球菌的鉴定[J].中华检验医学杂志,2005,28(11):1140-42.
[5]Burdash NM.,West ME.Identification of Streptococcus pneumoniae by the Phadebact coagglutination test[J].J Clin Microbiol, 1982,15(3):391-394.
[6]Chandler LJ.,Reisner BS,Woods GL,et al.Comparison of four methods for identifying Streptococcus pneumoniae[J].Diagn Microbiol Infect Dis,2000,37(2):285-287.
[7]Burdash NM,West ME.Identification of Streptococcus pneumoniae by the Phadebact coagglutination test[J].J Clin Microbiol,1982, 15(3):391-394.
[8]杨永权,朱保权,宁淑敏,等.肺炎链球菌自溶素和溶血素基因PCR法鉴定[J].微生物学免疫学进展,2002,28(2):49-53.
[9]Kawamura Y., Whiley RA, Shu SE,et al. Genetic approaches to the identification of the mitis group within the genus Streptococcus[J].Microbiology,1999,145(Pt 9):2605-2613.
[10]Martín-Galiano AJ., Balsalobre L, Fenoll A,et al.Genetic characterization of optochin-susceptible viridans group streptococci[J]. Antimicrob Agents Chemother,2003,47(10):3187-3194.
[11]Obregon V.,Garcia P, Garcia E,et al.Molecular peculiarities of the lytA gene isolated from clinical pneumococcal strains that arebile insoluble[J].J Clin Microbiol,2002,40(7):2545-2554.
[12]Poyart C.Quesne G, Coulon S,et al. Identification of streptococci to species level by sequencing the gene encoding the manganesedependent superoxide dismutase[J].J Clin Microbiol,1998,36(1): 41-47.
[13]Whatmore AM.,Efstratiou A,Pickerill AP,et al. Genetic relationships between clinical isolates of Streptococcus pneumoniae,Streptococcus oralis,and Streptococcus mitis: characterization of "atypical" pneumococci and organisms allied to S.mitis harboring S.pneumoniae virulence factor-encoding genes[J].Infect Immun,2000,68 (3):1374-1382.
[14]Goldenberger D, Künzll A, Vogt P,et al. Molecular diagnosis of bacterial endocarditis by broad-range PCR amplification and direct sequencing[J].J Clin Microbiol,1997,35(11):2733-2739.
R378.1+2
:B
:1671-8194(2013)04-0097-04

