原因不明不孕症患者种植窗期子宫内膜容受性变化及意义
罗 燕,吴荣珍
(江西省妇幼保健院,南昌330006)
原因不明不孕症(下称不孕症)是指夫妇双方通过标准而系统的不孕症检查未发现异常的不孕症,其在所有不孕症夫妇中的发生率为10% ~30%。不孕症患者的生育力处于正常生育功能的低限,或存在精子和卵母细胞功能异常(如受精、植入和早期胚胎发育异常)。体外受精—胚胎移植(IVF-ET)是目前治疗不孕症的最佳、最终选择,但其妊娠成功率仅12%~35%,且随年龄增长而逐渐降低。近年研究发现,子宫内膜局部调节因子失衡导致子宫内膜容受性(ER)缺陷,可能是不孕症的重要原因。为探讨不孕症患者种植窗期ER的变化及意义,我们进行了相关研究。现报告如下。
1 资料与方法
1.1 临床资料 选择2009年1月~2012年12月我院就诊的不孕症患者30例(观察组),年龄20~40岁,月经周期规律,基础内分泌正常,近3个月未用激素药物,输卵管通畅,腹腔镜检查证实无子宫内膜异位症和盆腔粘连,宫腔镜检查示宫腔正常;排除子宫畸形、有排卵、伴侣精液正常及不孕时间>2年者。另选同期因男方因素致不孕症的30例正常女性作为对照组,其年龄、不孕症时间与观察组有可比性。
1.2 方法
1.2.1 种植窗期子宫内膜活检 两组子宫内膜活检时间为黄体中期(月经周期第19~24天),排卵后5~7 d行子宫内膜取材,其标本分两份,一份经4%中性甲醛、室温下固定24 h,梯度乙醇逐级脱水,透明,石蜡包埋;另一份送病理科行常规石蜡包埋切片,HE染色,以确定子宫内膜病理分期,并排除子宫内膜病变。之后选择无病变组织进行切片,连续切3张、厚约4μm,进行SP免疫组化染色。
1.2.2 子宫内膜白血病抑制因子(LIF)、IL-11和信号转导与转录活化因子3磷酸化(pSTAT3)检测先将两组石蜡切片脱蜡、乙醇梯度脱水、3%H2O2阻断、枸橼酸盐缓冲液修复抗原;再滴加一抗4℃过夜,用PBS冲洗;然后滴加生物素化二抗,用DAB显色、苏木素复染、中性树胶封片。用PBS代替一抗作阴性对照,子宫内膜血管内皮组织为阳性对照。采用上海鲁汶生物公司产SP免疫组化试剂盒及北京中杉金桥生物公司产兔抗人LIF多克隆抗体、兔抗人IL-11多克隆抗体、小鼠抗pSTAT3单克隆抗体,检测子宫内膜中的LIF、IL-11和pSTAT3表达。
1.2.3 子宫内膜LIF、IL-11和pSTAT3免疫组化结果判定 将两组SP免疫组化染色切片置于Olympus显微镜(400×)下观察,在细胞密集区选择4个视野,每个视野计数100个细胞,分别对其中的阴性(-)、弱阳性(+)、阳性(++)和强阳性(+++)细胞数进行读片。阴性示细胞质/核内无棕色颗粒;弱阳性示细胞质/核内有较浅的棕色颗粒;阳性示细胞质/核内棕色颗粒清晰;强阳性示细胞质/核内有明显的棕色颗粒。染色切片由两人读片,结果由有经验的病理科医师进行审核,用H-score组织学积分法进行半定量分析。
1.2.4 统计学方法 采用SPSS11.0统计软件,计量资料以¯x±s表示,组间比较用独立样本t检验。子宫内膜LIF、IL-11、pSTAT3表达的相关性用双变量相关分析。P≤0.05为差异有统计学意义。
2 结果
2.1 两组子宫内膜中的LIF、IL-11和pSTAT3表达观察组及对照组子宫内膜中LIF均呈阳性表达,其表达均定位于细胞质并呈顶浆分泌状,腺腔内可见棕黄色物质,基质中表达较弱。观察组LIF表达低于对照组(P<0.05)。IL-11表达主要在子宫内膜腺上皮细胞,基质中的表达较弱,观察组与对照组比较有统计学差异(P<0.05)。观察组子宫内膜腺上皮细胞和基质中的pSTAT3从无表达到中度表达,对照组在子宫内膜腺上皮的表达强于观察组(P<0.05);两组基质中的表达比较无统计学差异(P >0.05)。见表1。
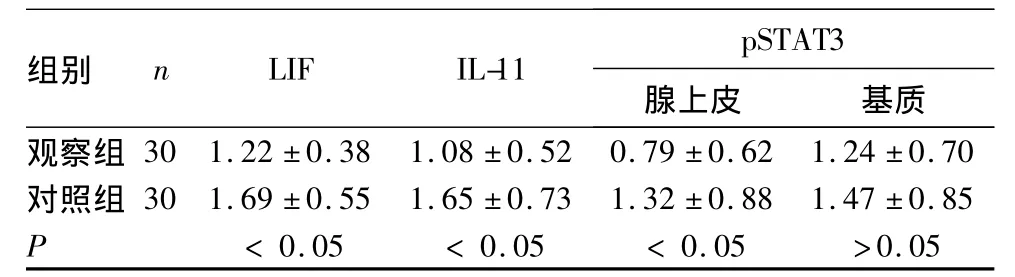
表1 两组子宫内膜中的LIF、IL-11和pSTAT3 表达比较(¯x±s)
2.2 相关性分析 双变量相关分析显示,观察组子宫内膜中的 LIF与 IL-11、IL-11与 pSTAT3(腺上皮)、pSTAT3(腺上皮)与 LIF表达均呈显著正相关,r分别为0.489、0.803、0.573,P 均 <0.01。
3 讨论
LIF是IL-6细胞因子家族成员,有调节细胞增殖、分化和细胞活化等作用[1]。Steward 等[2]研究发现小鼠胚胎无法在LIF基因缺失的野生型纯合子雌性小鼠子宫内膜种植,而对缺乏LIF基因的小鼠注射LIF后则可恢复其胚胎种植能力,证实LIF是小鼠胚胎着床的必要细胞因子。人类子宫内膜增殖期LIF表达量极少,中晚分泌期腺腔上皮和腺上皮表达大量LIF蛋白和mRNA,为增殖期的4~5倍,其表达特点与种植窗期时间高度吻合[3]。Laird等[4]研究发现,正常生育妇女宫腔灌洗液中的LIF升高,不孕症患者呈下降趋势;前者月经第18~21天体外子宫内膜组织培养基中的LIF高于后者及IVF-ET患者,且其研究被部分不孕症患者编码LIF基因区域出现突变的结果所证实[5]。因此,胚胎种植窗期子宫内膜LIF升高的时序性在胚胎种植中起重要作用,它被认为是很少的以“全或无”方式影响生殖力的因子之一。本研究显示,观察组子宫内膜中的LIF表达低于对照组,与文献报道结果相似。
IL-11是在多种细胞谱系发挥多效性作用的细胞因子,其参与调控炎症和损伤的反应,并与子宫内膜蜕膜化反应相关,具有潜在的抑制细胞凋亡作用[6]。IL-11和LIF一样同属于 IL-6家族,两者功能有所交叠。IL-6家族的细胞因子介导活性是通过高亲和力受体(即特异性受体)α亚基与一个共同的信号转导亚基gp130结合形成异二聚体而启动信号。IL-11与其受体(IL-11Rα)结合后启动信号,同时LIF与LIF受体LIFR结合启动信号,各自的配受体复合物和普通的跨膜信号传感器gp130结合形成异二聚体[7]。有研究表明,人为使编码IL-11Rα基因进行失效突变后的雌性小鼠无法受孕,其原因是子宫内膜对植入的囊胚产生相应的蜕膜化反应存在缺陷[8]。研究表明,整个月经周期子宫内膜均表达IL-11、IL-11Rα mRNA[9]。具有免疫活性的 IL-11 在分泌中后期的子宫腺腔内和腺上皮表达增加,尤其是在分泌晚期的蜕膜化基质细胞中表达激增[10]。雌性小鼠妊娠头3个月IL-11RαmRNA和IL-11蛋白存在于蜕膜和绒毛,而非妊娠状态则明显减少,IL-11表达量对区别妊娠与否可能起重要作用,IL-11信号已被确定为区别雌性小鼠胚胎生育能力的关键生物指标,所以IL-11和LIF在鼠类的胚胎种植是必须的[11]。此外,对小鼠、大鼠、非人灵长类和人类预测IL-11氨基酸序列的研究表明,IL-11表达在各物种之间是高度保守的[12]。本研究显示,观察组子宫内膜中的IL-11表达低于对照组,说明不孕症患者存在IL-11表达缺陷。
STAT3是STATs蛋白家族的一个亚型,广泛表达于不同类型的组织和细胞中,在调节细胞增殖、分化、凋亡等方面发挥重要的生理作用。另外,STAT3也与多种疾病的发生有关,特别是肿瘤疾病。鉴于胚胎种植过程中滋养细胞侵袭子宫内膜与肿瘤的转移有极大的相似性,STAT3可能在胚胎种植的过程中发挥重要的生理作用。Bhatt等[13]以小鼠为研究对象,用一种能透过细胞膜的pSTAT3抑制剂阻断小鼠的STAT3作用,发现其体内外的磷酸化作用均明显降低,且胚胎种植率下降,表明小鼠胚胎成功的种植依靠子宫内膜STAT3的磷酸化和激活。本研究显示,观察组子宫内膜中的pSTAT3表达低于对照组,说明不孕症患者存在pSTAT3表达缺陷。
Dimitriadis等[14]研究表明,IL-11 通过 pSTAT3和细胞因子信号抑制因子启动和促进子宫内膜基质细胞向蜕膜细胞分化,从而促进胚胎种植;并首次证明不孕症患者子宫内膜中的pSTAT3、IL-11表达下降。IL-11主要出现在腺上皮细胞,腺腔细胞表现为较少染色;而 pSTAT3在两者都出现,且IL-11和pSTAT3染色在不孕症患者的子宫内膜腺上皮细胞明显低于正常组,表明两者在不孕症患者均存在表达缺陷,且在种植窗期的子宫内膜腺上皮分泌转换中发挥重要作用。本研究显示,观察组子宫内膜中的LIF、IL-11、pSTAT3(腺上皮)表达均低于对照组,说明三者在不孕症患者的种植窗期子宫内膜腺上皮中均存在表达缺陷,且三者之间具有显著正相关性。其原因可能为STAT3能被多种细胞因子激活,包括LIF、IL-6、IL-11、制瘤素 M、瘦素等[15];但在子宫内膜上皮只有LIF与腺腔上皮的LIF受体LIFR结合后使STAT3磷酸化和移位核内来应答LIF,在体内由LIF激活的 STAT3引起其从腺腔上皮细胞质内移位到核内,这一过程与ER启动同步发生。因此,LIFR活性与STAT3磷酸化相关,且在腺腔上皮短暂地被调节;ER由LIF的表达及其受体抑制物所控制,而其他激活 STAT3的细胞因子IL-6、制瘤素 M等都不能在子宫内膜上皮激活 STAT3。本研究结果证实了上述结论。
总之,原因不明不孕症患者种植窗期子宫内膜中的LIF、IL-11及pSTAT3表达存在缺陷,导致胚胎种植能力下降,三者间存在显著相关性。但三者的具体相互关系,尤其是LIF、IL-11对pSTAT3进行精细调控的机制及pSTAT3的具体功能仍需要进一步研究和阐述。
[1]Mylonas I,Makovitzky J,Shabani N,et al.Leukemia inhibitory factor(LIF)is immunohistochemically expressed in normal,hyperplastic and malignant endometrial tissue[J].Eur JObstet Gynecol Reprod Biol,2005,118(1):101-108.
[2]Chen JR,Cheng JG,Shatyer T,et al.Leukemia inhibitory factor can substitute for nidatory estrogen and is essential to inducing a receptive aterus for implantation,but is not essential for subsequnent embryogenesis[J].Endocrinology,2000,141(12):4365-4372.
[3]Bourgain C,Devroey P.The endometrium in stimulated cycles for IVF[J].Hum Reprod Update,2003,9(6):515-522.
[4]Laird SM,Tuckerman EM,Li TC.Cytokine expression in the endometrium of women with implantation failure and recurrent miscarriage[J].Reprod Biomed Online,2006,13(1):13-23.
[5]Altmae S,Martinez-Conejero JA,Salumets A,et al.Endometrial gene expression analysis at the time of embryo implantation in women with unexplained infertility[J].Mol Hum Reprod,2010,16(3):178-187.
[6]Dimitriadis E,Robb L,Salamonsen LA.Interleukin 11 advances progesterone induced decidualisation of human endometrial stromal cells[J].Mol Hum Reprod,2002,8(6):636-643.
[7]Hilton DJ,Hilton AA,Raicevic A,et al.Cloning of a murine IL-11 receptor alpha chain:requirement for gp130 for high affinity binding and signal transduction[J].EMBO,1994,13(3):4765-4775.
[8]Bilinski P,Roopenian D,Gossler A.Maternal IL-11Rα function is required for normal decidua and fetoplacental development in mice[J].Genes Dev,1998,12(12):2234-2243.
[9]Dimitriadis E,Salamonsen LA,Robb L.Expression of interleukin-11 during the human menstrual cycle:coincidence with stromal cell decidualization and relationship to leukaemia inhibitory factor and prolactin[J].Mol Hum Reprod,2000,6(5):907-914.
[10]Chen HF,Lin CY,Chao KH,et al.Defective production of interleukin-11 by decidua and chorionic villi in human anembryonic pregnancy[J].Clin Endocrinol Metab,2002,87(12):2320-2328.
[11]Li R,Hartley L,Robb L.Cloning of rat interleukin 11 and interleukin 11 receptor alpha chain and analysis of their ex-pression in rat uterus in the peri-implantation period[J].Reproduction,2001,12(2):593-600.
[12]Darnell JE Jr.STATs and gene regulation[J].Science,1997,277(5332):1630-1635.
[13]Bhatt H,Brunet LJ,Stewart CL.Uterine expression of leukemia inhibitory factor coincides with the onset of blastocyst implantation[J].PNAS,1991,88(6):11408-11412.
[14]Dimitriadis E,Sharkey AM,Tan YL,et al.Immunolocalisation of phosphorylated STAT3,interleukin 11 and leukaemia inhibitory factor in endometrium of women with unexplained infertility during the implantation window[J].Repord Biol Endocrinol,2007,5(1):44.
[15]Chapman RS,Lourenco P,Tonner E,et al.The role of Stat3 in apoptosis and mammary gland involution.Conditional deletion of Stat3[J].Adv Exp Med Biol,2000,480(10):129-138.

