姜黄素对脂多糖诱导大鼠肝脏Kupffer细胞NF-κB及下游炎症因子的影响
张 哲 ,闻勤生,倪 阵 ,刘震雄,王景杰,王旭霞,赵曙光
第四军医大学唐都医院消化内科,陕西西安710038
脂多糖(lipopolysaccharide,LPS)是 G-杆菌细胞壁的重要成分,作为一种强有力炎症反应诱导剂,能够诱导Kupffer细胞活化,合成并释放炎性介质及细胞毒性因子,参与非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)的发病[1]。姜黄素是一种植物多酚,具有清除氧自由基、抗细胞增殖、抗炎、抗肿瘤等作用[2]。我们前期实验已证实[3],姜黄素通过促进Nrf2的核转位增加抗氧化酶的表达,发挥肝脏的保护作用。近年研究发现姜黄素可通过减少炎性因子合成与释放,对NAFLD起到保护作用[4],但具体机制目前尚不清楚。本研究通过观察姜黄素对LPS诱导Kupffer细胞炎性蛋白NF-κB及下游炎性因子TNF-α、IL-1β和IL-6的影响,从而从Kupffer细胞角度阐明姜黄素对NAFLD的保护作用及机制。
1 材料与方法
1.1 材料
1.1.1 实验动物:健康雄性SD大鼠(清洁级),体质量(300±50)g,由第四军医大学实验动物中心提供。
1.1.2 实验试剂:姜黄素、LPS(O55:B5)均购自美国Sigma公司;NF-κB p65兔抗大鼠多克隆抗体购自英国Abcam公司;二抗FITC标记的山羊抗兔多克隆抗体和山羊血清封闭工作液均购自北京中衫金桥生物技术有限公司;山羊抗兔IgG抗体(二抗)、FITC标记的山羊抗兔多克隆抗体(二抗)和山羊血清封闭工作液均购自北京中衫金桥生物技术有限公司;ELISA试剂盒购自西塘生物技术有限公司。
1.2 实验方法和步骤
1.2.1 SD大鼠Kupffer细胞分离、培养:SD大鼠肝脏Kupffer细胞的分离培养参照文献[5]。
1.2.2 LPS和姜黄素对Kupffer细胞NF-κB核转位的影响:将分离的Kupffer细胞按1×105/ml接种于24孔板,培养48 h后,对照组:常规培养;LPS组:给予终浓度为100 ng/ml的LPS培养8 h;姜黄素组:给予25 μmol/L姜黄素干预2 h后,其余处理同LPS组。收集细胞,固定、冲洗、封闭、加一抗(兔抗大鼠 NF-κB p65多克隆抗体1∶500)、冲洗、加二抗(山羊抗兔多克隆抗体 1∶200)、冲洗、DAPI、冲洗、荧光显微镜下观察。
1.2.3 Western blotting检测 NF-κB p65蛋白水平:将
1.2.2 收集的细胞按照核-胞浆蛋白提取试剂盒说明,提取不同组别Kupffer细胞胞浆和胞核蛋白,BCA法蛋白定量后,加上样缓冲液100℃煮沸5 min。取30 μg蛋白样品于8%SDS-PAGE凝胶电泳分离蛋白,转至NC膜,5%脱脂牛奶37℃摇床封闭1 h,加入一抗(1∶1 000)及内参 β-actin(1∶500),4 ℃ 孵育过夜,PBST 洗涤3 次,5 min/次,加入二抗(1∶500),37 ℃摇床孵育2 h,PBST洗3次,5 min/次,应用ECL发光液、化学发光成像系统自动曝光采集图像。采用Image J图像分析软件测定条带灰度值,以目的条带灰度值与β-actin灰度值的比值反映各组胞浆 IκBα、p-IκBα 及胞核NF-κB p65蛋白表达情况。
1.2.4 姜黄素对LPS诱导KC炎症细胞因子TNF-α、IL-1β和IL-6释放的抑制作用:ELISA法测定1.2.2收集的细胞上清TNF-α、IL-1β和IL-6水平,按试剂盒说明书操作,取出ELISA板依次加入标准品、细胞上清样本100 μl/孔,将反应板充分混匀后置37℃、2 h,洗板(用洗涤液洗涤4~6次),吸干;每孔加入标本稀释液和第一抗体工作液各50 μl(空白除外),37℃静置1 h,洗板;每孔加入酶标抗体工作液100 μl,37℃静置30 min,洗板;每孔加入底物工作液100 μl,37 ℃暗处反应15 min;每孔加入100 μl终止液混匀,30 min内用酶标仪在450 nm处测吸光值。根据所设标准品稀释梯度设定标准曲线,求出各样本的浓度。
1.3 统计学分析 采用SPSS 16.0软件进行统计学分析,各组所得计量数据用±s表示,组间均数两两比较用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 姜黄素对LPS诱导Kupffer细胞NF-κB活化抑制 实验结果显示,LPS能明显诱导NF-κB核转位,姜黄素能明显抑制LPS诱导NF-κB核转位(见图1)。
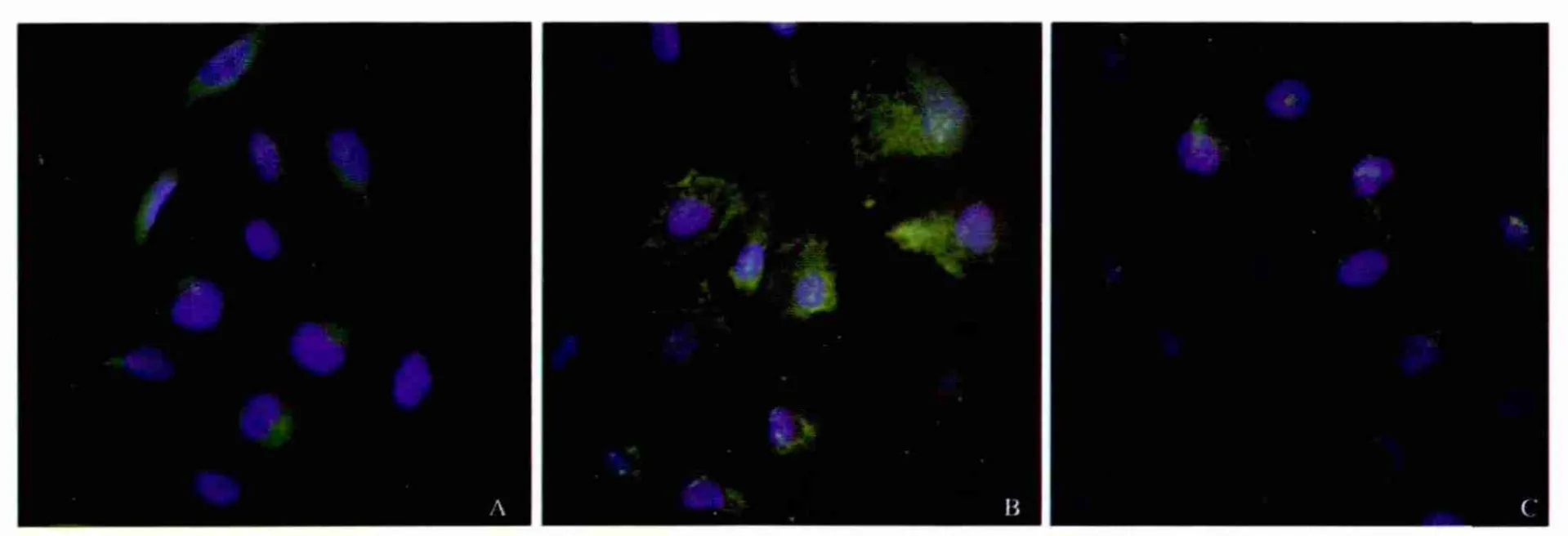
图1 免疫荧光法检测各组细胞NF-κB核转位 A:对照组;B:LPS组;C:姜黄素组Fig 1 The translocation of NF-κB detected by immunofluorescence staining A:control group;B:LPS group;C:curcumin group
2.2 姜黄素对LPS诱导Kupffer细胞NF-κB水平表达影响 Western blotting检测结果并作灰度分析显示,对照组胞浆蛋白IκBα表达显著高于LPS组和姜黄素组(P<0.05),但LPS组明显低于姜黄素组(P<0.05);LPS组胞核 NF-κB p65和 p-IκBα 表达显著高于对照组和姜黄素组(P<0.05),但姜黄素组表达显著高于对照组(P<0.05,见图2、表1),提示姜黄素可以降低NF-κB的活化、阻止前炎症因子的表达。
2.3 姜黄素对LPS诱导Kupffer细胞炎症细胞因子合成的影响 LPS组细胞上清TNF-α、IL-1β和IL-6表达显著高于对照组(P<0.05),姜黄素组细胞上清TNF-α、IL-1β 和 IL-6显著低于 LPS刺激组(P<0.05),但显著高于对照组(P<0.05,见表2)。
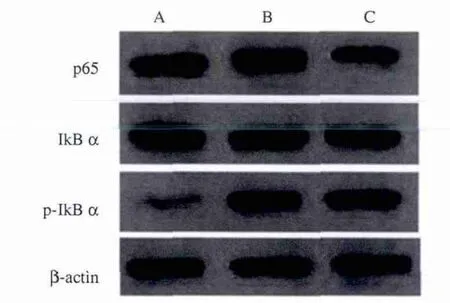
图2 各组细胞NF-κB表达水平 A:对照组;B:LPS组;C:姜黄素组Fig 2 The expression of NF-κB A:control group;B:LPS group;C:curcumin group
表1 各组细胞 p65、IκBα、p-IκBα表达 ( ±s)Tab1 Expression of p65,IκBα,p-IκBα in each group( ± s)

表1 各组细胞 p65、IκBα、p-IκBα表达 ( ±s)Tab1 Expression of p65,IκBα,p-IκBα in each group( ± s)
注:与对照组比较,*P<0.05;与LPS组比较,#P<0.05。
细胞核(p65) 细胞浆(IκBα) 细胞浆(p-IκBα)对照组0.7277±0.0243 1.4102±0.0965 0.0038±0.0015 LPS组 1.6840±0.1110* 0.6197±0.0284* 1.0742±0.0178*姜黄素组 0.6542±0.0221*# 0.9138±0.0326*# 0.8079±0.0118*#
表2 各组细胞上清 TNF-α、IL-1β和 IL-6 水平的比较( ±s)Tab2 Compared the level of three groups on TNF-α,IL-1β and IL-6

表2 各组细胞上清 TNF-α、IL-1β和 IL-6 水平的比较( ±s)Tab2 Compared the level of three groups on TNF-α,IL-1β and IL-6
注:与对照组比较,*P<0.05;与LPS组比较,#P<0.05。
TNF-α(ng/ml)IL-1β(ng/ml) IL-6(pg/ml)对照组1.21±1.27 0.30±0.362 49.73±12.34 LPS组 56.2±7.62* 18.12±2.14* 290.3±28.9*姜黄素组 8.97±4.35*# 4.26±0.98*# 98.43±24.12*#
3 讨论
NAFLD发病机制目前尚未阐明[6]。Marshall于1998年提出了“肝 -肠轴”的概念[7-8],即机体在遭受打击后,肠屏障功能受损,肠道内细菌和LPS大量进入门脉系统,LPS激活肝内Kupffer细胞,释放一系列炎症因子,这些炎症因子进一步造成肠道黏膜及远隔器官损伤。近年研究证实,肠道微生态失衡在NAFLD发病中发挥重要作用。其中LPS诱导Kupffer细胞活化并释放炎症因子在NAFLD发病中居核心地位[9]。因此,抑制LPS诱导的Kupffer细胞活化,对于防治NAFLD具有重要意义。本实验观察到姜黄素能够抑制LPS诱导的大鼠肝脏Kupffer细胞NF-κB活化及相关炎症因子TNF-α、IL-1β和IL-6的合成。
姜黄素是一种多酚类化合物,主要存在于姜科及天南星科植物的根茎中,是我国常用中药姜黄、郁金、莪术、石菖蒲的主要有效化学成分,具有调节血脂、抗氧化、抗炎、抗纤维化、抗肿瘤等作用,且价格低廉、毒性低,已被各国学者广泛应用于相关基础和临床研究[10]。本课题组前期研究证明[3,11],姜黄素上调 Nrf2的表达从而减轻肝细胞及肝星状细胞氧化应激,进而减轻氧化应激导致的胰岛素抵抗及细胞外基质的分泌,发挥对NAFLD的保护作用。本实验中我们进一步观察到姜黄素能够抑制LPS诱导的Kupffer细胞炎症蛋白NF-κB活化,进而抑制下游炎症因子的合成与释放。LPS被Kupffer细胞膜表面的CD14识别后激活TLR4受体,主要通过TLR4-MyD88信号通路触发一系列的炎症信号级联反应,激活IκB激酶(IKKs)使IκB磷酸化而降解,暴露出NF-κB亚单位p65上的核结合位点,导致NF-κB向核内转移,并与下游表达炎症因子的启动子结合,诱导其转录并合成大量的炎性因子[12-13]。
本实验中细胞免疫荧光检测结果表明,LPS诱导Kupffer细胞NF-κB的核转位,姜黄素能明显抑制这一效应。Western blotting结果表明,LPS能促进IκBα的磷酸化,使 NF-κBp65活化增加,从而使胞核内 NF-κBp65水平增加,通过与其下游炎症因子的启动子结合,诱导其转录并合成大量的炎性因子。通过对细胞培养液中TNF-α、IL-1β和IL-6水平的检测,证实LPS能够在诱导NF-κB核转位的同时,伴随有这些炎症因子合成的增加。而姜黄素通过抑制IκBα的磷酸化,减少NF-κB的活化,进而减轻这些炎症因子的合成。
因此,姜黄素可能通过抑制LPS诱导Kupffer细胞活化和炎性蛋白NF-κB的活化,减少炎性因子的合成释放,进而发挥对NAFLD的防治作用。
[1]Aron-Wisnewsky J,Gaborit B,Dutour A,et al.Gut microbiota and non-alcoholic fatty liver disease:new insights[J].Clin Microbiol Infect,2013,19(4):338-348.
[2]Khalil MI,Al-Zahem AM,Al-Qunaibit MH.Synthesis,characterization,mössbauer parameters,and antitumor activity of Fe(Ⅲ)curcumin complex[J].Bioinorg Chem Appl,2013,2013:982423.
[3]Zhao SG,Li Q,Liu ZX,et al.Curcumin attenuates insulin resistance in hepatocytes by inducing Nrf2 nuclear translocation [J].Hepatogastroenterology,2011,58(112):2106-2111.
[4]Ramirez-Tortosa MC,Ramirez-Tortosa CL,Mesa MD,et al.Curcumin ameliorates rabbits’s steatohepatitis via respiratory chain,oxidative stress,and TNF-alpha [J].Free Radic Biol Med,2009,47(7):924-931.
[5]Zhang Z,Zhao SG,Ni Z,et al.An improved method for isolation rat liver Kupffer cells[J].Chin J Gastroentrol Hepatol,2012,21(11):1060-1064.张哲,赵曙光,倪阵,等.一种改良大鼠肝脏Kupffer细胞分离方法[J].胃肠病学和肝病学杂志,2012,21(11):1060-1064.
[6]Farrell GC,Larter CZ.Nonalcoholic fatty liver disease:from steatosis to cirrhosis[J].Hepetalogy,2006,43(2 Suppl 1):S99-S112.
[7]Marshall JC.The gut as a potential trigger of exercise-induced inflammatory responses [J].Can J Physiol Pharmacol,1998,76(5):479-484.
[8]Miele L,Marrone G,Lauritano C,et al.Gut-liver axis and microbiota in NAFLD:insight pathophysiology for novel therapeutic target[J].Curr Pharm Des,2013,19(29):5314-5324.
[9]Shen F,Fan JG.Research progress on gut microbial ecology in the pathogenesis of nonalcoholic fatty liver disease[J].Chin J Gastroentrol Hepatol,2011,20(10):968-971.沈峰,范建高.肠道微生态在非酒精性脂肪性肝病发病机制中的研究作用[J].胃肠病学和肝病学杂志,2011,20(10):968-971.
[10]Shehzad A,Ha T,Subhan F,et a1.New mechanisms and the antiinflammatory role of curcumin in obesity and obesity-related metabolic diseases[J].Eur J Nutr,2011,50(3):151-161.
[11]Zheng YY,Liu ZX,Zhao SG,et al.Influence of curcumin on hepatic stellate cells activation and extracellular matrix secretion in oxidative stress [J].Chin J Gastroentrol Hepatol,2011,20(4):309-313.郑媛媛,刘震雄,赵曙光,等.姜黄素对氧化应激中肝星状细胞活化及细胞外基质分泌的影响[J].胃肠病学和肝病学杂志,2011,20(4):309-313.
[12]Abu-Shanab A,Quigley EM.The role of the gut microbita in nonalcoholic fatty liver disease[J].Nat Rev Gastroenterol Hepatol,2010,7(12):691-701.
[13]Machado MV,Cortez-Pinto H.Gut microbiota and nonalcoholic fatty liver disease[J].Ann Hepatol,2012,11(4):440-449.

