糖基转移酶抑制剂诱导原代肝细胞损伤中DNA损伤诱导蛋白DDI2 mRNA表达的研究
杜 冰 ,刘美燕,吕志武,王新红,魏红山,肖 凡 ,金世柱
1.哈尔滨医科大学附属第二医院消化内科,黑龙江哈尔滨150086;2.哈尔滨医科大学附属第三医院内四科;3.首都医科大学附属北京地坛医院传染病研究所
相关体外研究发现,转染HBV表面包膜大蛋白(HBV large surface protein,LHBs)或给予血管紧张素Ⅱ处理大鼠肝细胞系HSC-T6后,DNA损伤诱导蛋白(DNA damage inducible protein 2,DDI2)表达增强[1]。根据国内外有关该领域研究的最新进展,以及相关生物信息学资料显示,该蛋白为天冬氨酸肽酶,且具有诱导DNA损伤的作用[2-3]。因此,我们推测该蛋白表达可能与肝细胞损伤过程中介导的DNA损伤有关。
衣霉素(tunicamycin,TM)是一种天然的核苷抗生素,也是N-糖基化修饰抑制剂,可通过抑制蛋白糖基化途径中十四糖二磷酸长萜醇的生成,使糖链加工受阻,形成脱糖蛋白,阻碍内质网内新生蛋白质糖基化修饰,介导细胞凋亡,内质网中钙离子紊乱和未折叠蛋白质蓄积可引发内质网应激(endoplasmic reticulum stress,ERS),引起具有保护作用的未折叠蛋白反应发生[4]。ERS直接影响应激细胞的转归,如:修复、损伤或凋亡。相关研究已经证实衣霉素能够通过细胞凋亡的机制导致肝脏细胞及相关胃癌细胞凋亡[5-7]。O-糖基化修饰在肝纤维化及肝损伤过程中也起到相应的作用[8-9],但有关O-糖基化修饰抑制剂与内质网应激以及肝细胞代谢及损伤之间的关系尚无明确定论。为研究Ddi2在糖基化修饰过程中的表达及变化,我们以N-糖基化修饰抑制剂衣霉素及O-糖基转移酶抑制剂Benzyl-α-GalNAc对原代培养大鼠肝细胞进行刺激[10],从而研究其对DNA损伤诱导蛋白在mRNA水平表达的影响。
1 材料与方法
1.1 主要实验材料及试剂 Ⅳ型胶原酶、衣霉素购自Sigma公司,Benzyl-α-GalNAc购自 Calbiochem 公司,EDTA购自Fluka公司,HEPES购自Gibco公司,胎牛血清购自Hyclone公司,DMEM购自Gibco公司,Trizol RNA提取试剂盒购自Invitrogen公司,SYBR ExScript RT-PCR Kit购自Takara公司。DL2000 DNA Marker购自TaKaRa公司,所用引物由上海生工生物技术公司合成。
1.2 仪器 美国Beckman公司低温高速离心机;日本Olympus公司倒置显微镜;ABI 7500 Real-time定量PCR仪;美国GS公司CO2恒温培养箱。
1.3 实验动物 清洁级SD雄性大鼠,体质量200~250 g,购自中国协和医科大学实验动物研究所。
1.4 大鼠原代肝脏细胞分离和培养 腹腔注射2%戊巴比妥钠10 mg/100 g,0.06%肝素钠20 U/100 g。75%乙醇浴消毒,仰卧固定在灌注盘里,剔毛、乙醇消毒。沿腹壁正中剖开腹腔剖腹,充分暴露门静脉和下腔静脉后门静脉插入无菌塑料管,手术线固定塑料管。剪断下腔静脉同时灌流提前20 min 37℃预温的前灌流液,以20~40 ml/min的速度灌流约5~10 min,至肝脏表面呈现黄色为止;随之以37℃预温含0.02%Ⅳ型胶原酶的后灌流液,以10~20 ml/min速度灌流,灌至管路中残余的预灌流液排尽即可钳夹下腔静脉出口端,使低浓度胶原酶液充盈于肝脏,肉眼见各肝叶均匀肿胀立即停止灌流,静止1~3 min。重复若干次。至肝脏表面可见絮状纹路,体积缩小塌陷,立即取下肝脏,用眼科镊撕除包膜及纤维成分,钝性刮梳并反复吹打分离肝脏细胞后,以4℃含20%胎牛血清的DMEM终止消化。100目细胞筛过滤收集肝细胞悬液。随后以500 r/min离心5 min,弃上清。反复清洗离心3次,以获得较纯化的肝细胞。将肝细胞悬液取样在光镜下计数,将5×106个新鲜大鼠肝细胞用7 ml含20%胎牛血清、100 U/ml青霉素、100 mg/L链霉素的DMEM接种于直径8 cm培养皿于37℃,5%CO2条件下培养[11]。
1.5 糖基转移酶抑制剂对大鼠原代肝细胞作用实验稳定培养2 d后,待肝细胞贴壁后即更换新鲜培养液,其后每1~2 d换液1次。肝细胞的形态观察实验过程中用Olympus倒置显微镜对分离纯化和接种的肝细胞进行形态学观察。原代肝细胞培养至第9天,生长状态良好,稳定增殖,将5×106个细胞接种在培养皿内;当细胞长至80%时,换液,并将N-糖基化修饰抑制剂衣霉素按终浓度1 μg/ml及O-糖基化修饰抑制剂Benzyl-α-GalNAc按终浓度2 mmol/L加入细胞培养液,对照组为不加入任何药物作用。轻摇培养皿以使药物混匀,培养48 h。
1.6 RT-PCR检测DDI2的表达 按照分子克隆Trizol法提取各组原代肝细胞细胞总RNA,紫外分光光度计测定RNA的浓度和纯度,用RT-PCR试剂盒将提取的RNA逆转录为cDNA,-20℃保存备用。根据DDI2基因序列,在编码区的上游和下游设计合成一对寡聚核苷酸引物。RT-PCR的反应条件:42℃,反转录15 min,95℃ 2 min灭活反转录酶。合成的cDNA用于PCR扩增,每个反应均设3个复孔,并使用等量的cDNA(见表1)。两步法PCR扩增标准程序为步骤1:预变性95℃ 10 s;步骤2:PCR反应 95℃ 5 s,60℃20 s,40 个循环。

表1 Real-time PCR相应基因引物序列Tab1 Primer sequence of DDI2 and β-actin for Real-time PCR
1.7 统计学处理 采用ΔΔCT方法处理实验数据并进行相对定量比较,采用单因素方差分析进行统计,P<0.05为差异有统计学意义。
2 结果
2.1 成功分离并培养大鼠肝脏原代细胞 原代培养的肝细胞在24 h时,可见大量的细胞贴壁,细胞多数散在分布,边缘伸展,透亮、呈多边形或类圆形,边界清晰,胞体变平变薄,细胞核位于正中,可见双核细胞(见图1A);培养第4天,可观察到肝细胞有集落生长的克隆现象,新生的肝细胞部分连接成片,细胞多呈多边形,胞质颜色变淡,胞核为单核或双核,核仁圆形,清晰可见(见图1B);培养第7天,集落现象增多,可见集落周围伸出伪足,部分连接成片(见图1C);培养第9天,新生肝细胞进一步增多,爬壁现象明显,连接成片(见图1D)。
2.2 Trizol法提取细胞总RNA琼脂糖凝胶电泳鉴定凝胶电泳验证提取总RNA成功(见图2)。图中1,2自上至下可见RNA的28S、18S和5S条带清晰。
2.3 药物刺激大鼠原代肝细胞Real-time PCR检测DDI2表达 Real-time PCR 结果分析,DDI2/β-actin的相对定量采用ΔΔCT计算。结果显示两组糖基转移酶抑制剂作用于原代肝细胞所表达的DDI2/β-actin相对定量的差异有统计学意义(P<0.05)。DDI2表达水平在Benzyl-α-GalNAc作用后较对照组有所下调,衣霉素组较对照组有明显上调(见图3)。
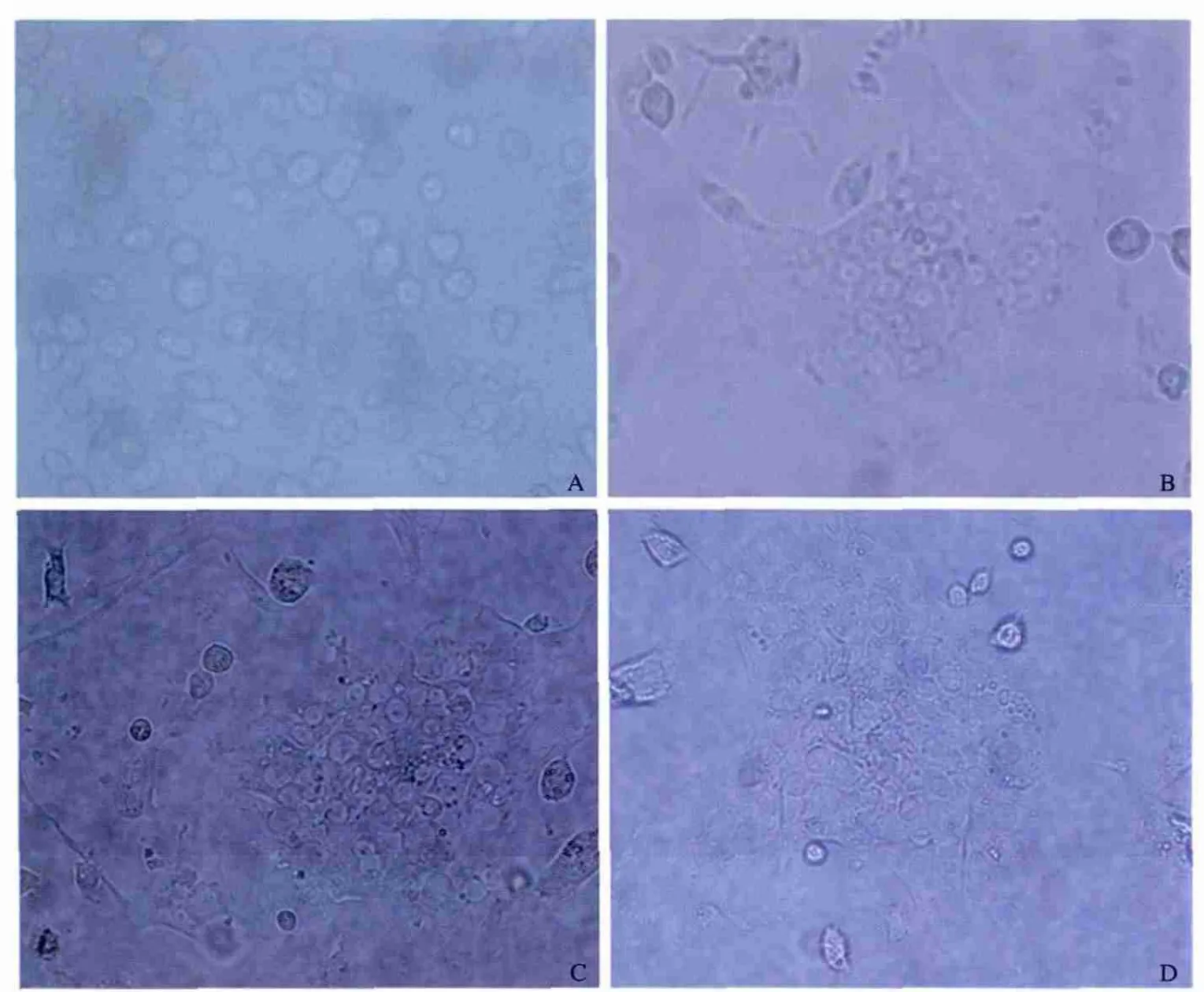
图1 原代肝细胞培养情况 A:培养24 h的大鼠原代肝细胞(400×);B:培养4 d的大鼠原代肝细胞(400×);C:培养7 d的大鼠原代肝细胞(400×);D:培养9 d的大鼠原代肝细胞(400×)Fig 1 The image of the culture of the primary hepatocyte A:primary rat hepatocytes after 24 hours(400×);B:primary rat hepatocytes after 4 days(400×);C:primary rat hepatocytes after 7 days(400×);D:primary rat hepatocytes after 9 days(400×)
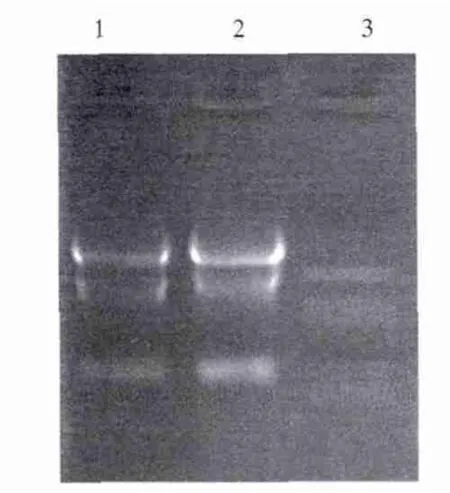
图2 提取原代肝细胞总RNA电泳鉴定 1、2:细胞总RNA;3:DL 2000 DNA markerFig 2 Identification of total RNA Line 1,2:total RNA;Line 3:DL 2000 DNA marker
3 讨论
为了进一步探讨DNA损伤诱导蛋白DDI2表达在原代培养大鼠肝细胞中的作用,我们分离纯化了SD大鼠原代肝细胞。在实验中之所以采用原代肝细胞而非肝脏来源的细胞系作为工具来研究药物对DDI2表达的影响,原因在于一方面原代肝细胞在一定的体外培养条件下仍保留许多体内细胞的功能和活性,特别是其很好保持了药物代谢酶的活性,使其成为对药物、毒物进行药理学、药物代谢和毒理学研究灵敏度较高的模型,同时结合本实验对于DNA损伤诱导蛋白是否与糖基转移酶抑制剂作用相关的特点,使用原代肝细胞可较经济和迅速的阐明药物对药物代谢酶的诱导或抑制,从而避免采用大量动物进行药理效应筛选。采用胶原将鼠肝细胞分离纯化,可以提供近似于体内状态的基质环境,有利于维持肝细胞的形态和肝脏特异基因的表达[12]。
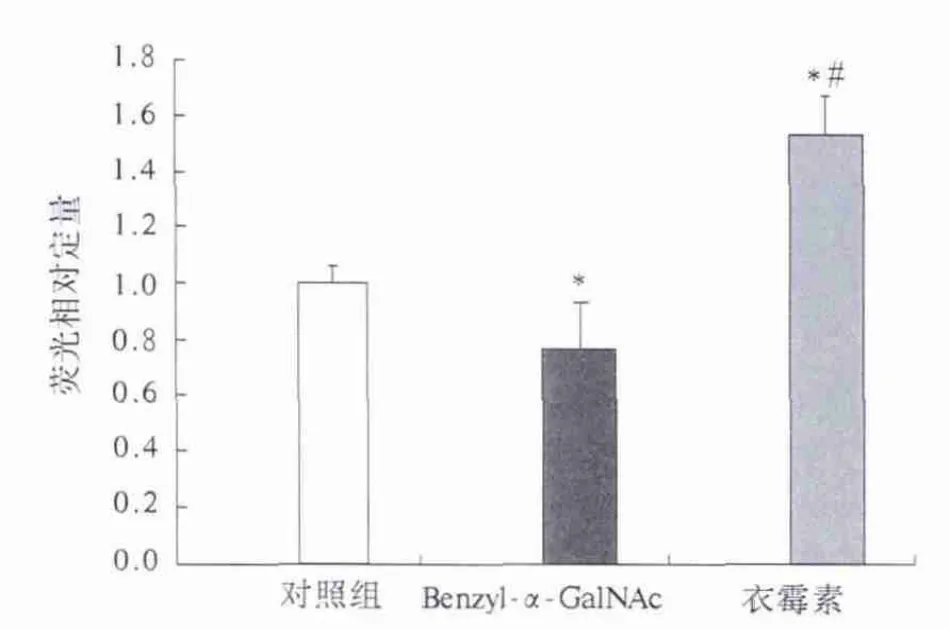
图3 各实验组DDI2相对荧光定量表达结果比较Fig 3 Comparison of relative quantitation of DDI2 mRNA in different groups
衣霉素是内质网应激常用诱导药物,衣霉素处理可以上调DNA损伤诱导蛋白DDI2的表达[13]。由此我们推论衣霉素在诱导细胞凋亡的过程中直接或间接导致了DNA损伤,进而使DDI2蛋白表达增加,促进了细胞的凋亡及坏死。本实验结果显示,与N-糖基化修饰抑制剂衣霉素相对比,O-糖基化修饰抑制剂Benzylα-GalNAc处理后的原代培养细胞DDI2表达有所下调。该结果提示O-糖基化修饰抑制剂可减轻DNA损伤所导致的DDI2蛋白的表达,同时也为进一步研究该作用是否可以缓解或逆转细胞内DNA损伤所导致的细胞损伤奠定了前期工作基础。
[1]Li GL,Wei HS,Song SJ,et al.The effects of angiotensinⅡ on gene expression of hepatic stellate cells[J].Chin J Hepatol,2006,14(12):914-919.李国力,魏红山,宋淑静,等.血管紧张素Ⅱ对肝星状细胞基因表达的影响[J].中华肝脏病杂志,2006,14(12):914-919.
[2]Wei HS,Li DG,Lu HM,et al.The effects of angiotensinⅡon proliferation and collagen synthesis of hepatic stellate cells[J].Chin J Hepatol,2001,9(3):133.魏红山,李定国,陆汉明,等.血管紧张素Ⅱ对肝星状细胞增殖及胶原合成的影响[J].中华肝脏病杂志,2001,9(3):133.
[3]Shen B,Du B,Lv ZW,et al.Preparation and identification of DDI2 monoclonal antibody [J].Chin J Gastroenterol Hepatol,2011,20(4):313-315.沈冰,杜冰,吕志武,等.肝细胞DNA损伤诱导蛋白DDI2的单克隆抗体制备及鉴定[J].胃肠病学和肝病学杂志,2011,20(4):313-315.
[4]Fang H,Huang W,Xu YY,et al.Blocking of N-acetylglucosaminyltransferase V induces cellular endoplasmic reticulum stress in human hepatocarcinoma 7,721 cells[J].Cell Res,2006,16(1):82-92.
[5]Finnie JW,Read SH,Swift JG.Apoptosis in liver damage produced by tunicamycin [J].Aust Vet J,2004,82(1-2):87-90.
[6]Finnie JW.Effect of tunicamycin on hepatocytes in vitro[J].J Comp Pathol,2001,125(4):318-321.
[7]Xing JL,Feng R,Li HC,et al.Tunicamycin induces endoplasmic reticulum stressmediated apoptosis in gastric cancer cell line BGC-823 [J].World Chinese Journal of Digestology,2010,18(10):1037-1040.邢俊丽,冯若,李海春,等.衣霉素诱导胃癌细胞内质网应激介导的细胞凋亡[J].世界华人消化杂志,2010,18(10):1037-1040.
[8]Naseem S,Parrino SM,Buenten DM,et al.Novel roles for GlcNAc in cell signaling[J].Commun Integr Biol,2012,5(2):156-159.
[9]Hurtado-Guerrero R,Dorfmueller HC,van Aalten DM.Molecular mechanisms of O-GlcNAcylation[J].Curr Opin Struct Biol,2008,18(5):551-557.
[10]Byrd JC,Dahiya R,Huang J,et al.Inhibition of mucin synthesis by benzyl-alpha-GalNAc in KATOⅢgastric cancer and Caco-2 colon cancer cells[J].Eur J Cancer,1995,31A(9):1498-1505.
[11]Zhang YD,Lai Y,Zhao JL.Isolation and long-term culture of newborn mouse hepatocytes in vitro[J].China Journal of Modern Medicine,2001,11(4):1-3.张阳德,赖毅,赵俊玲.新生小鼠肝细胞的体外培养[J].中国现代医学杂志,2001,11(4):1-3.
[12]Peggy P,Tamara V,Tom H,et al.Isolation of rat hepatocytes[J].Methods in Molecular Biology,2006,320:229-237.
[13]Fontanier-Razzaq NC,Hay SM,Rees WD.Upregulation of CHOP-10(gadd153)expression in the mouse blastocyst as a response to stress[J].Mol Reprod Dev,1999,54(4):326-332.

