不同抗菌药物对嗜麦芽窄食单胞菌L2β-内酰胺酶转录的影响
王丽丽,牛文凯,尹秀云,宋世平,尚学义,柏长青,苑 鑫,李 艳
不同抗菌药物对嗜麦芽窄食单胞菌L2β-内酰胺酶转录的影响
王丽丽,牛文凯,尹秀云,宋世平,尚学义,柏长青,苑 鑫,李 艳
目的:研究临床常用抗菌药物亚胺培南、哌拉西林/他唑巴坦对嗜麦芽窄食单胞菌产生L2β-内酰胺酶的诱导作用,指导临床抗菌药物的使用。方法:应用实时荧光定量PCR方法,研究0、1/4×MIC、1×MIC、4×MIC四种浓度的亚胺培南、哌拉西林/他唑巴坦的诱导作用,观察前后L2基因的mRNA转录水平及变化。结果:1×MIC浓度的哌拉西林/他唑巴坦诱导作用最强,亚胺培南无论任何浓度其诱导作用均较弱。结论:抗菌药物亚胺培南、哌拉西林/他唑巴坦对L2β-内酰胺酶的产生具有明显诱导作用,其中酶抑制剂复合制剂作用最强,临床上应避免长期应用该类药物,以免进一步诱导嗜麦芽窄食单胞菌多药耐药性的产生。
嗜麦芽窄食单胞菌;β-内酰胺酶;诱导性;多药耐药性
嗜麦芽窄食单胞菌为非发酵革兰阴性杆菌,可产生两种诱导性β-内酰胺酶分别是L1、L2酶[1-2],临床抗菌药物对其具有诱导作用,使β-内酰胺酶表达量增加,从而使其对多种抗生素耐药,尤其对临床常用的β-内酰胺类抗菌药物高度耐药。本研究采用实时荧光定量PCR方法,从转录水平研究不同浓度的亚胺培南、哌拉西林/他唑巴坦为诱导剂时,诱导前后L2基因的mRNA转录水平及变化。从转录水平分析常用抗菌药物对L2酶的诱导作用,指导临床用药。
1 资料和方法
1.1 菌株 临床分离肺部感染患者痰中嗜麦芽窄食单胞菌1株,PCR扩增L2基因阳性。
1.2 主要试剂和仪器 亚胺培南(IP,杭州默沙东)、哌拉西林/他唑巴坦(PTC,Wyeth制药)、E-test试条(AB BIODISK公司);DNAse I、RNA酶抑制剂、M-MLV逆转录酶(Promega公司);Taq DNA聚合酶、dNTPs、DNA marker、Premix Ex TaqTM(Takara公司);IQ™5实时荧光定量PCR仪(美国BIO-RAD公司)。
1.3 PCR引物 根据嗜麦芽窄食单胞菌16S核糖体序列的保守区域设计内参引物;根据GeneBank注册的L2β-内酰胺酶全基因序列设计引物(注册号:Y08562),由上海生工生物工程技术服务公司合成。见表1。
1.4 不同浓度抗生素的诱导作用 临床分离的嗜麦芽窄食单胞菌经VITEK-32型全自动细菌检测仪进行鉴定,用E-test试条进行最低抑菌浓度(MIC)检测,大肠埃希菌ATCC 25922、铜绿假单胞菌ATCC 27853为质控菌。IP的MIC为32μg/ml、PTC的MIC为64μg/ml。根据两种抗生素的MIC值,诱导浓度分为空白对照、1/4、1、4倍MIC的IP和PTC。将嗜麦芽窄食单胞菌接种于LB平皿上37℃孵育过夜,挑取1~2个菌落接种在5 ml LB培养基中,37℃恒温摇床过夜培养,取50μl菌液至7份5 ml LB培养液中,振摇5 h至OD6000.6。在7份菌液中分别加入浓度为1/4、1、4倍MIC的IP、PTC和空白对照,37℃振摇孵育2 h。用Trizol法提取细菌RNA。

表1 PCR所用引物序列
1.5 实时荧光定量PCR测定L2转录水平 以细菌RNA逆转录合成cDNA,并以cDNA为模板,用IQ™5 Multicolor Real-Time PCR对诱导前后L2的转录水平进行测定。内参引物为16S-F、16S-R;L2引物为L2-F、L2-R,荧光定量PCR反应体系为25μl,包括Premix Ex TaqT(M2×)12.5μl、引物(20μmol/L)0.5×2μl、cDNA模板1μl、ddH20 10.5μl。反应条件:95℃30 s;95℃10 s,60℃30 s,72℃30 s,45个循环,在60℃单点收集荧光信号,延伸72℃ 7min。根据扩增曲线确定Ct值,L2的相对表达量用2-△△Ct表示。以16S rRNA为阳性内参对照基因,以校正cDNA模板的拷贝数。相对定量的计算采用2-△△Ct方法,即△Ct目标基因=Ct(目标基因)-Ct(同一样本16S rRNA);△△Ct目标基因=△Ct目标基因(实验组)-△Ct目标基因(对照组),相对倍数(实验组/对照组)=2-△△Ct。实验组为空白对照、1/4、1、4倍IP和PTC。PCR结束后取3μl PCR产物进行琼脂糖凝胶电泳。
2 结果

图1 两种抗生素诱导前后细菌RNA电泳图
2.1 不同抗生素诱导前后嗜麦芽窄食单胞菌RNA电泳图 不同浓度的亚胺培南(IP)和哌拉西林/他唑巴坦(PTC)诱导2 h后,提取细菌RNA,发现均有电泳条带。见图1。 2.2L2转录前后变化 荧光定量PCR扩增后,16S、L2转录后的产物电泳图。见图2、3。以16S为内参,计算诱导前后L2相对表达量,并做柱状图。见表2、图4。PTC诱导的L2表达量比IP诱导的L2表达量明显增多,以PTC在1倍MIC诱导浓度时,L2基因表达量最高。
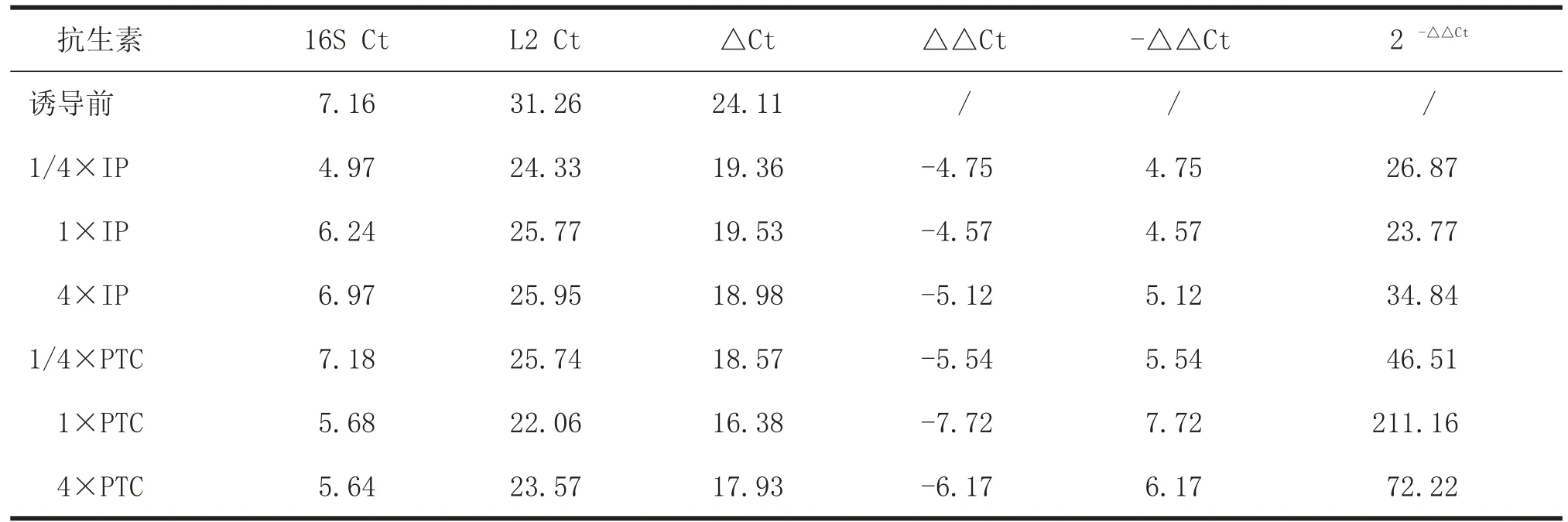
表2 诱导前、后L2相对表达量

图2 16S转录后电泳

图3 L2转录后电泳
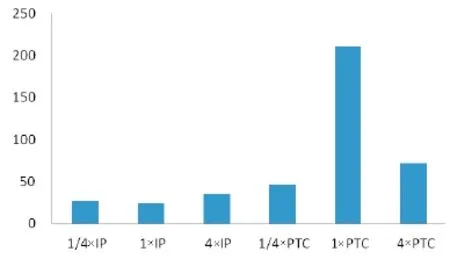
图4 L2诱导前、后相对表达量
3 讨 论
嗜麦芽窄食单胞菌产生的L2酶为具有丝氨酸活性位点的头孢菌素酶,属于bush分类中的2e,其ORF表现G+C含量高达71.6%,该酶为二聚体,分子量57 kDa,等电点为8.2,可被克拉维酸抑制,主要水解头孢菌素和单环类抗生素[2]。其组成型或诱导型表达使该菌对多数β-内酰胺类抗生素耐药。即在抗生素压力下尤其是β-内酰胺类抗菌药物,能诱导L2酶的高水平表达[3],从而使该菌对此类药物产生高水平耐药。而不同抗生素的诱导作用不完全一致。本研究应用荧光定量PCR方法,研究不同浓度抗生素诱导后L2基因的转录水平差异,以确定常用抗生素对L2酶的诱导作用。
实验中选取一株产生L2β-内酰胺酶的嗜麦芽窄食单胞菌,根据该菌对亚胺培南、哌拉西林/他唑巴坦两种抗生素的MIC,分别研究0、1/4×MIC、1× MIC、4×MIC四种不同浓度抗生素的诱导作用,发现1×MIC浓度的哌拉西林/他唑巴坦诱导作用最强,而亚胺培南,无论任何浓度其诱导作用均较弱。而既往的研究发现头孢菌素、亚胺培南均具有诱导作用,但不同临床菌株之间可能有差异。Avison等[4]通过16S rRNA的序列不同,将10株临床菌株分为A、B、C 3组,用头孢西丁诱导后发现,L2在A组中呈诱导后高水平表达,而在B、C组中表达水平极低,推测不同的嗜麦芽窄食单胞菌经诱导后L2表达量不同,其机制不详。Hu等[5]应用头孢菌素和青霉素类作为诱导剂测定L2β-内酰胺酶的活性,以头孢呋辛、头孢曲松和头孢噻肟为诱导剂时最高,而氨苄西林最低。另外的研究显示,酶抑制剂克拉维酸对该酶同样具有诱导作用[3]。
本实验中,不同浓度抗生素诱导前后L2相对表达量,以1倍MIC的哌拉西林/他唑巴坦最高,为211.16,其次是4倍浓度时,为72.22,而亚胺培南的诱导表达量为34.84,以4倍浓度时最高。可能的原因是,L2β-内酰胺酶为头孢菌素酶,不能水解碳青霉烯类抗生素,而诱导表达的L2酶很快被碳青霉烯类破坏有关。
β-内酰胺类抗生素是临床应用最广泛的一类抗菌药物,但由于日益严重的耐药性产生,β-内酰胺酶抑制剂是最好的解决途径之一。哌拉西林与他唑巴坦联合具有较强的协同作用,对大肠埃希菌、肺炎克雷伯菌和铜绿假单胞菌具有较好的抗菌活性,临床应用广泛[6]。但是,由于该制剂能够诱导嗜麦芽窄食单胞菌L2酶表达量的增加,因此,临床上在治疗敏感菌引起的感染时,可能会诱导多药耐药嗜麦芽窄食单胞菌的产生并加剧其耐药性,临床医师应高度重视,避免该药的长期、广泛应用,若临床上出现嗜麦芽窄食单胞菌感染的流行,可考虑暂停该药使用,或实行轮换抗生素使用策略,以避免选择或诱导耐药菌的出现,尤其危重患者更应高度警惕。碳青霉烯类的诱导作用不明显,但临床观察中发现嗜麦芽窄食单胞菌引起的感染患者多数使用过碳青霉烯类药物,可能的原因是碳青霉烯类为广谱抗生素,使用该类药物后将会杀灭敏感菌致使将对该类药物天然耐药的嗜麦芽窄食单胞菌选择出来。
本研究进一步验证了常用抗菌药物对β-内酰胺酶产生的具有诱导作用,对指导临床合理使用抗菌药物,控制该菌引起的感染具有重要的实际价值。
[1]Walsh TR,Hall L,Assinder SJ,et al.Sequence analysis of the L1 metallo-β-lactamase from Xanthomonas maltophilia[J].Biochim Biophys Acta,1994,1218(2):199-201.
[2]Walsh TR,MacGowan AP,Bennett PM.Sequence analysis and enzyme kinetics of the L2 serine β-lactamase from Stenotrophomonas maltophilia[J].Antimicrob Agents Chemother,1997,41(7):1460-1464.
[3]Lin CW,Hu RM,Huang SC,et al.Induction potential of clavulanic acid toward L1 and L2 beta-lactamases of Stenotrophomonas maltophilia [J].Eur J Clin Microbiol Infect Dis,2008,27(12):1273-1275.
[4]Avison MB,Higgins CS,Ford PJ,et al.Differential regulation of L1 and L2 β-lactamase expression in Stenotrophomonas maltophilia[J]. J Antimicrob Chemother,2002,49(2):387-389.
[5]Hu Rouh-Mei,Huang Kuang-Jay,Wu Lii-Tzu,et al. Induction of L1 and L2 beta-lactamases of Stenotrophomonas maltophilia[J].Antimicrob Agents Chemother,2008,52(3):1198-1200.
[6]彭凤英,贾 蓓,唐 君,等.哌拉西林/三唑巴坦(4∶1)治疗急性细菌性感染多中心、随机、双盲对照临床研究[J].中国抗生素杂志,2008,33(2):114-120.
(收稿:2013-04-09 修回:2013-05-08 编校:齐 彤)
Effects of different antimicrobial agents on transcription of L2β-lactamase gene in stenotrophomonas maltophilia
WANG Li-li,NIU Wen-kai,YIN Xiu-yun,SONG Shi-ping,SHANG Xue-yi,BAI Chang-qing,YUAN Xin,LI Yan.Deptment of Respiratory Diseases,The People′s Liberation Army 307 Hospital,Beijing 100071,China
LI Yan,E-mail:liyanmdhuxi@163.com
Objective:To research the induction effects of clinical commonly used antibiotics,imipenem and piperacillin/tazobactam,on L2 β-lactamase of stenotrophomonas maltophilia,and instruct the usage of clinical antimicrobial agents.Methods:Real-Time fluorescent quantified PCR was used to study the induction effects of different concentration of imipenem and piperacillin/ tazobactam to L2 β-lactamase,and determine L2 gene mRNA transcriptional changes.Results:Stronger induction on L2 β-lactamase showed in 1×MIC concentration of piperacillin/tazobactam,and weaker in any concentrations of imipenem.Conclusion:The two antibiotics had obvious induction effects on the production of L2 β-lactamase,especially enzyme inhibitors.So this kind of antibacterial agents should be limited to avoid more severe multidrug resistance in stenotrophomonas maltophilia.
stenotrophomonas maltophilia;β-lactamase;induction;multidrug resistance
R 378
A
2095-3496(2013)02-0090-04
首都医学发展科研基金资助(2009-3071)
100071 解放军307医院呼吸科(王丽丽,牛文凯,尚学义,柏长青,苑 鑫,李 艳);检验科(尹秀云,宋世平)
李 艳,E-mail:liyanmdhuxi@163.com

