吉西他滨联合培美曲塞不同序贯用药时序对HUT-78细胞增殖及凋亡的影响
韩正祥 赵琳玉 杜秀平
(徐州医学院附属医院肿瘤科,江苏 徐州 221002)
皮肤T细胞淋巴瘤(CTCL)属于外周 T细胞淋巴瘤(PTCL)中的一种,其发病率低,但恶性程度高,可累及淋巴结和内脏,预后较差。吉西他滨为核苷类药物,虽然2011年的美国国立综合癌症网络(NCCN)指南确立了吉西他滨在淋巴瘤等肿瘤治疗中的地位,但对提高PTCL的疗效仍有限。一项研究显示,吉西他滨治疗进展期CTCL患者,即使完全缓解率(CR)达到了22%,但中位缓解期只有10个月〔1〕。培美曲塞为多靶点叶酸拮抗剂,临床研究显示,培美曲塞对白血病细胞有细胞毒作用〔2〕,但对PTCL的研究较罕见。本研究旨在探讨吉西他滨与培美曲塞单药及不同联合用药时序方案对T淋巴细胞白血病细胞株HUT-78细胞增殖及凋亡的影响,为扩大CTCL临床治疗手段奠定实验基础。
1 材料与方法
1.1 实验材料 HUT-78,吉西他滨,培美曲塞,RPMI1640培养液,胎牛血清,胆囊收缩素八肽(CCK-8)试剂盒,膜联蛋白V-绿色荧光蛋白(AnnexinV-FITC)凋亡试剂盒。
1.2 细胞培养 将HUT-78常规培养在含有10%胎牛血清的1640培养基中,置于37℃,5%CO2饱和湿度的培养箱内培养。
1.3 绘制生长曲线 连续7 d计数并绘制HUT-78细胞生长曲线。取对数生长期HUT-78细胞,离心,用完全培养基稀释成2×105/ml的细胞悬液,按每孔1 ml接种于24孔板,分7组,每组3孔,1~7 d计数并绘制生长曲线。
1.4 分组 共分7组:单药吉西他滨组(G组)、单药培美曲塞组(P组)、吉西他滨、培美曲塞同时给药组(G+P组)、先用吉西他滨24 h后用培美曲塞组(GP组)、先用培美曲塞24 h后用吉西他滨组(PG组)、阴性对照组(D组)及空白对照组。
1.5 CCK-8检测增殖 取对数生长期的HUT-78细胞,离心,以RPMI1640培养基调整细胞悬液浓度为1.6×105/ml,100μl/孔,接种于96孔板,每组6个平行复孔。按实验设计进行实验,终止培养时,每孔加入10μl的CCK-8,继续培养3 h,酶标仪测定450 nm波长处每孔的光密度(OD)值。吉西他滨终浓度分别为:0.002、0.004、0.006、0.008、0.01 μg/ml;培美曲塞终浓度 分 别 为:0.137、0.412、1.235、3.703、11.111、33.333、100 μg/ml,分别作用细胞24、48、72 h后测定其抑制率,根据浓度反应曲线计算两药的IC50值。按照实验分组,应用两药的IC50浓度作用HUT-78细胞,作用72 h后测定其抑制率。
1.6 AnnexinV-FITC法检测凋亡 每孔接种4.8×105个细胞,按照实验分组,每组作用时间均为72 h,收集细胞,按照AnnexinV-FITC凋亡检测试剂盒说明书要求处理待测细胞,立即在流式细胞仪上检测,实验重复3次。
1.7 统计学方法 应用SPSS16.0统计软件进行分析,实验结果以表示,组间比较采用One-way ANOVA。P<0.05为差异有统计学意义。
2 结果
2.1 HUT-78细胞1~7 d的生长情况 于接种第2天进入对数生长期,第6天进入平台期。见图1。
2.2 吉西他滨单药抑制HUT-78细胞增殖的结果 吉西他滨在终浓度为0.002 ~0.01 μg/ml范围内,作用细胞24、48、72 h,抑制率具有浓度依赖性及时间依赖性,即随着药物浓度的增加及药物处理时间的延长,其抑制率逐渐增加。在24、48、72 h的时间点,其相邻浓度的抑制率之间差异有统计学意义(P<0.05)。在不同的浓度下,其相邻时间点的差异同样具有统计学意义(P<0.05)。48 h吉西他滨的IC50值为(7.50±0.71)×10-3μg/ml。见图 2。
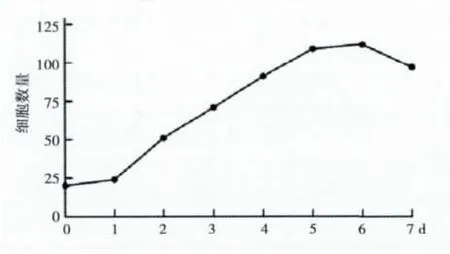
图1 HUT 78细胞的生长曲线

图2 吉西他滨对HUT 78细胞增殖的影响
2.3 培美曲塞单药抑制HUT-78细胞增殖的结果 培美曲塞在终浓度为0.137~100 μg/ml范围内,作用细胞24、48、72 h,抑制率具有浓度依赖性及时间依赖性,随着药物浓度的增加及药物处理时间的延长,其抑制率逐渐增加。在不同的时间点,100μg/ml及33.333μg/ml差异无统计学意义(P>0.05),其余浓度组间差异具有统计学意义(P<0.05)。在不同的浓度下,相邻时间点的差异具有统计学意义(P<0.05)。48 h培美曲塞的IC50值为(1.72±0.52)μg/ml。见图3。

图3 培美曲塞对HUT 78细胞增殖的影响
2.4 吉西他滨及培美曲塞不同处理组72 h对HUT-78细胞增殖的影响 以吉西他滨及培美曲塞IC50浓度作用于HUT-78细胞,单药 G组抑制率为(55.85±2.72)%,P组为(76.37±2.83)%,联合组中GHP组抑制率为(81.66±2.26)%,PG组为(86.53±2.43)%,均较单药组高,差异具有统计学意义(P<0.05),而PG组抑制率较G+P组高,差异具有统计学意义(P<0.05)。GP组为(61.56±2.75)%,比单药P组抑制率低,差异具有统计学意义(P<0.05)。
2.5 AV-PI双染法检测吉西他滨及培美曲塞不同处理组于72 h对HUT-78细胞凋亡的影响 对于HUT-78细胞,对照组凋亡率为(6.66±0.60)%,与各药物组相比,差异具有统计学意义(P<0.05)。其中PG组凋亡率最高,为(31.69±1.16)%,其次为G+P组,凋亡率为(29.41±0.89)%,P组为(25.63±0.77)%,GP组为(13.90±0.49)%,G组为(12.02±0.91)%。各处理组间差异具有统计学意义(P<0.05)。
3 讨论
CTCL是结外T细胞性非霍奇金淋巴瘤(NHL)的一类亚型,占NHL的1% ~2%。因其具有明显异质性,标准化治疗方案难以统一,早期以局部治疗为主,进展期则以全身治疗为主或推荐进行临床试验。早期患者的疗效较好,但是进展期患者疗效差,特别是ⅡB期以上的Sézary综合征(SS)和蕈样霉菌病(MF)患者,中位生存时间仅1~4年〔3〕。在CTCL系统化疗中,单药氟达拉滨、苯丁酸氮芥、甲氨蝶呤及联合用药如:环磷酰胺+阿霉素+长春新碱+泼尼松(CHOP)、环磷酰胺+长春新碱+泼尼松(COP)、依托泊苷+泼尼松+长春新碱+环磷酰胺+多柔比星(EPOCH)等方案,虽取得了一定的疗效,但肿瘤易耐药,缓解期短。吉西他滨是阿糖胞苷的衍生物,属于细胞周期特异性药物,目前广泛应用于PTCL的治疗,2008年NCCN指南将吉西他滨列入CTCL的二线系统治疗中,但总的无进展生存期或缓解期仍不理想〔1,4〕。
培美曲塞为多靶点叶酸拮抗剂,能抑制胸苷酸合成酶、二氢叶酸还原酶、甘氨酸核糖核苷甲酰基转移酶等叶酸依赖性酶,广泛应用于各种肿瘤的治疗中。Chun等〔5〕报道培美曲塞能抑制胰腺癌细胞的增殖,与吉西他滨联合具有协同作用,且先用培美曲塞后用吉西他滨对细胞增殖的抑制作用更强。Tonkinson等〔6〕报道吉西他滨与培美曲塞联合应用于人结肠癌细胞(HT29)存在时序效应,先用培美曲塞后用吉西他滨对细胞增殖的抑制作用更强。Li等〔7〕研究埃罗替尼与培美曲塞联合应用于非小细胞肺癌,先用埃罗替尼后用培美曲塞,对埃罗替尼敏感的细胞产生拮抗作用;同时给药或先用培美曲塞后用埃罗替尼,对埃罗替尼敏感或不敏感的细胞均产生协同作用。以上提示研究联合培美曲塞抗肿瘤治疗可能存在不同的时序效应。
本研究提示吉西他滨与培美曲塞单药以及不同时序联合应用均可抑制HUT-78增殖,促进凋亡,作用大小与应用时序有关,先用培美曲塞后再用吉西他滨的作用最强。
本实验由于载体动物体内实验的复杂性,与体外细胞学实验存在一定差异,而且CTCL是一组具有明显异质性的疾病,因此有必要此进一步探讨多种PTCL细胞株体内外实验研究,进一步明确药物作用机制、联合用药时序。
1 Marchi E,Alinari L,Tani M,et al.Gemcitabine as frontline treatment for cutaneous T-cell lymphoma:phase Ⅱ study of 32 patients〔J〕.Cancer,2005;104(11):2437-41.
2 Abdel-Karim I,Plunkett WK Jr,O'Brien S,et al.A phase I study of pemetrexed in patients with relapsed or refractory acute leukemia〔J〕.Invest New Drugs,2011;29(2):323-31.
3 Agar NS,Wedgeworth E,Crichton S,et al.Survival outcomes and prognostic factors in mycosis fungoides/Sézary syndrome:validation of the revised International Society for Cutaneous Lymphomas/European Organisation for Research and Treatment of Cancer staging proposal〔J〕.J Clin Oncol,2010;28(31):4730-9.
4 Kim JG,Sohn SK,Chae YS,et al.CHOP plus etoposide and gemcitabine(CHOP-EG)as front-line chemotherapy for patients with peripheral T cell lymphomas〔J〕.Cancer Chemother Pharmacol,2006;58(1):35-9.
5 Chun PY,Feng FY,Scheurer AM,et al.Synergistic effects of gemcitabine and gefitinib in the treatment of head and neck carcinoma〔J〕.Cancer Res,2006;66(2):981-8.
6 Tonkinson JL,Worzalla JF,Teng CH,et al.Cell cycle modulation by a multitargeted antifolate,LY231514,increases the cytotoxicity and antitumor activity of gemcitabine in HT29 colon carcinoma〔J〕.Cancer Res,1999;59(15):3671-6.
7 Li T,Ling YH,Goldman ID,et al.Schedule-dependent cytotoxic synergism of pemetrexed and erlotinib in human non-small cell lung cancer cells〔J〕.Clin Cancer Res,2007;13(11):3413-22.

