基于UPLC-TOF-MS分析人参麦冬配伍后皂苷类成分的变化
周思思,马增春,梁乾德,汤响林,王宇光,谭洪玲,肖成荣,张伯礼,高 月
(1.军事医学科学院放射与辐射医学研究所,北京100850;2.安徽医科大学研究生学院,安徽 合肥 230032;3.天津中医药大学,天津 300193)
中医临床用药多采用复方形式,方剂是在辨证审因决定治法之后,选择合适的药物,酌定用量,按照组方结构的要求,妥善配伍而成的。“药有个性之专长,方有合群之妙用”。临床单用人参,可直接发挥补气健脾、补气益肺、补气养心、补气生津、大补元气等功效,通过与其他药物相配,能使某一方面的直接功效更为突出[1]。人参与麦冬相配,人参乃补气圣药,兼有生津之功;麦冬乃滋阴要药,亦有扶正之力[2]。合用则补气养阴之功大增。人参与麦冬相配亦有气充津足脉复之效,故《景岳全书》言麦冬复脉须仗人参。
人参皂苷是人参所含的最为重要的一类生理活性物质,约占人参组成的3%[3]。目前从人参植物中至少分离提取出80多种人参皂苷单体,按硅胶薄层色谱Rf值的大小顺序,由小到大命名为 Ro,Ra,Rb1,Rb2,Rb3,Rc,Rd,Re,Rf,Rgl,Rg2,Rg3,Rh1,Rh2等。人参皂苷按苷元的结构可分为3类:齐墩果酸型(如人参皂苷Ro),人参二醇型(如人参皂苷Rb1),人参三醇型(如人参皂苷 Rg1)[4-6]。人参含有多种化学成分,且其作用各不相同,甚至在有些方面截然相反。有些成分的作用是专一的,其它成分则不产生该作用[7-8]。本实验采用超高效液相色谱-飞行时间质谱(UPLC-TOF-MS)技术,结合主成分分析(principal component analysis,PCA)和正交偏最小二乘判别分析(orthogonal partial least squared discriminant analysis,OPLS-DA)进行数据分析,探讨人参麦冬配伍后对人参皂苷的影响,试图从人参皂苷成分变化的角度阐述二者配伍应用的科学内涵。
1 实验部分
1.1 试剂与仪器
甲酸(分析纯):国药集团化学试剂有限公司产品;乙腈(色谱纯):美国Fisher Scientific公司产品;麦冬(批号20110917,产地浙江慈溪)、人参(批号20110901,产地吉林)、标准品人参皂苷Rb2,Rc,Rd (批 号 20110624、20110527、20110505):购自中国药品生物制品检定所。
Acquity UPLC-Synapt MS色谱-质谱联用仪:美国 Waters公司产品,配有 MassLynx V 4.1质谱工作站,Acquity HSS T3色谱柱(100 mm×2.1mm×1.8μm),色谱柱冷冻离心机(Heraeus Labofuge 400R)。
1.2 样品制备
按V(人参)∶V(麦冬)=1∶1比例称重混合,加入8倍量的水,浸泡30min后煎煮,煮沸60min,提取煎液,3层纱布过滤;第二次煎煮加入5倍量水,煎煮30min后,纱布过滤,提取煎液,合并两次滤液,即为人参麦冬合煎液;先制备人参单煎液和麦冬单煎液,制备方法同上,将两煎液按1∶1混合,即为人参麦冬合并液。将制备的煎液静置,以13000r/min离心10min,取上清液,0.22μm微孔滤膜过滤即为样品,重复以上所有步骤8次,将所有样品4℃保存,待测。
1.3 标准品溶液的制备
称取1mg人参皂苷Rb1于10mL V(乙腈)∶V(水)=1∶1的溶液里,即为人参皂苷Rb1的标准品溶液,同法制备人参皂苷Rc和人参皂苷Rd的标准品溶液。
1.4 超高效液相色谱条件
采用Acquity BEH C18色谱柱(100mm×2.1mm×1.7μm);柱 温 45 ℃,流 速 0.45 mL/min,进样量5μL;流动相:A为0.1%甲酸水溶液,B为乙腈溶液;梯度洗脱(0→2min:25%B;2→3min:25%→30%B;3→17min:30%→35%B;17→19min:35%→25%B;19→20min:25%B)[9-10]。
1.5 质谱条件
采用电喷雾电离离子源(ESI),正离子V模式检测,检测范围m/z 70~1000,毛细管电压2.9kV,锥孔电压40V,离子源温度100℃,脱溶剂温度450℃,脱溶剂气体流速900L/h,锥孔气 流 量 50L/h,质 量 校 正 质 荷 比 m/z 556.2771;负离子V模式检测,检测范围m/z 70~1500,毛细管电压3kV,锥孔电压40V,离子源温度100℃,脱溶剂温度450℃,脱溶剂气体流速900L/h,锥孔气流量50L/h,质量校正质荷比 m/z554.2615[11-12]。
1.6 数据分析
质谱数据采用 MassLynx 4.1软件进行峰提取、峰对齐及归一化等处理,找出人参与麦冬合煎液与合并液中20种人参皂苷。首先利用MassLynx V4.1质谱工作站中的PCA功能,对人参麦冬合煎液与合并液中的所有分子离子峰进行比较,然后利用pareto算法更精确计算出两组之间差异显著的分子离子峰,通过PLS-DA计算分析,然后通过散点图S-Plot找出人参麦冬药对配伍后变化显著的8种人参皂苷,结合文献和本实验室MassLynx工作站Exact Mass Search(EMS)软件质谱数据库检索,对潜在的化学标记物进行鉴定[13-14]。
2 结果与讨论
2.1 UPLC-TOF-MS结果
比较人参麦冬合并液、人参麦冬合煎液的负离子流图,示于图1,即人参与麦冬药对合并液与合煎液负离子模式下的离子流图。对应图1中1~20号峰,根据本体结构的不同,其中原人参二醇型人参皂苷包括9,10,11,13,14,15,16,17,18,19号峰,分别为人参皂苷Ra2,人参皂苷Rb1,丙二酸甲酰基人参皂苷Rb1,人参皂苷Rc,人参皂苷Ra1,丙二酸甲酰基人参皂苷Rc,人参皂苷Rb2,人参皂苷Rb3,丙二酸甲酰基人参皂苷Rb2,人参皂苷Rd。原人参三醇型人参皂苷包括1,3,4,5,6,7,8号峰,分别为20-葡萄糖基人参皂苷Rf,人参皂苷Rg1,人参皂苷Re,人参皂苷Rf,人参皂苷F3,20(R)-人参皂苷 Rg2,人参皂苷F2。齐墩果型人参皂苷为12峰,为人参皂苷Ro,另外还有2号峰三七皂苷R1。
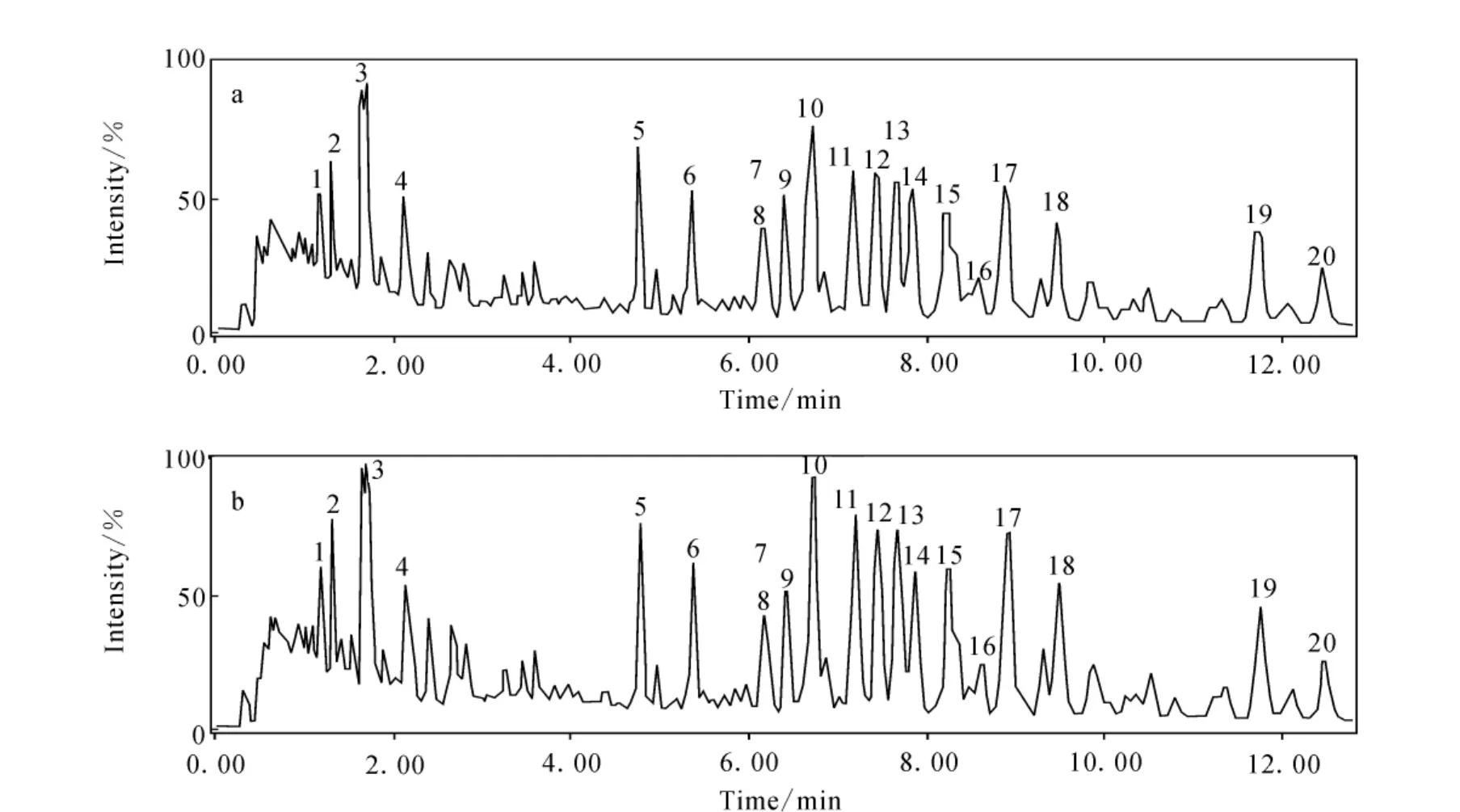
图1 人参与麦冬药对合并液(a)与合煎液(b)负离子模式下的离子流图Fig.1 The chromatograms of mixed-decoction(a)and co-decoction(b)of giseng and ophiopogonis in negative ion mode
2.2 人参皂苷同分异构体的定性结果
人参皂苷根据主体结构主要分为3种:二醇型人参皂苷、三醇型人参皂苷和齐墩果型人参皂苷,人参皂苷的结构决定了人参皂苷能形成多种同分异构体,示于图2。比如m/z 1077.5846的人参皂苷有3个同分异构体,分别为人参皂苷Rb2、Rb3、Rc;m/z 991.5478的同分异构体有人参皂苷Re、Rd;m/z 1209.5904的同分异构体有人参皂苷Ra1、Ra2。
如图3所示,进行人参皂苷Rb2、Rc的标准品确认,发现人参皂苷Rb2在8.93min出峰,人参皂苷Rc在7.66min出峰,且标准品的测定精确度均小于百万分之五,因此另一峰即为人参皂苷Rb3,可以确定此3种人参皂苷的出峰顺序是Rc>Rb2>Rb3。同样对m/z 991.5478的同分异构体人参皂苷Re、Rd进行标准品的确认,确定两种人参皂苷的出峰顺序是Re>Rd。对于m/z1209.5904的同分异构体人参皂苷Ra1、Ra2,查 阅 文 献[4-5],确 定 其 出 峰 顺 序 为Ra2>Ra1。
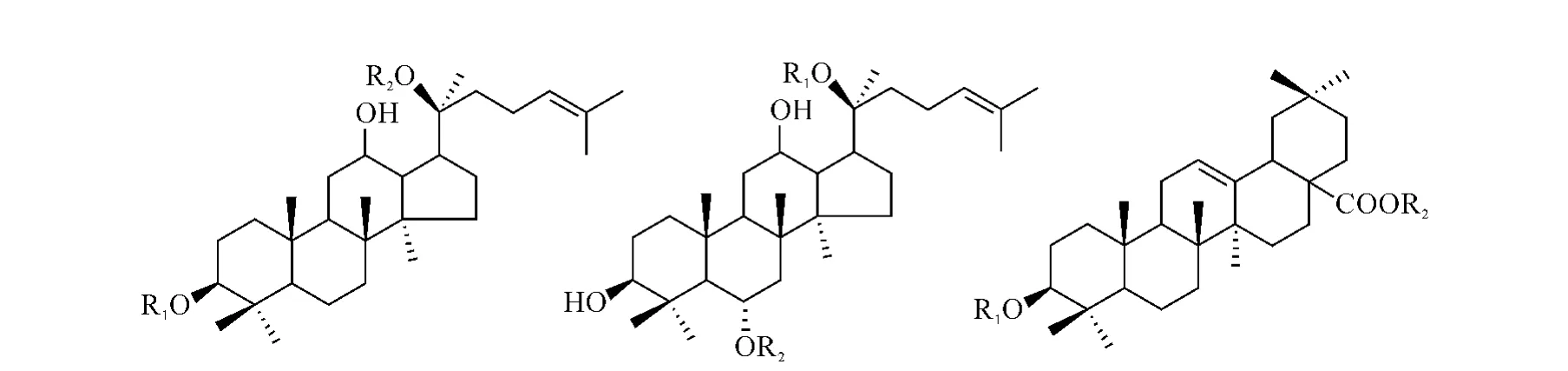
图2 二醇型人参皂苷,三醇型人参皂苷和齐墩果型人参皂苷的结构图Fig.2 The structure of protopanaxadiol type ginsenoside,protopanaxatriol type ginsenoside and oleanolic acid ginsenoside
质谱数据采用MassLynx 4.1软件进行峰提取、峰对齐及归一化等处理,结合标准品确认与本实验室的MassLynx工作站Exact Mass Search(EMS)软件质谱数据库找出人参与麦冬合煎与合并液中20种人参皂苷。结合图1,整理的结果列于表1,20种人参皂苷的质量精确度都小于4×10-6。与本实验所设置的流动相梯度相符,极性大的先出峰,在8号峰之前的化合物基本是原三醇型人参皂苷,相反之后的峰基本是原二醇型人参皂苷。
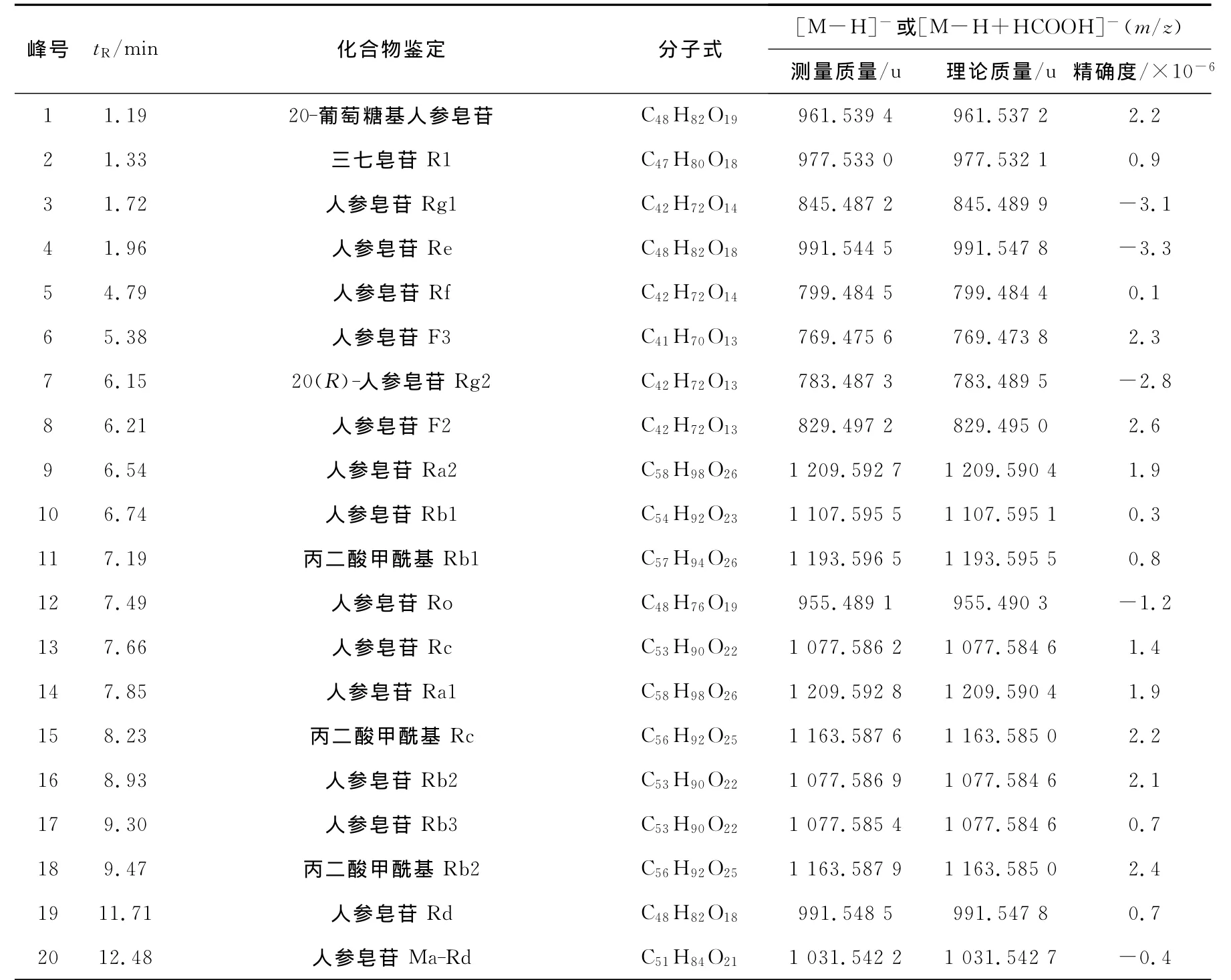
表1 人参麦冬药对合并液与合煎液的皂苷类成分的鉴别Table 1 Ginsenoside identified from decoctions of ginseng and radix ophiopogonis
2.3 MarkerLynx统计结果
MarkerLynx 4.1统计分析结果示于图4~6。由图4即主成分分析图PCA可见,两组样品能够得到明显的区分,也就是说两组样品具有差异明显的标志物。进一步由图5人参麦冬药对合并液与合煎液负离子模式下正交偏最小二乘法差异成分的S曲线可见,合煎液与合并液之间差异显著的分子离子峰分布在S曲线的两端,S曲线的左下角代表了合煎液与合并液相比差异显著的分子离子峰,S曲线的右下角代表了合并液与合煎液相比差异显著的分子离子峰,而差异的分子离子峰代表了特征性的化学成分,即两组样品在化学成分上的差异性。因此,a、b、c、d点代表了合煎液与合并液相比差异显著的化学成分,而e、f、g、h点代表了合并液与合煎液相比差异显著的化学成分。
人参麦冬药对合并液与合煎液负离子模式下差异成分S曲线中有代表性的化合物示于图6。在合煎液中,人参皂苷Rb3、丙二酸甲酰基人参皂苷Rb2、丙二酸甲酰基人参皂苷Rc、人参皂苷Rf含量增高;在合并液中,人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1、丙二酸甲酰基人参皂苷Rb1含量增高。
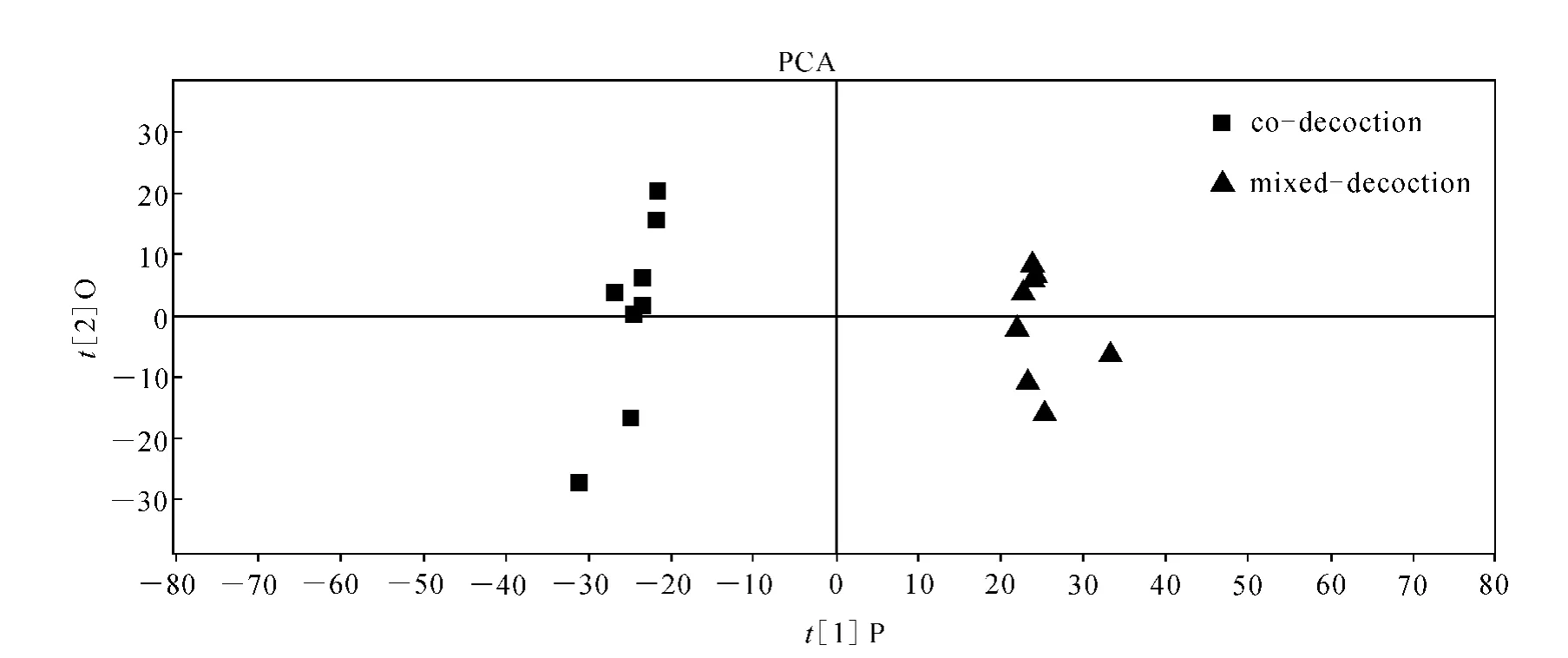
图4 人参麦冬药对合并液与合煎液负离子模式下主成分分析图Fig.4 PCA/Scores plot of co-decoction and mixed-decoction of ginseng and radix ophiopogonis obtained using Pareto scaling with mean centering
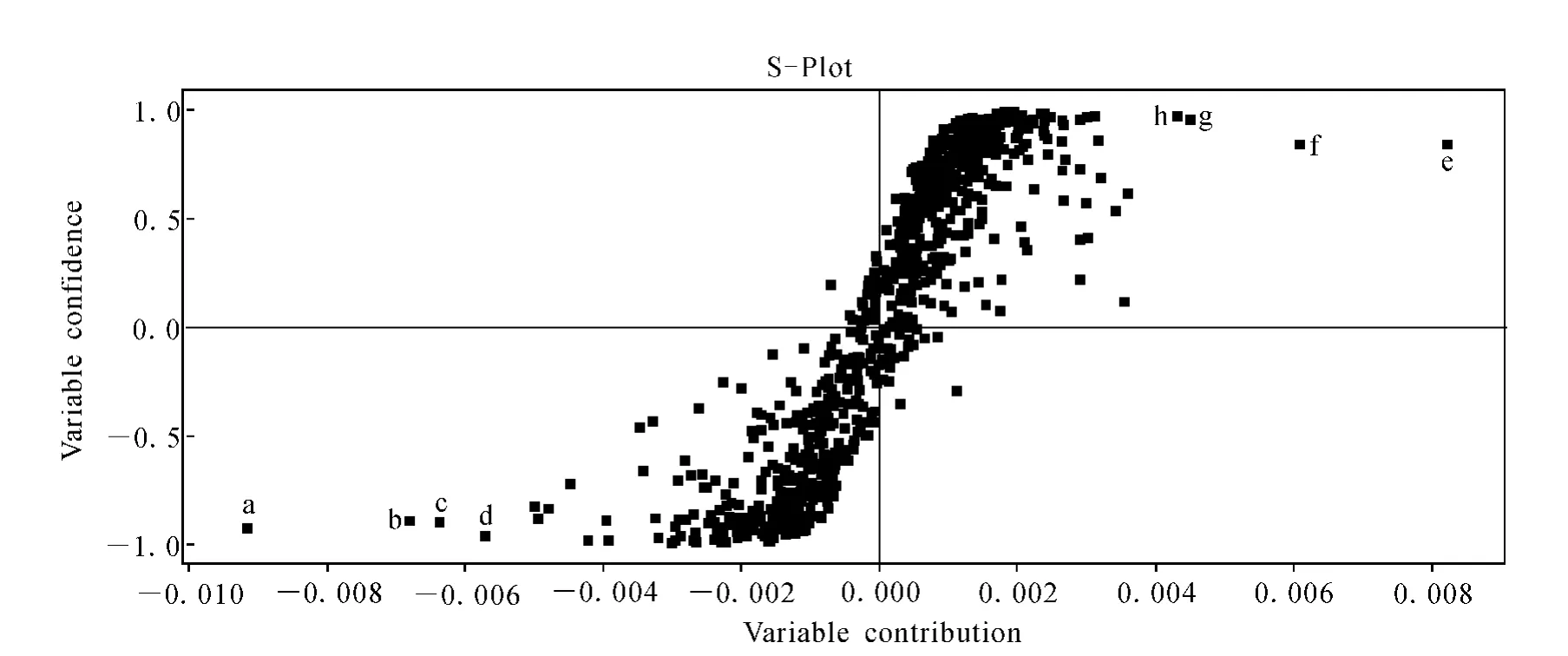
图5 人参麦冬药对合并液与合煎液负离子模式下正交偏最小二乘法差异成分的S曲线Fig.5 OPLS-DA/S-Plot of co-decoction and mixed-decoction of ginseng and radix ophiopogonis obtained using Pareto scaling with mean centering
3 结论
药物的功用各有所长,也各有所短,只有通过合理的组织,使各具特性的群药组合成一个新的有机整体,从而符合辨证论治的要求。人参皂苷是人参所含的最为重要的一类生理活性物质,约占人参组成的3%。人参皂苷按苷元的结构可分为3类:齐墩果酸型,主要有抗炎、抗血小板作用[15];原人参二醇型,主要作用表现为中枢神经抑制和改善心肌缺血再灌注损伤等[16];人参三醇型,表现为中枢神经兴奋作用[17]。对9种人参皂苷抗大鼠心律失常活性研究表明,其活性强度顺序为:人参三醇型>齐墩果酸型>人参二醇型[18]。人参中三醇型皂苷表现较强的细胞毒性作用[19-20]。
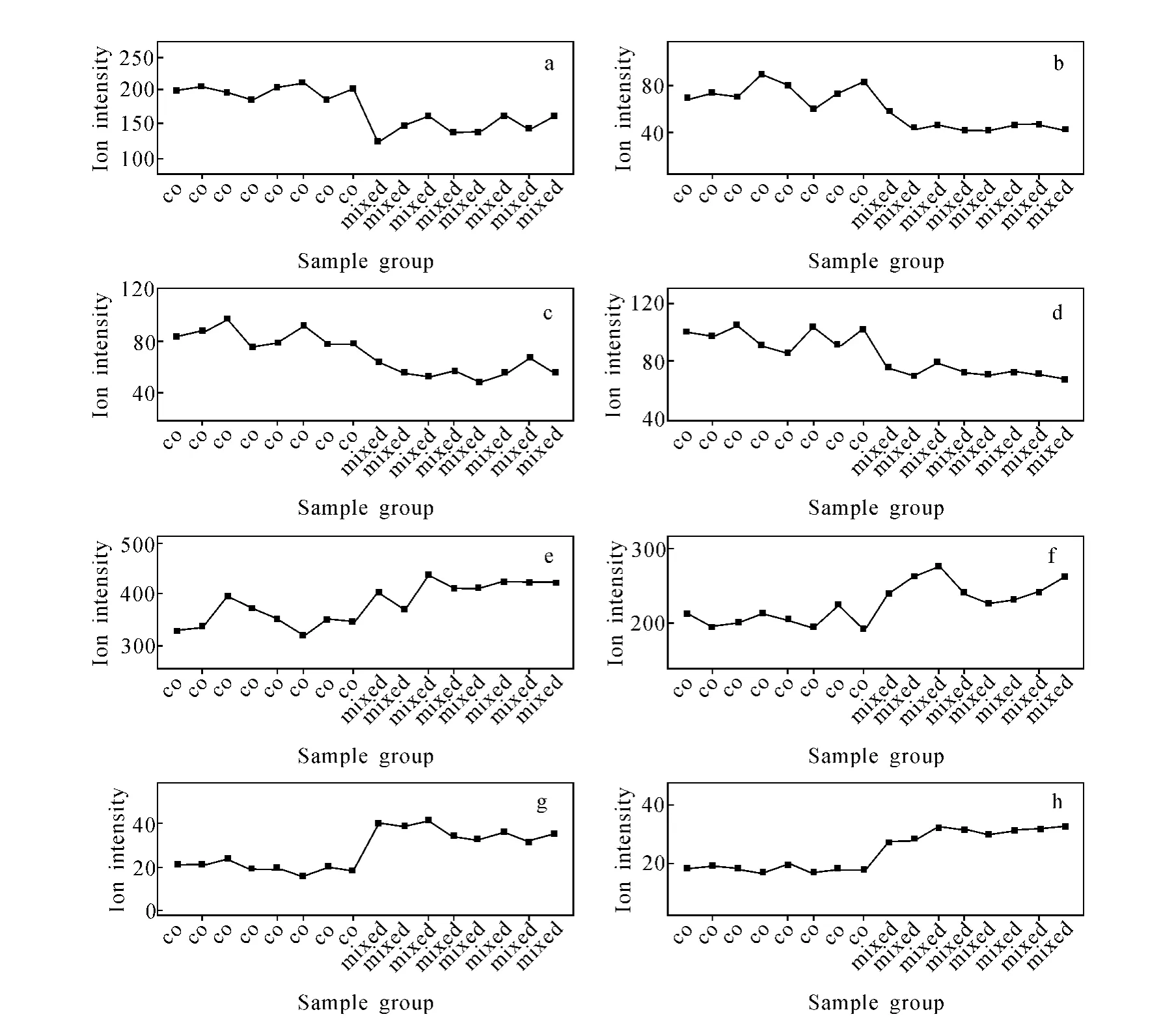
图6 人参麦冬药对合并液与合煎液负离子模式下差异成分S曲线中有代表性的化合物Fig.6 Selected ion intensity trend plots of mixed-decoction and co-decoction of ginseng and radix ophiopogonis obtained using Pareto scaling with mean centering monitored in negative ion mode
采用UPLC-TOF-MS技术获得人参麦冬药对合并液与合煎液的指纹图谱,采集含有精确质量测定的原始数据,当将这些数据作为精确质量保留时间数据对转成二维矩阵形式,采用多元数学统计分析方法即可对这套数据进行分析。结果可以导回Markerlynx的结果列表中,再通过精确分子质量与保留时间在数据库中检索,确定合并液与合煎液的差异成分。研究结果表明:在合煎液中,人参皂苷Rb3、丙二酸甲酰基人参皂苷Rb2、丙二酸甲酰基人参皂苷Rc、人参皂苷Rf含量增高;而人参皂苷Rg1、人参皂苷Re、人参皂苷Rb1、丙二酸甲酰基人参皂苷Rb1含量减少。这说明人参与麦冬配伍后,人参三醇型人参皂苷Rg1、人参皂苷Re的含量降低,人参二醇型人参皂苷Rb3的含量升高,即人参配伍麦冬可起到增效减毒的作用。
[1]QI L W,WANG C Z,YUAN C S.Ginsenosides from American ginseng:Chemical and pharmacological diversity[J].Phytochemistry,2011,72(8):689-699.
[2]LEE J,LEE E,KIM D,et al.Studies on absorption,distribution and metabolism of ginseng in humans after oral administration[J].Ethnopharmacol,2009,122(1):143-148.
[3]LV J M,YAO Q,CHEN C.Ginseng compounds:An update on their molecular mechanisms and medical applications[J].Curr Vasc Pharmacol,2009,7(3):293-302.
[4]FENG L,WANG L,HU C,et al.Pharmacokinetics,tissue distribution,metabolism,and excretion of ginsenoside Rg1in rats[J].Arch Pharm Res,2010,33(12):1975-1984.
[5]ZHAO Q,ZHENG X,JIANG J,et al.Determination of ginsenoside Rg3in human plasma and urine by high performance liquid chromatographytandem mass spectrometry[J].J Chromatogr B Analyt Technol Biomed Life Sci,2010,878(24):2266-2273.
[6]JIN H,SEO J H,UHM Y K,et al.Pharmacokinetic comparison of ginsenoside metabolite IH-901 from fermented and non-fermented ginseng in healthy Korean volunteers[J].Ethnopharmacol,2012,139(2):664-667.
[7]YUE P Y,MAK N K,CHENG Y K,et al.Pharmacogenomics and the Yin/Yang actions of ginseng:anti-tumor,angiomodulating and steroid-like activities of ginsenosides[J].Chin Med,2007,15(2):6-10.
[8]LIU H,YANG J,DU F,et al.Absorption and disposition of ginsenosides after oral administration of Panax notoginseng extract to rats[J].Drug Metab Dispos,2009,37(12):2290-2298.
[9]LI L,LUO G A,LIANG Q L,et al.Rapid qualitative and quantitative analyses of Asian ginseng in adulterated American ginseng preparations by UPLC/Q-TOF-MS[J].J Pharm Biomed Anal,2010,52(1):66-72.
[10]马增春,周思思,梁乾德,等.基于UPLC/QTOF-MS分析人参附子药对配伍的化学成分变化[J].药学学报,2011,46(12):1488-1492.
[11]LI S L,LAI S F,SONG J Z,et al.Decocting-induced chemical transformations and global quality of Du-Shen-Tang,the decoction of ginseng evaluated by UPLC-Q-TOF-MS/MS based chemical profiling approach[J].J Pharm Biomed Anal,2010,53(4):946-957.
[12]周思思,马增春,梁乾德,等.基于UPLC/Q-TOF-MS分析附子半夏配伍相反的物质基础[J].化学学报,2012,70(3):284-290.
[13]WANG C Z,KAREN E,KIM,et al.Ultra-performance liquid chromatography and time-offlight mass spectrometry analysis of ginsenoside metabolites in human plasma[J].Am J Chin Med,2011,39(6):1161-1171.
[14]杨 亮,王宇光,梁乾德,等.基于UPLC/QTOF-MS不同比例人参配伍藜芦增毒的物质基础及动物毒性关联性研究[J].质谱学报,2012,33(5):223-230.
[15]KITTS D,HU C.Efficacy and safety of ginseng[J].Public Health Nutr,2000,3 (4A):473-485.
[16]KARMAZYN M,MOEY M,GAN X T.Therapeutic potential of ginseng in the management of cardiovascular disorders[J].Drugs,2011,71(15):1989-2008.
[17]JIA Y,ZHANG S,HUANG F,et al.Could ginseng-based medicines be better than nitrates in treating ischemic heart disease?A systematic review and meta-analysis of randomized controlled trials[J].Complement Ther Med,2012,20(3):155-166.
[18]KARMAZYN M,MOEY M,GAN X T.Therapeutic potential of ginseng in the management of cardiovascular disorders[J].Drugs,2011,71(15):1989-2008.
[19]KITTS D D,POPOVICH D G,HU C.Characterizing the mechanism for ginsenoside-induced cytotoxicity in cultured leukemia(THP-1)cells[J].Can J Physiol Pharmacol,2007,85(11):1173-1183.
[20]HUANG J,TANG X H,IKEJIMA T,et al.A new triterpenoid from Panax ginseng exhibits cytotoxicity through p53and the caspase signaling pathway in the HepG2cell line[J].Arch Pharm Res,2008,31(3):323-329.

