高效液相色谱-串联质谱法检测动物源食品中硝呋索尔代谢物残留
黄 帆,王传现,张 缙,盛永刚,王 敏,韩 丽,李晓虹,徐敦明,刘 茜,丁卓平
(1.上海海洋大学食品学院,上海 201306;2.上海出入境检验检疫局,上海 200135;3.厦门出入境检验检疫局,福建 厦门 361026)
硝基呋喃类抗生素是一类人工合成的具有5-硝基结构的广谱抗菌药物,包括众所周知的呋喃唑酮、呋喃它酮、呋喃西林和呋喃妥因,该类药物也是一类具有潜在致癌和诱导有机体产生突变的物质。硝基呋喃类药物在动物体内代谢速度快,半衰期短,一般为几个小时,因此,对动物组织中硝基呋喃母体药物的准确检测是比较困难的,对硝基呋喃类药物的残留量测定也是不准确的。但通过对硝基呋喃类药物进行同位素标记的动物实验发现,其代谢产物能够与组织蛋白质形成稳定的蛋白质结合物,在动物组织体内残留较长时间,并通过水解从蛋白质中释放出来。因此,硝基呋喃类药物的真实残留状况可利用检测其代谢物体现[1-3]。
欧盟于1995年发布指令要求此类药物不再允许使用在食用动物身上。硝呋索尔(nifursol)也属于硝基呋喃类药物(nitrofurans),被欧盟1756/2002/EC禁用。但是,无论在科研还是标准制定方面,国内尚未有测定硝呋索尔代谢物残留的文献报道,因而加快对硝呋索尔代谢物残留的检测研究,对保证食品安全具有十分重要的意义。目前,国内外关于硝基呋喃类药物及其代谢产物的检测方法主要有分光光度法[4]、高效液相色 谱 法[5-8]、液 质 联 用 分 析 法[9-10]和 免 疫 分 析法[11-12]等。张会彩 等[8]利 用 高 效 液 相 色 谱 法 检测饲料中含硝呋索尔在内的7种硝基呋喃类药物,该法对饲料中7种药物的检测限均小于32 μg/kg。国外学者对硝呋索尔代谢物残留的研究多采用液质联用分析法,如Verdon等[13]建立了同时检测5种硝基呋喃代谢物的多残留监控的液质联用法;Kaufmann等[14]建立了包括硝呋索尔在内的5种硝基呋喃药物的液相色谱-串联质谱法;Zuidema等[2]利用动物实验研究了硝呋索尔在肉鸡中的代谢及降解,并建立了液相色谱-串联质谱法对肉鸡的不同部位残留的硝呋索尔及其代谢产物3,5-二硝基水杨酸肼(DNSH)检测。
质谱检测器具有定性定量准确、检测限低、灵敏度高等优点,本研究采用液相色谱-串联质谱法检测肠衣、鱼、虾等基质中硝呋索尔代谢物的残留量。
1 实验部分
1.1 主要仪器与装置
LC-20ADXR高效液相色谱仪:日本Shimadzu公司产品;API 4000三重四极杆串联质谱仪:美国AB公司产品,配有电喷雾离子源;Allegra X-22R高速离心机:美国Beckman公司产品;N-EVAP111型氮吹浓缩仪:美国Organomatian公司产品。
1.2 主要材料与试剂
甲醇、乙酸乙酯、正己烷、乙腈、甲酸(色谱纯):美国J.T.Baker公司产品;二甲亚砜(色谱纯)、2-硝基苯甲醛(2-NBA)(纯度>98%):美国Sigma公司产品;实验用水为 Milli-Q超纯水;3,5-二硝基水杨酸肼(纯度>99%):俄罗斯vitas-M公司产品;硝呋奇特内标物标准品(纯度>99%):德国 Witega公司产品。储备液:甲醇配制,浓度为0.1g/L,贮存在0~4℃冰箱中,根据需要用甲醇稀释至适当浓度的标准工作液;衍生剂:称取75.5mg 2-硝基苯甲醛,并溶解于10mL二甲亚砜中,现配现用。
1.3 实验条件
1.3.1 色谱条件 Thermo Aquasil C18色谱柱(150mm×4.6mm×3.0μm);流动相 A为含1‰甲酸的乙腈、B为含1‰甲酸的5mmol/L乙酸铵溶液;流速0.6mL/min;进样体积20μL;柱温:常温。梯度洗脱程序列于表1。

表1 梯度洗脱程序Table 1 Program of gradient elution
1.3.2 质谱条件 电喷雾离子化负离子模式(ESI-);电喷雾电压(IS):-4500V;雾化气压力(GS1):483kPa;气 帘 气 压 力 (CUR):241 kPa;辅助气压力(GS2):414kPa;离子源温度:550℃。定性离子对、定量离子对和去簇电压(DP),聚焦电压(FP),碰撞气能量(CE)及碰撞室出口电压(CXP),列于表2。
1.4 样品前处理
1.4.1 样品的水解及衍生化 称取1.00g试样于50mL塑料离心管中,依次加入10mL水,0.5mL盐酸溶液和500μL衍生剂溶液,混匀后置于37℃恒温振荡器中保持16h。
1.4.2 样品的提取和净化 将上述衍生好的溶液取出后,加入5mL 0.1mol/L磷酸氢二钠溶液,用300μL 1.0mol/L氢氧化钠溶液调节pH 7.0~7.5,再在该中性溶液中加入2.0g中性氧化铝,摇匀1min,以4000r/min离心3min,上层清液转移至装有16mL乙酸乙酯的塑料离心管中,充分混匀5min后,以4000r/min离心3min,将上清液转移至20mL氮吹管中,再加入10mL乙酸乙酯重复提取,经上述步骤后,合并提取液,提取液在40℃下氮气吹干;吹干后,在氮吹管中加入1mL V(乙腈)∶V(1‰甲酸水)=2∶8的溶液定容,2mL乙腈饱和的正己烷去脂,充分混匀后,下层溶液转移至2mL离心管中,以16000r/min离心5min,上清液过0.2μm滤膜后,转移至进样小瓶中,待测。
2 结果与讨论
2.1 前处理条件的优化
与其他4种硝基呋喃类代谢物3-氨基-2-恶唑烷酮(AOZ)、3-氨基-5-吗啉甲基-2-恶唑烷酮(AMOZ)、1-氨 基 乙 内 酰 脲 (AHD)、氨 基 脲(SEM)一样,DNSH以蛋白结合物的形态存在于样品组织中,在适当的酸性条件下释放出来。同时DNSH的分子质量较小,不易产生具有典型特征的离子碎片,检测灵敏度低,因此,需要对其进行衍生化。目前对硝基呋喃类代谢物采用最多的衍生化试剂是2-硝基苯甲醛(2-NBA),故本研究选用2-NBA作为衍生化试剂,对水解游离出来DNSH的自由氨基进行衍生化,形成的衍生化产物具有更好的质谱特性,其衍生化反应示于图1。参照文献[15]方法,对食品中的DNSH进行了同步水解和衍生化。2-NBA配制的溶剂一般为二甲亚砜和甲醇,本实验对两种溶剂进行比较,结果发现,用甲醇配制的衍生剂溶液,其衍生物质谱信号强度较二甲亚砜低,且背景干扰相对大,因此,选择二甲亚砜配制2-NBA衍生化试剂。
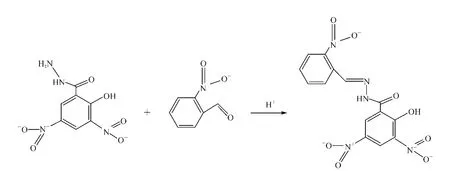
图1 DNSH与2-硝基苯甲醛的衍生化反应Fig.1 Derivatizing reaction leading to the nitrophenyl derivative of DNSH
样品净化的方法主要有液液萃取[16-17]和固相萃取法[18-19]。固相萃取法操作较为繁琐,成本较高,因此本实验采用乙酸乙酯液液萃取。实验发现,乙酸乙酯液液萃取法适用于大多数的复合型基质,其操作较为简单,且成本低廉。为了防止乳化,可在提取之前离心后除去固体样品,利于净化。对于虾仁、鱼等含脂量高的样品,也可通过提高离心转速,降低乳化,提高回收率[20]。由于乙酸乙酯对水中脂类物质也有一定的提取,在浓缩定容后,采用正己烷去脂,高速离心法,可有效去除杂质。
同时,还考察了中性氧化铝的加入顺序对提取和净化效果的影响。加入中性氧化铝能吸附样品中的脂肪,有利于净化步骤提取更完全,其一是将中性氧化铝加入到调好pH值的溶液中;其二是为了防止样品中的脂肪对衍生化效率有影响,中性氧化铝在样品进行衍生化时添加。结果发现,在衍生时加入中性氧化铝,对衍生有一定的干扰,使衍生不完全,结果的重现性差,并且对水解时要求的酸性环境有影响。而第一种方式所得到的水溶液较为澄清,去脂效果明显。因此,选择在溶液调完pH值之后加入中性氧化铝。
在进行样品提取时,衍生液的pH值对萃取效率有很大的影响。在阴性样品水解衍生后,加入5mL 0.1mol/L磷酸氢二钠溶液,用1.0 mol/L氢氧化钠溶液调至不同pH值后测定。结果发现,pH值为7.0~7.5时,DNSH 的衍生产物测定响应值最高。
2.2 质谱条件的优化
实验采用10mg/L DNSH以及水杨酰肼(SAH)标准溶液进行水解和衍生化处理,分别得到NPDNSH和NPSAH标准衍生溶液。利用针泵分别以流动注射的方式在电喷雾正/负模式下进行母离子全扫描,确定其分子离子,调节去簇电压、射入电压,使其丰度最大,进行二级质谱分析,固定去簇电压、射入电压,调节碰撞气能量和碰撞室出口电压,选择二级质谱中没有干扰、信号相对较强的3个特征碎片离子,与其母离子组成3对离子对,对该药物进行定性和定量分析,NPDNSH的二级质谱图示于图2。以多反应监测模式优化质谱参数,优化后的质谱条件列于表2。

图2 NPDNSH的二级质谱图Fig.2 MS/MS spectra of NPDNSH
2.3 基质效应及内标物的选择
采用液相色谱-串联质谱法进行食品中药物残留检测时,由于基质效应的影响,导致目标化合物发生离子增强或抑制作用,通过添加内标物和用空白样品提取液稀释配制标准工作溶液两种方式相结合,可以减弱离子化时的基质效应,减少定量结果的偏差。在对DNSH进行测定时发现,信号强度变化大,分析的准确度低。因此,在本实验中,DNSH的内标选择用DNSH的类似物SAH代替,SAH是由另一种硝基呋喃类药物硝呋奇特经过水解获得,所得离子信号能得到满意的分析结果。

表2 DNSH和SAH的衍生物定性、定量离子对以及质谱相关参数表Table 2 Multiple reaction monitoring transition and mass spectrometry parameters of derivative compounds
2.4 线性范围及检出限
在优化后的实验条件下,以空白基质溶液配制0.5、1.0、2.0、5.0、10.0μg/L的系列混合物标准溶液进行测定,以内标法定量(50μg/L内标),以分析物与内标物峰面积比值(y)对质量浓度(x)进行线性回归。获得的线性方程为y=0.0613x-0.007,相关系数(R2)为0.9995。结果表明,在0.5~10μg/L范围内,定量离子的响应峰面积和样品质量浓度之间有很好的线性关系。以3倍信噪比(S/N)计算DNSH的检出限(LOD)为0.5μg/kg,以10倍信噪比(S/N)计算DNSH的定量限(LOQ)为1.0μg/kg。
2.5 添加回收实验
以不含DNSH残留的虾仁、猪肉、肠衣、鱼为空白样品,按前述方法进行添加回收和精密度实验。在0.5、1.0、2.0、4.0μg/kg的添加水平下,DNSH 的回收率在 63.4% ~109.5%(n=6)之间,相对标准偏差为2.0%~11.9%(n=6)。实验结果列于表3。
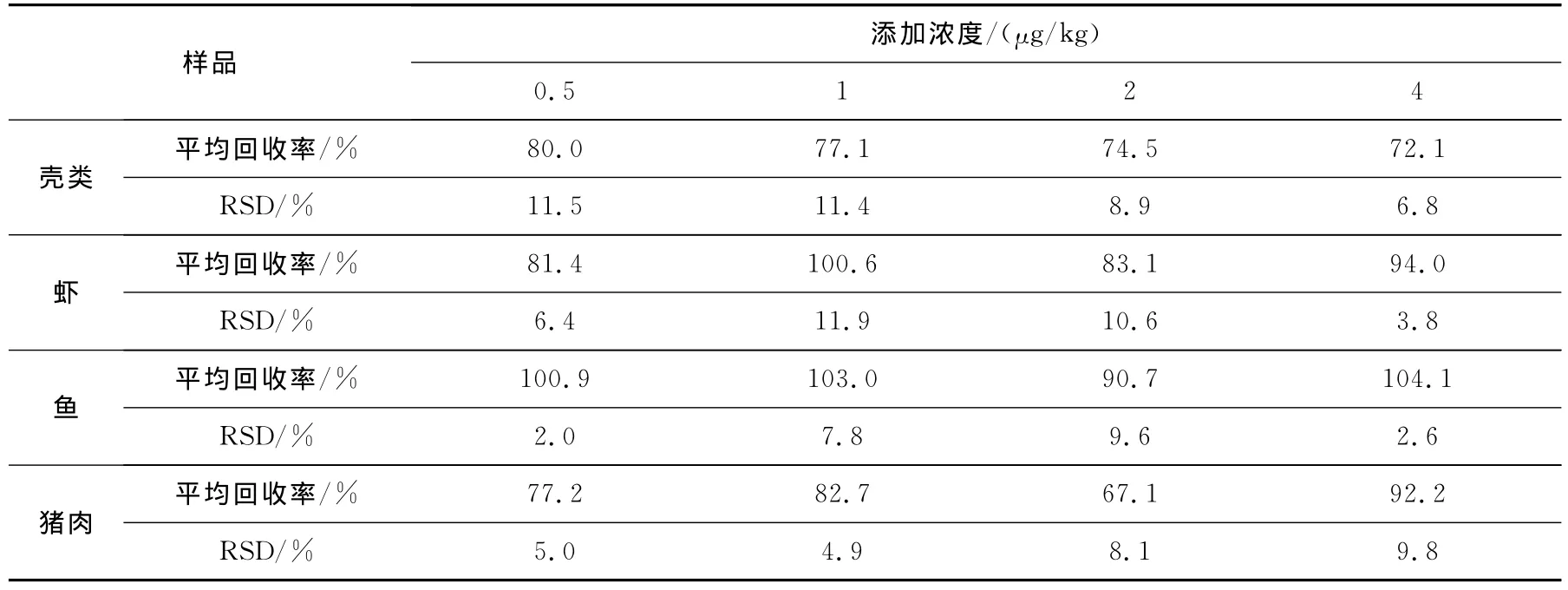
表3 不同添加水平下,4种动物组织中DNSH的回收率及相对标准偏差(n=6)Table 3 Recoveries and relative standard deviations of DNSH at four spiked levels in animal tissue samples(n=6)
3 结论
采用液相色谱-三重四极杆串联质谱法对动物源食品基质中的硝呋索尔代谢物进行同时定性和定量分析,该方法简便、快速,可以满足目前对动物源食品中硝呋索尔代谢物残留量的同时定性定量的检测需求。
[1]蒋 原,丁 涛,徐锦忠,等.硝基呋喃类药物在克氏螯虾组织中消除规律的研究[J].畜牧与兽医,2008,40(2):34-37.
[2]ZUIDEMA T,MULDER P P J,RHIJIN J A,et al.Metabolism and depletion of nifursol in broilers[J]. Analytia Chimica ACTA,2005,529:339-346.
[3]AILA O,SHITANDI A,MAHUNGU M S,et al.Determination of the depletion of furazolidone residues in chicken tissues using a bacillus stearothermophilus test [J].Food Control,2009,20:543-547.
[4]张 玲,李 劼,王 鑫,等.动物肝脏中呋喃唑酮残留量的快速检测与评价[J].上海畜牧兽医通讯,2008,(5):44-45.
[5]王 媛,蔡友琼,贾东芬,等.高效液相色谱法检测水产品中硝基呋喃类代谢物残留量[J].分析试验室,2009,28(12):86-90.
[6]ROBERT J,MCCRACKEN,KENNEDY D G.Determination of furazolidone in animal feeds using liquid chromatography with UV and thermospray mass spectrometric detection[J].Journal of Chromatography A,1997,771:349-354.
[7]BARBOSA J,MOURA S,BARBOSA R,et al.Determination of nitrofurans in animal feeds by liquid chromatography-UV photodiode array detection and liquid chromatography-ionspray tandem mass spectrometry[J].Analytica chimica Acta,2007,586:359-365.
[8]张会彩,李 军,闫晓东,等.高效液相色谱法检测饲料中7种硝基呋喃类药物[J].中国兽医杂志,2011,47(5):72-74.
[9]XIA X,LI W X,ZHANG X S,et al.Simultaneous determination of 5-nitroimidazoles and nitrofurans in pork by high performance liquid chroma-tography tandem mass spectrometry[J].Journal of Chromatography A,2008,1208:101-108.
[10]MOTTIER P,KHONG S-P,GREMAUD E,et al.Quantitative determination of four nitrofuran metabolites in meat by isotope dilution liquid chromatography electrospray ionization tandem mass spectrometry[J].Journal of chromatography A,2005,1067:85-91.
[11]COOPER K M,SAMSONOVA J V,PLUMPTON L,et al.Enzyme immunoassay for semicarbazide-The nitrofuran metabolite and food contaminant[J].Analytica Chimica Acta,2007,592:64-71.
[12]JIANG W X,LUO P J,WANG X,et al.Development of an enzyme-linked immunosorbent assay for the detection of nitrofurantoin metabolite,1-amino-hydantoin,in animal tissues[J].Food Control,2011:1-6.
[13]VERDON E,COUEDOR P,SANDERS P.Multi-residue monitoring for the simultaneous determination of five nitrofurans(furazolidone,furaltadone,nitrofurazone,nitrofurantoine,nifursol)in poultry muscle tissue through the detection of their five major metabolites(AOZ,AMOZ,SEM,AHD,DNSAH)by liquid chromatography coupled to electrospray tandem mass spectrometry-In-house validation in line with Commission Decision 657/2002/EC[J].Analytica Chimica Acta,2007,586:336-347.
[14]KAUFMANN A,BUTCHER P,MADEN K.LCMS-MS method for determining nifursol and oth-er nitrofuran residues in meat[J].Mitt Lebensm Hyg,2004,95:135-146.
[15]彭 涛,邱月明,李淑娟,等.高效液相色谱串联质谱法测定动物肌肉中硝基呋喃类抗生素代谢物[J].检验检疫科学,2003,(6):24-26.
[16]RADOVNIKOVIC R,MOLONEY M,BYRNE P,et al.Detection of banned nitrofuran metabolites in animal plasma samples using UHPLC-MS/MS[J].Journal of chromatography B,2011,879:159-168.
[17]RODZIEWICZ L.Determination of nitrofuran metabolites in milk by liquid chromatography-electrospray ionization tandem mass spectrometry[J].Journal of chromatography B,2008,864:156-160.
[18]SZILAGYI S,CALLE B.Development and validation of an analytical method for the determination of semicarbazide in fresh egg and in egg powder based on the use of liquid chromatography tandem mass spectrometry[J].Analytica Chimica Acta,2006,572:113-120.
[19]LEITNER A,ZOLLNER P,LINDNER W.Determination of the metabolites of nitrofuran antibiotics in animal tissue by high-performance liquid chromatography-tandem mass spectrometry[J].Journal of Chromatography A,2001,939:49-58.
[20]邢丽红,孙卫红,李早新.液相色谱-串联质谱法快速测定水产品种硝基呋喃类代谢物[J].环境化学,2011,30(6):1202-1203.

