慢性脑缺血致认知功能障碍大鼠皮层ROCK2、MBS表达的变化
王立波 莽 靖 刘晓阳 王晓明 何金婷 包晓群 徐忠信
(吉林大学中日联谊医院神经内科,吉林 长春 130033)
慢性脑缺血是临床上常见的脑损伤之一,是阿尔茨海默病、血管性痴呆和Binswanger病等多种疾病发展过程中的一个共同病理过程,其损伤机制尚不完全清楚。本研究前期实验已证实,Rho激酶(ROCK)2参与慢性缺血性脑损伤过程〔1〕,但其下游作用底物肌球蛋白结合亚单位(MBS)在慢性脑缺血致认知功能障碍中的变化及相关干预对其的影响尚不清楚。本实验在成功制备慢性脑缺血致认知功能障碍模型基础上,以ROCK为靶点,探讨ROCK2/MBS信号传导参与慢性脑缺血致认知功能障碍损伤的机制,为慢性脑缺血致认知功能障碍的治疗提供新思路和新靶点。
1 材料与方法
1.1 实验动物与分组 健康雄性Wistar大鼠54只,体重320~340 g,由吉林大学实验动物中心提供,经Morris水迷宫实验筛选后,随即平均分为:假手术组、缺血(2VO)组和ROCK抑制剂(法舒地尔)组,每组再根据缺血时间随机分为3、6、9 w三组,每组6只。
1.2 模型建立及给药方法 采用双侧颈总动脉永久性阻断法(2VO)建立慢性脑缺血动物模型〔2〕。ROCK抑制剂(法舒地尔)组于术后48 h内,每天予盐酸法舒地尔注射液(天津红日药业股份有限公司生产)7.5 mg/kg腹腔注射。各模型组于双侧颈总动脉结扎后3、6、9 w,再次麻醉大鼠,断头取脑,分离皮层,液氮保存。
1.3 Morris水迷宫实验 以Morris水迷宫实验测定空间学习记忆能力。Morris水迷宫由圆形水池、自动摄像机及电脑分析系统组成。记录大鼠找到站台的时间(逃避潜伏期,escape lantency)和游泳路径。如大鼠在120 s内未找到站台者,潜伏期记为120 s。选取搜索持续时间(逃避潜伏期)和搜索行走路径(游泳距离)作为评价指标。术后大鼠找到平台所用时间越长,在此期间走的距离越长,表明其学习记忆保持能力越差,提示学习记忆受损严重。数据采集及图像分析均由图像自动监视和处理系统完成。
1.4 RT-PCR检测ROCK2 mRNA表达 大鼠额叶皮层组织经Trizol法抽提总RNA,反转录制备cDNA。应用RT-PCR方法检测ROCK2 mRNA的表达。反应条件为 94℃ 预变性5 min,94℃ 变性30 s,47℃退火 40 s,72℃延伸2 min,共30个循环,72℃再延伸5 min。PCR产物经1.2%琼脂糖凝胶电泳观察结果、照相,用凝胶图像分析系统扫描后,Bandscan软件分析条带灰度,分别计算ROCK2条带的光密度与相对的β-actin条带光密度的比值,表示各组mRNA表达水平。引物根据GenBank检索的核苷酸序列用Premier 5.0软件设计,由上海生工生物工程技术服务有限公司合成。见表1。

表1 引物序列和PCR产物长度
1.5 Western印迹检测ROCK2、MBS蛋白表达 分离提取各时间点脑组织皮层细胞,PBS洗涤2次,每次1 000 r/min,离心5 min;将细胞沉淀溶于150μl细胞裂解液,4℃裂解 30 min;4℃12 000 r/min离心2 min,收集上清即为总蛋白粗提液。应用Bio-rad测定蛋白含量。12%SDS-PAGE电泳(恒压100 V,3 h),电泳完毕后进行转膜,5%的脱脂牛奶封闭2 h。使用5%脱脂牛奶按比例适当稀释一抗,然后一抗孵育过夜。TBST洗涤PVDF膜,加入HRP二抗,室温孵育2 h。TBST洗涤膜,ECL显色液曝光。结果用凝胶图像分析系统扫描后,Bandscan分析条带灰度,分别计算ROCK2、MBS条带的光密度与相对的β-actin条带光密度的比值,表示各组蛋白表达水平。一抗为兔抗鼠ROCK2、MBS(武汉博士德生物制品公司)。
1.6 统计学处理 实验数据用SPSS12.0统计软件进行分析,数据结果以±s表示,组间比较采用方差分析和t检验。
2 结果
2.1 大鼠不同缺血时间学习记忆能力变化 假手术组3、6、9 w大鼠搜索持续时间(逃避潜伏期)和搜索行走路径(游泳距离)无明显变化(P>0.05),缺血3 w时,大鼠逃避潜伏期和游泳距离明显延长,与假手术组相比差异显著(P<0.05),缺血6 w和9 w时,与假手术组相比也有显著差异(P<0.05),9 w时,大鼠逃避潜伏期和游泳距离改变最为显著,与3 w相比有显著差异(P<0.05)。表明随缺血时间延长,大鼠学习记忆能力明显下降。法舒地尔组各时间点学习记忆成绩均较缺血组明显提高(P<0.05),但仍未恢复正常水平。见表2、表3。
表2 各组大鼠不同缺血时间逃避潜伏期(n=6,±s)
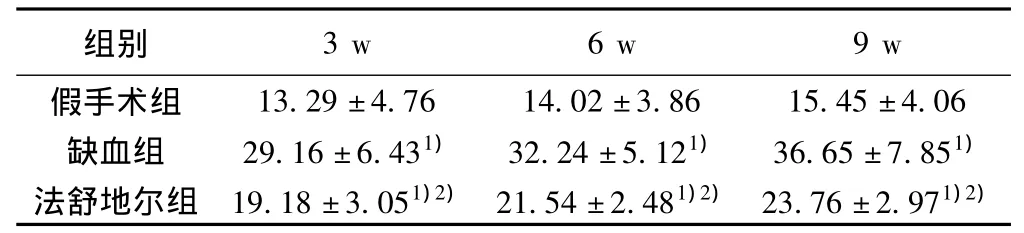
表2 各组大鼠不同缺血时间逃避潜伏期(n=6,±s)
与假手术组比较:1)P<0.05;与缺血组比较:2)P<0.05;下表同
13.29±4.76 14.02±3.86 15.45±4.06缺血组 29.16±6.431) 32.24±5.121) 36.65±7.851)法舒地尔组 19.18±3.051)2) 21.54±2.481)2) 23.76±2.971)2)3 w 6 w 9 w假手术组组别

表3 各组大鼠不同缺血时间游泳距离(n=6,cm)

图1 不同缺血时间ROCK2蛋白及mRNA表达
2.2 大鼠不同缺血时间皮层ROCK2蛋白及mRNA表达 见图1。假手术组有弱ROCK2蛋白和mRNA表达,缺血3 w后ROCK2蛋白和mRNA表达增加,均高于假手术组(P<0.05),且随缺血时间延长,6 w时出现表达高峰,9 w时表达有所下降,但仍高于假手术组(P<0.05);法舒地尔干预后,大鼠额叶皮层ROCK2蛋白和mRNA表达均低于同一时间点缺血组(P<0.05),但仍高于相同时间点的假手术组(P<0.05)。
2.3 大鼠不同缺血时间额叶皮层脑组织MBS蛋白表达MBS蛋白检测结果显示,与假手术组相比,缺血组和法舒地尔组大鼠各时间点MBS蛋白表达均增高(P<0.05),且随时间延长,MBS蛋白表达增高,6 w时达最高峰,与ROCK表达一致;法舒地尔干预后,大鼠额叶皮层MBS蛋白表达均低于同一时间点的盐水缺组组(P<0.05),但仍高于相同时间点的假手术组(P<0.05)。见图2。
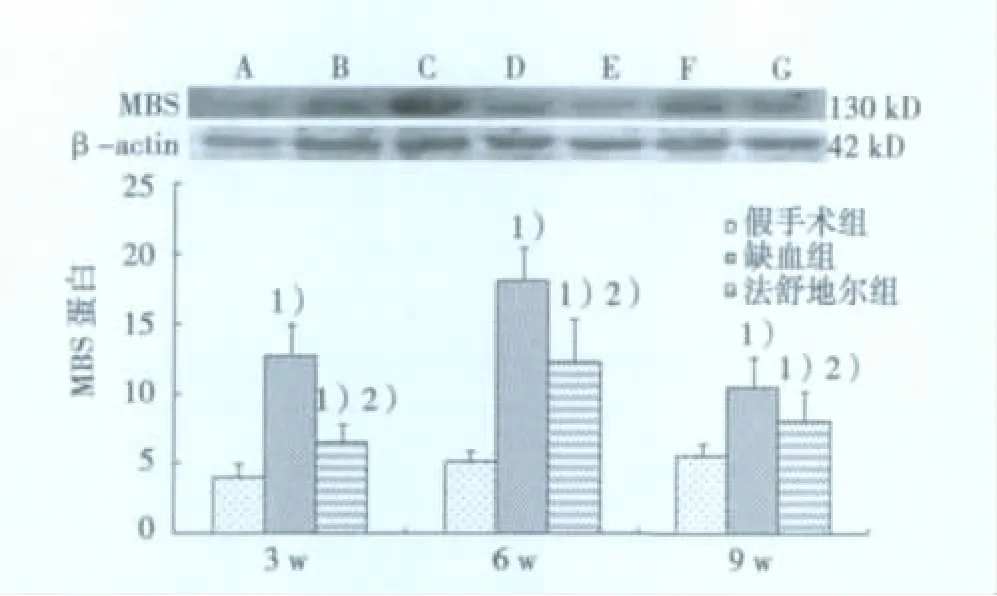
图2 不同缺血时间MBS蛋白表达
3 讨论
慢性脑缺血是临床上常见的脑损伤之一,目前非常重视对慢性脑缺血致认知功能障碍防治的研究。有研究表明,在脑组织低灌注和低代谢状态下,大鼠的学习记忆功能可发生减退〔3〕。本研究发现慢性脑缺血可使大鼠逃避潜伏期和游泳路径均明显延长,大鼠学习记忆功能发生改变,并随着时间推移逐渐加重,表明大鼠慢性脑缺血可以导致认知功能障碍。研究结果与Rho激酶可以通过多种途径影响细胞信号转导系统,参与血管损伤后内皮细胞和平滑肌细胞增殖以及再狭窄的调控过程相一致〔4〕。
Rho是哺乳类动物Ras基因超家族的一个亚群,被称为小GTP结合蛋白(小G蛋白)。Rho的下游效应器为Rho激酶(ROCK),是一种丝氨酸-苏氨酸蛋白激酶,它有两种细胞亚型,分别是ROCK 1和ROCK 2,ROCK-1在除脑和肌肉外的其他组织中普遍表达,而ROCK2广泛表达于脑、肌肉、心肺和胎盘。ROCK的主要作用底物是肌球蛋白轻链脱磷酸化酶(MLCP)的肌球蛋白结合亚基(MBS),ROCK的激活本身可以将MLC磷酸化而发生肌丝收缩作用,同时也能将MLCP磷酸化,从而使MLCP失活,阻止了磷酸化的MLC脱磷酸失活,间接促进MLC磷酸化而促进平滑肌收缩〔5〕。Rho和ROCK活性在脑血管疾病中普遍地增加,不仅仅在血管平滑肌,而且在内皮,甚至在炎症细胞和神经元。ROCK不仅仅参与平滑肌细胞的收缩,还可能通过与ATⅡ、ET21、PDGF等血管活性物质的相互作用参与许多细胞功能的调节,与动脉粥样硬化、高血压和缺血性脑损害等血管性疾病的发生和发展关系密切〔6~9〕。本研究结果表明慢性缺血后不但有ROCK的表达上调,并存在功能活化,与认知功能改变平行。因此,ROCK的表达变化与慢性脑缺血认知功能损伤密切相关。
血管平滑肌细胞的收缩取决于胞浆内MLC磷酸化程度,慢性脑缺血致认知功能障碍时血管段肌球蛋白轻链磷酸化水平升高。肌球蛋白轻链磷酸化水平主要由肌球蛋白轻链磷酸酶参与的钙增敏途径调节,而并非细胞内 Ca2+浓度的增加〔10,11〕。本研究说明这两组血管段的肌球蛋白轻链磷酸酶的活性下降,导致肌球蛋白轻链磷酸化水平升高。ROCK磷酸化肌球蛋白轻链结合亚基,使肌球蛋白轻链磷酸酶失活,提高了肌球蛋白轻链磷酸化水平,并增强了钙增敏作用,使血管平滑肌收缩性增高,脑组织特别是额叶皮层血供发生障碍,导致大鼠学习记忆能力下降。因此,ROCK信号转导途径通过增加磷酸化肌球蛋白轻链结合亚基,抑制肌球蛋白轻链磷酸酶的活性及加强钙增敏途径参与了慢性脑缺血致认知功能障碍的发病机制。
自Rho蛋白的发现即开始研制ROCK抑制剂。作用机制主要为通过与ATP竞争ROCK催化区的ATP结合位点而阻断了ROCK的活性,具有较强的平滑肌松弛作用,对肌球蛋白轻链激酶(MLCK)具有抑制作用,从而使血管平滑肌舒张,扩张血管,具有极大的临床应用价值〔12〕。本研究提示ROCK参与了慢性脑组织低灌注损伤过程,ROCK转导通路变化可能是慢性脑低灌注后认知功能障碍机制之一。
1 王晓明,莽 靖,徐忠信,等.慢性脑缺血致认知功能障碍大鼠皮层ROCK表达变化〔J〕.中国老年学杂志,2009;29(4):935-6.
2 Shibata M,Ohtani R,Ihara M,et al.White Matter Lesions and Glial Activation in a Novel Mouse Model of Chronic Cerebral Hypoperfusion〔J〕.Stroke,2004;35(11):2598-603.
3 Fan LW,Lin SY,Pang Y,et al.Hypoxia-ischemia induced neurological dysfunction and brain injury in the neonatal rat〔J〕.Behav Brain Res,2005;165(1):80-90.
4 Zhao ZY,Scott AR.Rho-associated kinases play a role in endocardial cell differentiation and migration〔J〕.Develop Biol,2004;275:183-91.
5 Huang L,Li Q,Li H,et al.Inhibition of intracellular Ca2+release by a Rho-kinase inhibitor for the treatment of ischemic damage in primary cultured rat hippocampal neurons〔J〕.Eur J Pharmacol,2009;(2-3):238-44.
6 Kazuo Y,Koh K,Tsuyoshi H,et al.Demonstration of elevation and localization of Rho-kinase activity in the brain of a rat model of cerebral infarction〔J〕.Eur JPharmacol,2008;594(1-3):77-83.
7 Dong-Myung S,Jinmo K,Jongwon H,et al.Cystamine prevents ischemiareperfusion injury by inhibiting polyamination of RhoA〔J〕.Biochem Biophys Res Comm,2008;365(3):509-14.
8 Kenji I,Hisayo F,Mariko H,et al.Trapidil inhibits platelet-derived growth factor-induced migration via protein kinase A and RhoA/Rho-associated kinase in rat vascular smooth muscle cells〔J〕.Eur J Pharmacol,2005;515(1-3):28-33.
9 Hiroaki S,Mamunur R.Development of Rho-kinase inhibitors for cardiovascular medicine〔J〕.Trends Pharmacol Sci,2007;28(6):296-302.
10 Yuko Fukata,Kazushi Kimura,Noriko Oshiro,et al.Association of the myosin-binding subunit of myosin phosphatase and moesin:dual regulation of moesin phosphorylation by Rho-associated kinase and myosin phosphatase〔J〕.JCell Biol,1998;141(2):409-18.
11 王晓明,邵延坤,徐忠信.Rho激酶在脑血管疾病研究中相关进展〔J〕.中风与神经疾病杂志,2008;25(6):878-80.
12 Fukushima M,Nakamuta M,Kohjima M,et al.Fasudil hydrochloride hydrate,a Rho-kinase(ROCK)inhibitor,suppresses collagen production and enhances collagenase activity in hepatic stellate cells〔J〕.Liver International,2005;25(4):829-38.

