fibulin-5在缺血再灌注大鼠脑组织中的表达
徐广会 秦新月 陶 涛 程 创 (重庆医科大学附属第一医院神经内科,重庆 400016)
脑缺血早期血管梗阻引起血管内皮细胞坏死凋亡,细胞间连接受到破坏,进而引起血脑屏障的破坏,造成后续级联反应。因此保护血管内皮细胞或者维持血管的稳定是有效的解决缺血早期脑损伤的重要途径。fibulin-5作为一种细胞外基质蛋白因为广泛的细胞功能而备受关注,因为发现其能够增加内皮细胞与基底膜的黏附,降低内皮细胞迁移,因而在血管稳定方面成为近年来的研究热点,但其在脑缺血过程中所起的作用值得探讨。本研究拟通过构建大鼠局灶性脑缺血再灌注模型,观察fibulin-5在缺血再灌注早期的表达变化规律,为探索治疗缺血性脑血管病提供新的思路。
1 材料与方法
1.1 材料与试剂 兔抗fibulin-5多克隆抗体(Santa),小鼠抗CD31单克隆抗体(BD),Alexa Fluor 488标记山羊抗兔IgG(绿光)、Alexa Fluor 594标记山羊抗小鼠IgG(上海碧云天),RNAiso plus、逆转录试剂盒、荧光定量试剂盒(Takara),PCR引物(上海生工),Western印迹检测相关试剂(上海碧云天)。
1.2 实验动物与分组 选用健康雄性清洁级SD大鼠96只,体质量230~280 g,鼠龄3~4月龄,由重庆医科大学实验动物中心提供。分为6组各16只,分别为正常组、假手术组、中脑动脉闭塞(MCAO)模型6 h组、24 h组、48 h和72 h组。术前12 h禁食不禁水。
1.3 模型制备及神经功能评分 参照Longa线栓法,并根据改良法制作大鼠大脑中动脉缺血再灌注模型,大鼠清醒后进行神经功能评分,神经功能评分采用Zea Longa评分法:1~3分者入组,0分和4分者均被剔除。到达时间点取材时若发现蛛网膜下腔出血者也剔除。所有剔除者随机补充。
1.4 激光共聚焦检测脑组织内fibulin-5的表达 取大鼠缺血侧脑组织制备冰冻切片(片厚20μm),-80℃保存。取出晾干,放入丙酮中固定30 min,PBS冲洗后放入枸橼酸盐中进行微波修复,待自然冷却后 PBS冲洗,加入0.4%Triton破膜,37℃孵育30 min,PBS冲洗后封闭血清37℃孵育30 min,甩干血清,加入兔抗大鼠fibulin-5多克隆抗体和小鼠抗大鼠CD31单克隆抗体(稀释浓度均为1∶50)的混合液,4℃过夜。第二天将切片放入37℃复温1 h,PBS冲洗后,在避光情况下加入Alex 488(羊抗小鼠,绿光)和Alex 596(羊抗兔,红光)的混合二抗(稀释浓度均为1∶100),37℃孵育2 h后PBS冲洗,50%甘油封片。激光共聚焦显微镜下观察拍照。
1.5 实时荧光定量PCR检测脑组织中fibulin-5 mRNA的表达水平 取大鼠右侧大脑半球缺血区部分脑组织,严格按照RNA提取说明书进行每个样本的总 RNA提取,测定其260和280 nm光密度比值在1.9~2.2,用逆转录试剂盒合成cDNA,按照荧光定量试剂盒的说明书进行实时定量PCR检测。β-actin作为内参。引物序列分别为:fibulin-5上游5'-GCCCTACTCCAATCCCTACTCT-3',下 游 5'-TACCCTCCTTCCGTGTTGATAC-3';β-actin 上游 5'-CACCCGCGAGTACAACCTTC-3',下游 5'-CCCATACCCACCATCACACC-3'。扩增条件为 95℃预变性2 min;95℃ 变性 5 s,60℃ 退火 34 s,40 个循环;72℃ 延伸10 min。根据相对定量(RQ)法计算fibulin-5 mRNA的相对表达量。
1.6 Western印迹检测脑组织中fibulin-5的表达 取大鼠大脑半球缺血区部分脑组织提取全蛋白,使用蛋白定量试剂盒测定蛋白浓度。用SDS-PAGE电泳分离等量的蛋白质,然后电转至PVDF膜。将膜浸入TBST5%脱脂奶粉中37℃封闭1 h,封闭后加入1∶100稀释的兔抗大鼠fibulin-5多克隆抗体4℃过夜。第2天37℃复温1 h,TBST清洗后1∶2 000稀释的羊抗兔IgG 37℃孵育2 h。多次清洗后,加入显影剂,使用凝胶成像分析系统扫描拍照。结果以 Quantity One图像进行条带分析,以fibulin-5/β-actin条带密度的相对值表示蛋白表达水平。
2 结果
2.1 激光共聚焦检测脑组织中fibulin-5的表达 CD31主要标记内皮细胞,能够特异性地定位组织中的血管。激光共聚焦结果显示,fibulin-5主要分布在内皮细胞之间,也可在实质细胞或者血管内皮细胞胞质中表达见图1。

图1 激光共聚焦检测脑组织内fibulin-5的表达(箭头所示,×200)
2.2 实时荧光定量PCR检测脑组织内fibulin-5 mRNA的表达水平 fibulin-5 mRNA表达量模型组各时间点与假手术组比较有统计学意义(P<0.05)。Fibulin-5 mRNA的表达从缺血再灌注6 h(1.25±0.01)逐渐升高,24 h(1.47±0.06)达到高峰,随后开始降低,但48 h(1.21±0.38)、72 h(1.13±0.03)时仍高于假手术组(1.02±0.01,P<0.05)。正常组与假手术组比较无统计学意义。
2.3 Western印迹检测脑组织内fibulin-5蛋白表达量 fibulin-5蛋白表达缺血再灌注各组与假手术组比差异有统计学意义(P<0.05)。缺血再灌注缺血侧脑组织fibulin-5蛋白的表达趋势与fibulin-5 mRNA表达趋势相似。与假手术组(0.30±0.14)相比,缺血再灌注各组脑组织fibulin-5蛋白表达从再灌注6 h(1.26±0.46)逐渐升高,再灌注24 h(1.78±0.48)达到高峰,72 h(0.89±0.27)时有所下降,但仍高于假手术组(P<0.05)。正常组与假手术组的差异无统计学意义。见图2。
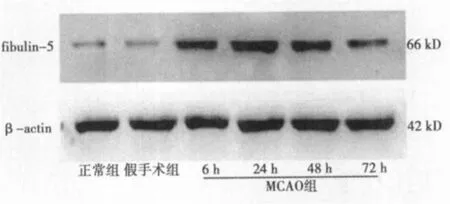
图2 Western印迹检测缺血侧脑组织fibulin-5蛋白表达量
3 讨论
Fibulin-5是一种细胞外基质蛋白,因为广泛的细胞功能而备受关注,在组织的形成、重建和修复等各种生理过程中都起着关键的作用〔1〕,其表达缺失与肿瘤和生殖器官脱垂等病理过程有着密切的关系〔2〕。Anna等〔3〕研究发现,在缺氧条件下人脐静脉血管内皮细胞的fibulin-5表达水平明显升高,这与本研究有相似之处。
Fibulin-5在正常成人血管中表达较低,但是在球囊撤出引起的血管损伤、颈动脉结扎以及动脉粥样硬化斑块激活的内皮细胞中有大幅度的上调,其表达上调可以增加内皮细胞黏附力,降低内皮细胞的迁移,对血管的稳定起到促进作用。在大多数肿瘤形成过程中,fibulin-5的表达降低使得肿瘤内出现大量畸形新生血管,而fibulin-5的过表达可以抑制新生血管的生长,进而抑制肿瘤的生长〔4〕。Fibulin-5含有能与整联蛋白结合的RGD基序(integrin-binding RGD motif),这一基序能介导内皮细胞黏附,能与细胞表面的整合素 ανβ3、ανβ5和 α9β1结合〔5〕。Preis 等〔6,7〕通过离体研究发现 fibulin-5 能够通过 RGD与整合素的结合增强内皮细胞间以及内皮细胞和细胞外基质的黏附力,而过度表达fibulin-5的内皮细胞能够明显增强其黏附力以及对抗剪切力的能力。另外,过表达的fibulin-5能够竞争纤连蛋白与α5β1整合素的结合,抑制ROS的表达,从而降低缺氧条件下内皮细胞的死亡〔6〕。因此,离体条件下已经证实了的fibulin-5过表达对血管内皮细胞的保护作用能否在在体条件下发挥同样的作用将是以后研究的重点。缺血再灌注条件下fibulin-5的表达明显升高,这一表达变化可能会激活脑内血管内皮细胞,阻滞内皮细胞的死亡,增强内皮细胞与基底膜的黏附,以及通过调节缺血后脑组织内的炎症反应,从而对脑损伤起到保护作用。我们将在后续的课题中重点对fibulin-5作用于脑血管的分子机制进行更深入的研究。
1 Spencer JA,Hacker SL,Davis EC,et al.Altered vascular remodeling in fibulin-5-deficient mice reveals a role of fibulin-5 in smooth muscle cell proliferation and migration〔J〕.Proc Natl Acad Sci USA,2005;102:2946-51.
2 Soderberg MW,Bystrom B,Kalamajski S,et al.Gene expressions of small leucine-rich repeat proteoglycans and fibulin-5 are decreased in pelvic organ prolapse〔J〕.Mol Hum Reprod,2009;15:251-7.
3 Anna Guadall,Mar Orriols,Ricardo Rodriguueze,et al.Fibulin-5 is upregulated by hypoxia in endothelial cells through a hypoxia-inducible factor-1(HIF-1α)-dependent mechanism〔J〕.J Biol Chem,2011;286(9):7093-103.
4 Albig AR,Neil JR,Schiemann WP.Fibulins3 and 5 antagonize tumor angiogenesis in vivo〔J〕.Cancer Res,2006;66:2621-9.
5 Albig AR,Schiemann WP.Fibulin-5 antagonizes vascular endothelial growth factor(VEGF)signaling and angiogenic sprouting by endothelial cells〔J〕.DNA Cell Biol,2004;23(6):367-79.
6 Preis M,Cohen T,Sarnatzki Y,et al.Effects of fibulin-5 on attachment,adhesion,and proliferation of primary human endothelial cells〔J〕.Biochem Biophys Res Comm,2006;348(3):1024-33.
7 Schiemann WP,Blobe GC,Kalume DE,et al.Context-specific effects of fibulin-5(DANCE/EVEC)on cell proliferationg motility,and invasion.Fibulin-5 is induced by transforming growth factor-beta and affects protein kinase cascades〔J〕.JBiol Chem,2002;277(30):27367-77.

