不同补肾法在脑梗死大鼠体内促骨髓间充质干细胞向神经元样细胞分化的作用
刘永琦 王 倩 颜春鲁 苏 韫 张 毅 范 萍 吴晓晶 董介正
(甘肃中医学院,甘肃 兰州 730000)
目前关于脑梗死的治疗主要有内科药物、外科手术及血管内治疗等方法,但迄今为止,尚无理想的内科治疗或外科手术方法可以对脑梗死发生后取得疗效。因此,考虑通过干细胞移植的方法重建神经通路,恢复或改善神经功能障碍成为近年来医学领域备受关注的研究热点〔1〕。骨髓间质干细胞(BMSCs)是骨髓中存在的除造血干细胞外的另一类干细胞,具有多向分化潜能,在一定条件下,可以分化为骨细胞、脂肪细胞、内皮细胞、神经细胞等。因BMSCs取材简便,容易分离纯化培养,特别是自身骨髓的取材不受伦理学及供体组织来源的限制,细胞移植时可避免免疫排斥反应,成为细胞治疗和组织工程的理想种子细胞。本课题用不同补肾法(补益肾阴法、阴阳双补法、补益肾阳法)代表方药左归丸、地黄饮子、右归丸含药血清孵育BMSCs,观察不同补肾方药在体内对BMSCs的诱导分化作用,探讨不同补肾方药影响BMSCs移植在脑梗死功能修复中的机制,为补肾方药联合BMSCs移植治疗脑梗死的临床应用提供理论和实验基础。
1 材料与方法
1.1 实验动物 提取BMSCs的动物:SPF级Wistar大鼠15只,雌雄不限,体重(120±10)g。制备含药血清的动物:SPF级Wistar大鼠40只,雌雄不限,体重(250±20)g。造模的动物:SPF级Wistar大鼠60只,雌雄各半,体重(300±30)g。以上动物皆由甘肃中医学院实验动物中心提供,实验动物质量合格证号:SCXK(甘)2004-0006。
1.2 实验药物 左归丸、右归丸、地黄饮子均购自甘肃中医学院附属医院药剂科,经中药教研室鉴定,均为正品。
1.3 主要药品试剂与仪器 L-DMEM培养基(GIBCO Invitrogen Corporation,批号1240031),胎牛血清(杭州四季青生物工程材料有限公司,批号090123),0.25%胰酶(Sigma),L-谷氨酰胺(上海新兴医药保健品科技开发中心,批号991085),全反式维甲酸(RA,Sigma),CD45荧光标记抗体(Gibco公司),CD90荧光标记抗体(Gibco公司),Nestin、神经元特异性烯醇化酶(NSE)、胶质纤维酸性蛋白(GFAP)免疫组化试剂盒,荧光FITC试剂盒,兔抗大鼠BrdU抗体(武汉博士德生物工程有限公司,批号2009006);二氧化碳培养箱(SANYO Electric Co.Ltd,型号MOA-18ALC),超净工作台(苏州净化仪器厂,型号 SW-CJ-2FD),流式细胞仪(美国贝克曼公司)。
1.4 实验方法
1.4.1 BMSCs的分离培养、鉴定 采用全骨髓贴壁筛选法分离培养、纯化BMSCs,经流式细胞仪检测BMSCs表面标志CD90及造血干细胞表面标志CD45的表达率。
1.4.2 中药含药血清的制备 40只Wistar大鼠,随机分为4组:空白组、左归丸全药组(补益肾阴法代表方药)、地黄饮子全药组(阴阳双补法代表方药)和右归丸全药组(补益肾阳法代表方药)。晚禁食,第2天,空白组给生理盐水,其余组给药液(剂量按1 g生药/100 g大鼠),连续3 d,2次/d;于第3天给药后2 h从股动脉取血,3 000 r/min,10 min,分离血清,56℃灭活30 min,0.22μm滤器过滤除菌,分装,-20℃保存备用。
1.4.3 对F3代BMSCs进行补肾方药含药血清孵育 将已纯化的BMSCs(F3代)接种至培养瓶中,待细胞70% ~80%融合后,弃完全培养液,随机分组,分别用含10%左归丸、右归丸、地黄饮子中药血清和维甲酸的L-DMEM培养液孵育,连续培养3 d。将诱导的BMSCs用0.25%的胰酶消化,待细胞变形、间隙增大,加入含10%胎牛血清的DMEM中止消化,磷酸盐缓冲液轻洗,吹打成1×106个/ml细胞悬液,备用。
1.4.4 MCAO动物模型制备及成功的判定
1.4.4.1 MCAO动物模型的制备 健康Wistar大鼠60只采用文献〔1〕所报道的线栓法建立Wistar大鼠MCAO模型,10%水合氯醛腹腔麻醉(0.3 ml/100 g)后,将大鼠于颈部正中切开皮肤,结扎颈外动脉远端后,于其近端插入直径0.25 mm尼龙线,将尼龙线缓慢向颅内推进,进线约18 mm左右,略感阻力,即到大脑中动脉起始部,阻断右侧大脑中动脉2 h后,将尼龙线拔至颈外动脉残端,剪断尼龙线,缝合皮肤切口。另设8只大鼠作为假手术组对照,仅分离左侧血管和神经,结扎颈外动脉远端,不插入尼龙线,即缝合皮肤切口。
1.4.4.2 模型成功的判定标准 MCAO后24 h对大鼠神经功能评分,参考Longa及Bederson〔2〕评定神经功能缺损程度的5级4分法标准进行评分,评分标准为0分:无神经系统症状;1分:不能完全伸展对侧前爪;2分:爬行时转圈;3分:向对侧倾倒;4分:不能自行行走,意识丧失。评分为1~3分者,提示模型成功,可按预定方案,给予相应的干预措施。
1.4.5 BMSCs加中药含药血清孵育、标记 各组细胞于移植前72 h用无血清L-DMEM洗涤三次后,加入相应的诱导培养液,置于37℃、气体体积分数为5%,湿度饱和的CO2培养箱内培养诱导。其中,单纯BMSCs组诱导液由等量大鼠空白血清代替胎牛血清加入L-DMEM培养液配制而成;各中药血清组诱导液由等量相应含药血清代替胎牛血清加入L-DMEM培养液配制而成;维甲酸组诱导液先将维甲酸配成质量浓度为0.3 mg/L的溶液,加入含10%胎牛血清L-DMEM的细胞中,诱导剂的最终浓度为2.5 g/L。五组均于移植前48 h做细胞爬片,加入终浓度为10μmol/L的BrdU液标记骨髓间充质干细胞,并用免疫组化法进行FITC染色,计算标记率。
1.4.6 不同补肾方药含药血清孵育BMSCs的移植 各组大鼠于造模24 h后,取第3代经不同补肾类中药孵育的各组BMSCs,用胰酶消化,加入含10%胎牛血清的DMEM中止消化,用等渗PBS液吹打成细胞悬液,然后1 500 r/min离心5 min,弃上清液,再加入等渗PBS液,吹打成细胞悬液,让细胞充分、均匀悬浮于细胞培养液中,并进行细胞计数,将细胞浓度调至约2×106个/L。再取细胞悬液约1 ml于模型大鼠尾静脉注射。
1.4.7 移植细胞神经标志蛋白检测
1.4.7.1 BrdU双标免疫细胞化学染色 荧光显微镜观察并拍照。以Nestin抗原表达鉴定神经干细胞,NSE抗原表达鉴定分化形成的神经元,GFAP抗原表达鉴定分化形成的胶质细胞,此三者均为胞质表达。免疫细胞化学检测采用SABC改良法进行。
1.4.7.2 免疫细胞化学结果判定 ①BrdU细胞:BrdU标记细胞经免疫组化SABC-FITC荧光染色后,在荧光显微镜(用波长为490~495 nm蓝光激发)下呈黄绿色。随机在脑组织缺血侧BrdU细胞丰富区域,选取不重叠的5个视野进行观察,对每个视野观察到的BrdU细胞进行计数;每组观察6张切片,合计30个视野。统计每张切片的5个视野下观察到的BrdU细胞个数,取其均值(单位:个/视野),或对5个视野的细胞总和纳入统计(单位:个/5视野),下同。②BrdU与Nestin免疫双标细胞:细胞浆中呈棕黄色颗粒者为阳性细胞,转换荧光显微镜后细胞核中出现黄绿色荧光。③BrdU与NSE免疫双标细胞:NSE表达在神经元细胞的胞质,光学显微镜下观察,胞浆阳性表达呈棕褐色,阴性不显色,细胞核淡染,在荧光显微镜下细胞核中出现黄绿色荧光。④BrdU与GFAP免疫双标细胞:分化为神经胶质细胞(BrdU与GFAP免疫双标细胞)的染色特点为胞质呈GFAP的红褐色,转换荧光显微镜后细胞核中出现黄绿色荧光。
1.5 统计学分析 应用SPSS16.0软件,数据均采用±s表示,采用单因素方差分析。
2 结果
2.1 大鼠BMSCs的形态及CD90、CD45的表达 F3代细胞形态单一均匀,融合后呈典型的极性,漩涡状生长(如图1)。经流式细胞仪检测BMSCs表面标志CD90及造血干细胞表面标志CD45的表达,CD90+CD45-细胞为97.0%。
2.2 BMSCs的标记及标记率 做细胞爬片,将BrdU标记的BMSCs用免疫组化法进行FITC染色,并用荧光显微镜观察,计算BrdU标记率为85.8%(见图2)。
2.3 移植细胞Nestin/BrdU双标表达水平 因假手术组与模型组未注射细胞,Nestin/BrdU双标免疫组化全为阴性,故不做比较。与单纯细胞组比较,RA组、地黄饮子与左归丸组Nestin/BrdU双标阳性表达率增高明显(P<0.05);与7 d时相比,14 d各组Nestin/BrdU双标阳性表达率,都有下降趋势(P<0.05),见表1。
2.4 移植细胞NSE/BrdU双标表达水平 因假手术组与模型组未注射细胞,NSE/BrdU双标免疫组化全为阴性,故不做比较。与单纯细胞组比较,RA组与地黄饮子组NSE/BrdU双标阳性表达率增高明显(P<0.05);与7 d时相比,14 d各组NSE/BrdU双标阳性表达率增高(P<0.05),可能原因是由于双标细胞数目增多以及BrdU标记细胞数目下降两方面的原因造成,见表2。
2.5 移植细胞GFAP/BrdU双标表达水平 因假手术组与模型组未注射细胞,GFAP/BrdU双标免疫组化全为阴性,故不做比较。与单纯细胞组比较,RA组与左归丸组GFAP/BrdU双标阳性表达率增高明显(P<0.05);与7 d时相比,14 d各组NSE/BrdU双标阳性表达率,有升高趋势(P<0.05),但可能是由于双标细胞数目增多以及BrdU标记细胞数目下降两方面的原因造成,见表3。
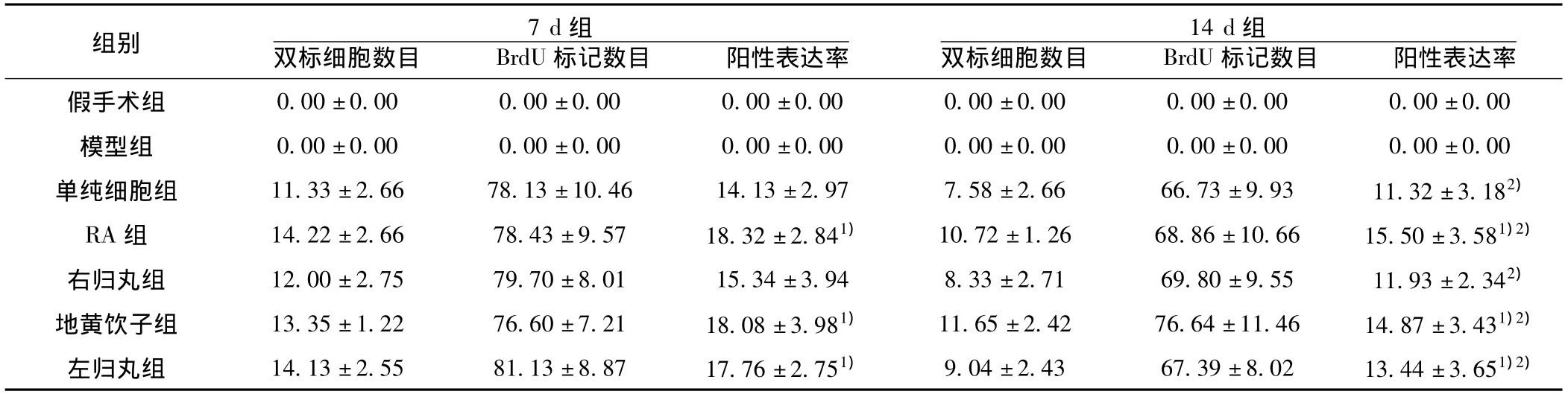
表1 移植细胞Nestin/BrdU双标表达水平(x ± s,n=6)

表2 移植细胞NSE/Brd U双标表达水平(x ± s,n=6)

图1 F3代BMSCs

图2 FITC荧光检测Brd U细胞标记(×100)
3 讨论
脑血管疾病,特别是缺血性脑血管疾病是目前危害中老年人身体健康的主要疾病,大多数患者留有肢体瘫痪、口眼歪斜、语言功能损伤等不同程度的功能障碍,严重影响患者的生活质量,具有高发病率、高死亡率、高致残率及高治疗费用等特点。根据中医理论,中风病的病机较为复杂,离不开风、火、痰、瘀、气、血六端,而肝肾阴亏为其病机关键,贯穿于中风病的整个病理过程。由于患者多为中老年人,积损正衰,脏腑功能虚损,肝肾不足,成为中风病发病的基础。缺血性中风无论在急性期,还是恢复期,均有一定比例的阴虚血瘀证型存在,同时其他证型的缺血性中风病患者在疾病的发生、发展中,亦多兼有阴虚血瘀的临床症状表现。正如《冯氏锦囊秘录·卷一》所述:“中风一症,多由肝阴不足,肾水有亏,虚火上乘,无故猝倒,筋骨无养,偏枯不遂,故滋肾养肝,治本之至要”。因此阴虚是其中的一个重要病理变化,其导致中风的病机为阴液不足,脉络瘀滞,髓海失养,脑络空虚,虚风内动。
近年来,进行细胞移植以替代或修复受损的脑组织为治疗缺血性脑损伤带来了新的曙光。BMSCs是近年来倍受关注的源于骨髓的细胞群。BMSCs具有多向分化潜能,易于分离和扩增,来源丰富,低免疫源性,可用于异体移植,不存在伦理问题。因此,BMSCs在组织工程、细胞和基因治疗中,尤其是中枢神经系统损伤后的再生修复中具有广阔的应用前景。本实验利用BMSCs移植修复和治疗大鼠脑缺血损伤。BMSCs从骨髓中分离得到,取材容易;体外分离培养能快速扩增,可以自体移植而且也未发现明显免疫排斥反应等问题。BMSCs具有高度自我更新和多向分化的能力〔2〕,在一定的条件下可以分化为神经干细胞、神经元细胞及神经胶质细胞等〔3〕。很多关于BMSCs对缺血性脑损伤的治疗研究表明:BMSCs能够与宿主大脑整合并存活、迁移。另外,在脑的微环境中存在一些因素如神经营养因子(NGF)等,可保护BMSCs在脑中不被破坏,并促进其增殖分化〔4〕。Nestin为存在于神经上皮干细胞中,为神经干细胞的标志物;NSE主要存在于神经细胞中,为成熟神经细胞的标志物;GFAP存在于正常星形胶质细胞和反应性胶质细胞中,为构成成熟星形胶质细胞中间丝的主要成分。
本结果提示阳性表达神经细胞的相关蛋白NSE、Nestin及GFAP,有诱导BMSCs向神经干细胞、神经元细胞及神经胶质细胞分化的可能性。在脑缺血微环境中可能存在一些因素,可引导BMSCs向缺血局部迁移,并保护BMSCs在脑中不被破坏,并促进其进一步分化;并可能存在着BMSCs先分化为神经干细胞,然后再向神经元细胞及神经胶质细胞分化的趋势不同补肾法在脑梗死大鼠体内外能够促BMSCs向神经元样细胞分化,且补阴类代表方左归丸和阴阳双补类代表方地黄饮子在体内诱导分化的效果优于补阳类代表方右归丸,这也正符合了中医“肾生髓,通于脑”理论实质。中医理论认为,肾“主骨、生髓、通于脑”,三者皆来源于先天的肾之精气;BMSCs来源于骨髓,而骨髓又属阴髓,故补益肾阴、阴阳双补法可促进BMSCs的增殖,并且利于BMSCs在脑内的存活及分化,从而达到对脑缺血损伤后神经的保护和修复作用,从而为补肾法联合细胞移植治疗神经系统疾病提供了新的理论依据。
1 王 颖,邓宇斌,李 艳,等.骨髓间质干细胞诱导为神经元样细胞移植治疗脑梗死模型大鼠后运动功能的改善〔J〕.中国病理生理杂志,2006;22(12):2401-6.
2 Kopen GC,Proekop DJ,Phinney DG.Marrow stromal cells migrate through out fore brain and cerebellum,and they differentiate into astrocytes after injection into neonatal mouse brains〔J〕.Proc Natl Acad Sci USA,2009;96(19):10711-6.
3 Carcia JH,Waner S,Liu KF,et al.Neurological deficit and extent of neuronal necrosis attributable to middle cerebral artery occlusion in rats statistical validation〔J〕.Stroke,1995;26(4):627-35.
4 张化彪,许予明,张苏明.体外诱导大鼠骨髓间质干细胞分化为神经样细胞的实验研究〔J〕.中国神经免疫学和神经病学杂志,2003;10(4):276-80.

