新型植物激素独角金内酯类化合物的电喷雾傅里叶变换离子回旋共振串联质谱研究
骆 丹,辛培勇,闫吉军,3,房 爽,孙晓红,闫 静,褚金芳,闫存玉
(1.中国科学院遗传与发育生物学研究所,国家植物基因研究中心(北京),北京 100101;2.黑龙江中医药大学药学院,黑龙江 哈尔滨 150040;3.青岛科技大学化工学院,山东 青岛 266042)
植物激素是植物体内合成的,参与调控植物生长发育、适应生物与非生物胁迫等植物生理过程的重要信号分子的总称,在极低浓度下即可发挥其生理作用。除了已发现和报道的传统类别植物激素,例如生长素、乙烯、细胞分裂素、赤霉素和油菜素等种类外,最新研究发现表明,独角金内酯(strigolactones,SLs)能够参与调控植物侧枝形成,是一类全新结构形式的植物激素[1-2]。SLs能够影响水稻等重要农作物的株型,进而影响其产量,在农业生产领域有着重要的研究价值。SLs是具有倍半萜内酯(sesquiterpene lactone)结构特征的植物信号分子,最初是在研究寄生植物独角金(striga)与宿主植物信号关系过程中发现的,宿主植物合成的SLs通过根系分泌并被寄生植物种子感知,诱导其种子萌发,并建立寄生关系[3];此外,当土壤中磷等营养元素缺乏时,植物根际分泌的SLs作为信号分子,还能够被根际微生物丛枝菌根真菌(AM fungi,arbuscular mycorrhizal fungi)识别,促进AM 真菌的菌丝形成和孢子萌发,从而帮助植物吸收土壤中的磷等营养元素[4]。植物界80%的植物可以与AM真菌形成共生关系,因此大部分的植物根际都分泌SLs[5],但是研究发现,对于不与AM菌根建立共生关系的植物,例如拟南芥,其根部也能够分泌SLs,部分植物的地上部分亦可检测到SLs,这些研究表明,SLs除了作为根部分泌的信号分子,可能也参与调控植物地上部分的生长发育[6-8]。目前,在植物研究领域发现和报道的SLs类化合物已经超过十几种,这类化合物极性较小,易溶于乙酸乙酯、丙酮和氯仿等有机溶剂中,其分子结构由ABC并环通过烯醚键连接D环构成,ABC并环和D环均具有内酯结构特征。利用遗传学手段,通过对模式植物拟南芥和水稻max和d系列突变体的研究发现,SLs均是通过类胡萝卜素合成途径多步酶催化反应合成的,其合成途径正处于深入研究阶段[9-11]。由于SLs类化合物结构多样,且广泛发现于多个物种中,其结构与功能关系是未来的重要研究方向[12-17]。基于电喷雾离子化的高分辨串联质谱技术能够为复杂结构天然产物的定性结构表征提供详尽可靠的数据和信息,能够与SLs植物生理功能研究互为补充,为深入研究此类植物信号分子的分子作用机制奠定基础。目前,系统性研究此类化合物质谱碎裂特征的结果还未见报道。
本工作分别选取具有结构代表性的3种SLs化合物作为研究对象,其结构式示于图1。系统地研究羟基化SLs(Strigol)、脱羟基化SLs(5-deoxystrigol,5-DS)和 人 工 合 成 类 似 物(GR24)正离子模式下高分辨串联质谱可能的碎裂规律,为进一步筛选和验证植物内源性SLs类化合物提供借鉴和帮助。
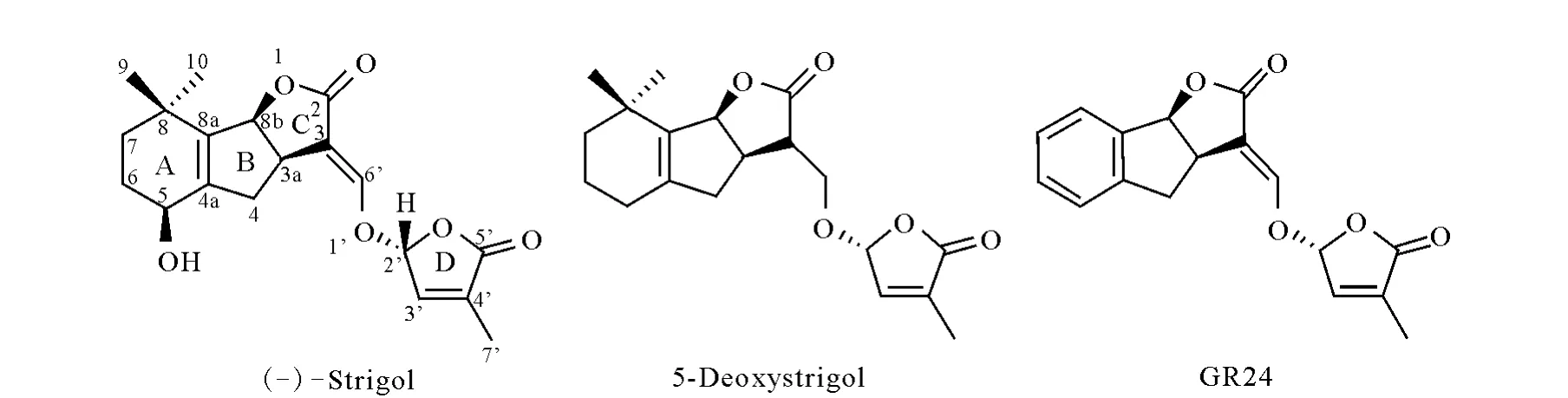
图1 3种代表性独角金内酯化合物的结构式Fig.1 The structures of 3representative model compounds of strigolactones
1 实验部分
1.1 仪器及实验条件
12TsolariX傅里叶变换离子回旋共振质谱仪(FTICR MS):德国Bruker Daltonics公司产品,直接进样方式。
质谱条件:样品流速2μL/min;毛细管喷雾电压4 500V;末端板补偿电压-500V;干燥气流速4.0L/min;雾化气压力100kPa;源温200℃;扫描区间m/z50~400;离子选择模式sweep;选择离子窗口宽度0.5u;串联质谱数据均在离子回旋池中进行采集(in cell模式),碰撞诱导解离模式为SORI CID,能量选择区间1%~2%。
1.2 主要材料与试剂
乙腈、超纯水:德国Fluka Diesenhofen公司产品;Strigol、5-Deoxystrigol:捷 克 OlChemIm Ltd公司产品;GR24:荷兰Chiralix BV公司产品。考虑到独角金内酯类化合物在质子化溶剂条件下的稳定性较差,首先将上述标准品溶解于乙腈中,配制成500μg/L储备液,备用。为获得稳定电喷雾离子化响应信号,将上述储备液用75%乙腈水溶液稀释至500ng/L,用于FTICR MS直接进样分析。
2 结果与讨论
实验中选择的SLs模型化合物具有此类化合物的代表性:GR24是A环为苯环的人工合成类似物,其合成成本相对较低,常用于替代昂贵的植物内源性SLs化合物,对SLs合成或信号途径发生突变的植物样本进行遗传学研究;Strigol和5-DS是分布广泛的独角金内酯类化合物,已被发现存在于多个物种中。依据SLs化合物的A/B环结构特征,可将目前已发现的独角金内酯类化合物区分为A环或B环羟基化和未羟基化两大类,因此本实验分别选择Strigol和5-DS作为上述两类SLs类化合物的模型化合物,重点探讨其串联质谱碎裂特征,为后期新型SLs类化合物的发现和定性表征提供借鉴和帮助。
2.1 SLs类化合物MS/MS中D环子离子特征
GR24、5-DS和Strigol的二级质谱图示于图2a,由图2a可见,上述3种化合物均能够产生m/z97.028 4的子离子,其途径是连接C环和D环的烯醚键发生断裂,产生D环碎片离子所致。D环子离子的产生不受ABC环的结构形式影响,羟基化或具有苯环结构特征A环的Strigol和GR24均能够产生D环碎片子离子,实验结果与部分文献具有一致性[17-20]。因此可以考虑在后续SLs类化合物筛选时,将其作为特征离子加以关注。
2.2 SLs类化合物MS/MS中H2O及CO中性丢失碎裂途径分析
值得注意的是,3种SLs模型化合物MS/MS谱中均有多重H2O及CO中性碎片丢失子离子产生。除[M+H]+能够直接产生的多重H2O及CO中性碎片丢失子离子外,MS/MS谱中还能够发现明显的ABC环失去H2O及CO中性碎片丢失子离子,例如[ABC+HH2O]+、[ABC+H-2H2O]+和[ABC+HH2O-CO]+等子离子,其归属信息列于表1。这些子离子的产生与SLs类化合物分子结构中的A环、C环和D环密切相关。其中,Stigol的5-OH是H2O中性碎片丢失的典型结构特征,因此其[M+H-H2O]+易于归属,脱水后的A环能够形成双烯共轭结构特征的子离子;而5-DS和GR24没有羟基修饰,其H2O和CO中性碎片丢失碎裂途径与具有羟基的SLs类化合物不同。根据文献报道,具有内酯结构特征的离子在碰撞诱导解离(CID)过程中,能够发生H2O中性碎片丢失现象[21]。SLs类化合物其分子的C环和D环分别是丁酸内酯和丁烯酸内酯结构,其内酯结构的醇羟基O具有较强的质子亲和势,质子化后的丁酸内酯和丁烯酸内酯发生开环裂解,同时,羰基的β位H通过重排转移至质子化的醇羟基,进而发生H2O和CO中性碎片丢失,其碎裂机理示于图2b。综合2.1和2.2的分析结果,SLs类化合物可能发生碰撞诱导解离的化学键位置示于图2c。
2.3 SLs类化合物 MS/MS中自由基子离子特征
尽管SLs类化合物不具备大共轭体系,但在其串联质谱信息中仍能发现典型的自由基子离子,例如5-DS谱图中的m/z234.125 05、m/z216.114 48 等,GR24MS/MS 谱 图 中 的m/z202.062 43。这些子离子均产生自D环中性碎片丢失,同时,对应于这些ABC环自由基子离子碎片,还有相应的D环、H2O和CO同时失去的子离子,如表1中所总结的[ABC+HH2O]+·、[ABC+H-2H2O]+和[ABC+HH2O-CO]+。说明SLs类化合物在发生D环中性丢失过程中,化学键的裂解主要是通过均裂产生,同时,得到的自由基子离子能够被C环的内酯羰基和α位的烯键共轭稳定,形成丰度较高的奇电子离子,而这些自由基子离子能够进一步发生更为复杂的碰撞诱导解离。以最具生物活性的水稻内源性SLs类化合物5-DS为例,其m/z234.125 05的[ABC+H]+·自由基子离子的MS/MS/MS三级质谱图示于图3a。
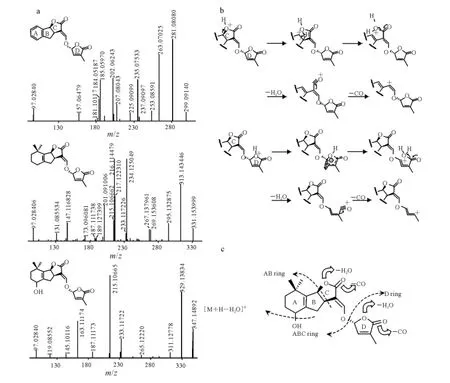
图2 GR24、5-DS和Strigol二级质谱图及可能的碎裂机理Fig.2 The MS/MS mass spectra of GR24,5-DS and Strigol and proposed fragmentation pathway

表1 3种SLs类化合物MS/MS子离子类别及对应质荷比信息Table 1 The category of SLs’fragment ions and corresponding mass to charge(m/z)information
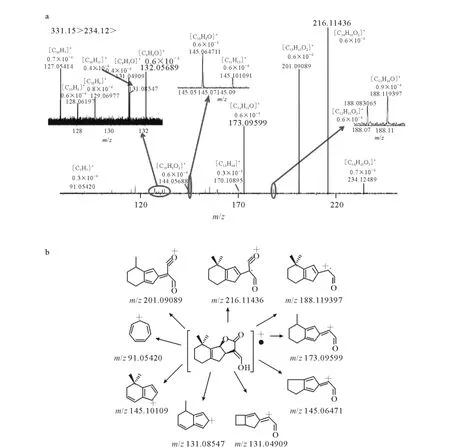
图3 5-DS自由基子离子[ABC+H]+·的三级质谱图及可能的碎裂途径Fig.3 The MS3 spectra of radical fragment ion[ABC+H]+and proposed fragmentation pathway
5-DS自由基离子[ABC+H]+的三级质谱表明,其三级子离子能够通过CH3中性碎片丢失碎裂途径得到更为稳定的偶电子三级子离子[ABC+H-H2O-CH3]+(m/z201.090 89),由于[ABC+H]+具有完整的ABC环结构,仍具备丁酸内酯结构特征,因此能够产生[ABC+H-H2O]+(m/z216.114 36)和[ABC+HH2O-CO]+(m/z173.095 99)三级子离子,进一步验证了SLs类化合物 MS/MS中H2O及CO中性丢失碎裂途径的分析结果。同时,在[ABC+H]+·的三级质谱图的低质量端,有较多具有多共轭结构特征的AB环三级子离子产生。其 中,m/z145 的 谱 峰 由 [C10H9O]+和[C11H13]+两组碎片离子组成;m/z131的谱峰由[C9H7O]+和[C10H11]+两组碎片离子组成,示于图3a。上述两组碎片离子的质荷比相差0.03u左右,得益于傅里叶变换离子回旋共振质谱仪的超高分辨率能够对其进行清晰区分,这些三级子离子进一步显示出自由基子离子发生碰撞诱导解离时其碎裂途径更为复杂,示于图3b。而低质量区丰富的碎片离子信息为SLs类化合物的定性表征提供了可靠数据保证。
3 结论
实验结果表明,傅里叶变换离子回旋共振质谱能够提供精准的串联质谱表征数据,初步阐述了SLs类化合物的质谱碎裂特征,尽管单纯依赖质谱手段还不能够对SLs类化合物进行完全的结构确认,其串联谱图中D环、H2O和CO等特征中性丢失途径和ABC环形成的自由基子离子,为后期开展植物内源性SLs类化合物结构定性研究和利用三重四极杆质谱仪进行此类化合物定量分析MRM通道选择奠定了基础。本工作就具有特征内酯结构形式的植物激素的H2O和CO中性丢失的机理进行了探讨,为具有类似结构特征的天然产物质谱分析提供借鉴。
[1] GOMEZ-ROLDAN V,FERMAS S,BREWER P B,et al.Strigolactone inhibition of shoot branching[J].Nature,2008,455(7 210):189-194.
[2] UMEHARA M,HANADA A,YOSHIDA S,et al.Inhibition of shoot branching by new terpenoid plant hormones[J].Nature,2008,455(7 210):195-200.
[3] COOK C,WHICHARD L,TURNER B,et al.Germination of witchweed (StrigaluteaLour.):isolation and properties of a potent stimulant[J].Science,1966,154(3 753):1 189-1 190.
[4] AKIYAMA K,MATSUZAKI K,HAYASHI H.Plant sesquiterpenes induce hyphal branching in arbuscular mycorrhizal fungi[J].Nature,2005,435(7 043):824-827.
[5] AKIYAMA K,Chemical identification and functional analysis of apocarotenoids involved in the development of arbuscular mycorrhizal symbiosis[J].Biosci Biotechnol Biochem,2007,71(6):1 405-1 414.
[6] FOO E,YONEYAMA K,HUGILL C,et al.Strigolactones:Internal and external signals in plant symbioses?[J].Plant Signal Behav,2013,8(3):e23168.
[7] RASMUSSEN A,MASON M G,DE CUYPER C,et al.Strigolactones suppress adventitious rooting in Arabidopsis and pea[J].Plant Physiol,2012,158(4):1 976-1 987.
[8] SCHACHTSCHABEL D,BOLAND W.Strigolactones:The first members of a new family of"shoot branching hormones"in plants? [J].Chembiochem,2009,10(2):221-223.
[9] RUYTER-SPIRA C,AL-BABILI S,VAN DER KROL S,et al.The biology of strigolactones[J].Trends Plant Sci,2013,18(2):72-83.
[10] RUIZ-SOLA M A,RODRIGUEZ-CONCEPCION M.Carotenoid biosynthesis in Arabidopsis:A colorful pathway[J].Arabidopsis Book,2012,10:e0158.
[11] ALDER A,JAMIL M,MARZORATI M,et al.The path from beta-carotene to carlactone,a strigolactone-like plant hormone[J].Science,2012,335(6 074):1 348-1 351.
[12] KOHLEN W,CHARNIKHOVA T,BOURS R,et al.Tomato strigolactones:A more detailed look [J]. Plant Signal Behav, 2012, 8(1):e22785.
[13] XIE X,YONEYAMA K,KISUGI T,et al.Confirming stereochemical structures of strigolactones produced by rice and tobacco[J]. Mol Plant,2013,6(1):153-163.
[14] DELAUX P M,XIE X,TIMME R E,et al.Origin of strigolactones in the green lineage[J].New Phytol,2012,195(4):857-871.
[15] LIANG J,ZHAO L,CHALLIS R,et al.Strigolactone regulation of shoot branching in chrysanthemum (Dendranthemagrandiflorum)[J].J Exp Bot,2010,61(11):3 069-3 078.
[16] KISUGI T,XIE X,KIM H I,et al.Strigone,isolation and identification as a natural strigolactone fromHouttuyniacordata[J].Phytochemistry,2013,87:60-64.
[17] AWAD A,SATO D,KUSUMOTO D,et al.Characterization of strigolactones,germination stimulants for the root parasitic plants striga and orobanche,produced by maize,millet and sorghum[J].Plant Growth Regulation,2006,48(3):221-227.
[18] YOKOTA T,SAKAI H,OKUNO K,et al.Alectrol and orobanchol,germination stimulants for Orobanche minor,from its host red clover[J].Phytochemistry,1998,49(7):1 967-1 973.
[19] XIE X,YONEYAMA K,KUSUMOTO D,et al.Isolation and identification of alectrol as (+)-orobanchyl acetate,agermination stimulant for root parasitic plants[J].Phytochemistry,2008,69(2):427-431.
[20] XIE X,KUSUMOTO D,TAKEUCHI Y,et al.2’-Epi-orobanchol and solanacol,two unique strigolactones,germination stimulants for root parasitic weeds,produced by tobacco[J].J Agric Food Chem,2007,55(20):8 067-8 072.
[21] DONOVAN T,BRODBELT J.Characterization of the dissociation behavior of gas-phase protonated and methylated lactones[J].Journal of the American Society for Mass Spectrometry,1992,3(1):47-59.

