高密度脂蛋白亚组分促胆固醇逆转运及抗氧化功能研究*
谭迎,田迪,刘挺榕,赖文岩,郭志刚
高密度脂蛋白(HDL)是一个复杂的多功能蛋白复合体,可通过其促进胆固醇逆转运、抗炎、抗氧化及抗血栓形成等多种功能发挥抗动脉粥样硬化作用,其中,促胆固醇逆转运功能最为关键。然而,最近的研究发现,在急性期反应、慢性炎症以及一些代谢性疾病中,HDL的抗动脉粥样硬化减弱,甚至出现致动脉粥样硬化作用[1-3]。Shao 等[4]研究证实,氧化损伤可损害HDL主要组成蛋白载脂蛋白A-I(apoA-I)促胆固醇逆转运功能,其机制可能与HDL发生氧化修饰有关。Heinecke等[5]发现从冠心病患者血浆分离出的HDL中髓过氧化物酶的两种产物(氯酪氨酸和硝基酪氨酸)均明显升高,推测冠心病患者HDL抗氧化功能可能受到了损害。急性冠状动脉(冠脉)综合征(ACS)发生时,机体处于一种特殊的炎症及氧化应激状态,因此我们推测ACS的发生可能损害HDL胆固醇逆转运及抗氧化功能,从而使HDL抗动脉粥样硬化作用减弱甚至出现致动脉粥样硬化作用。HDL亚组分主要由HDL2和HDL3组成,目前国内外关于HDL2和HDL3抗动脉粥样硬化作用的强弱仍存在许多争议。为此,本研究通过检测健康人群及ACS患者HDL亚组分介导的胆固醇转出率及脂氢过氧化物(LOOH)水平,以明确ACS患者HDL亚组分促胆固醇逆转运及抗氧化功能是否受到了损害,同时探讨HDL2和HDL3抗AS作用的强弱。
1 对象和方法
研究对象:2011-01至2012-01选取我院心内科住院的ACS患者(ACS组)40例,男27例,女13例,平均年龄(51.5±6.2)岁。入选标准:经确诊的ACS患者应符合不稳定性心绞痛临床表现、冠状动脉(冠脉)造影示至少有一支血管狭窄>50%、心肌酶谱及肌钙蛋白升高和/或心电图有动态改变。排除标准:高血压未控制平稳、糖尿病、肝肾功能异常、甲状腺功能异常、肿瘤、自身免疫性疾病、任何急性或慢性炎症性疾病、甘油三酯≥5mmol/L及体重指数(BMI)≥30 kg/m2者、近6周内服用调脂药物者。我院同期健康体检者(对照组)40例,男27例,女13例,平均年龄(49.2±5.0)岁,无冠心病及高脂血症病史,除外高血压、糖尿病、肝肾功能异常、甲状腺功能异常、肿瘤、自身免疫性疾病、任何急性或慢性炎症性疾病及血脂代谢异常相关疾病者。本研究已通过伦理委员会批准,所有入选者均为自愿参加本研究并签署知情同意书。
血脂及高敏C-反应蛋白(hs-CRP)检测:抽取两组人群清晨空腹静脉血5ml,静置30 min后离心取血清,置于-80℃冰箱保存备用。采用酶学终点比色法在全自动生化分析仪上检测血清总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)及高密度脂蛋白胆固醇(HDL-C)浓度;采用透射比浊法检测血清高敏C-反应蛋白浓度。
高密度脂蛋白亚组分(HDL2和HDL3)分离提取:采用Karlsson等[6]两步非连续性超高速密度梯度离心方法分离提取HDL亚组分。乙二胺四乙酸(EDTA)抗凝全血20ml,离心后收集血浆并加入乙二胺四乙酸(1mg/ml)和蔗糖(终浓度0.5%)以防HDL氧化和凝集。用固体溴化钾(0.3816 g/ml)调整血浆(取4ml)密度至1.24 g/ml,置于规格为8.9ml离心管底部,上缓慢加入溴化钾/磷酸盐缓冲液(0.0834 g/ml,密度1.063 g/ml),用考马斯亮蓝着色蛋白(此试管作为分离收集HDL的参考)。配平后置于超高速离心机(Beckman L-80 XP,Ti90转子,固定转角,购自美国基因仪器公司)中以290000 g于15℃离心4 h,离心后离心管上层为及低密度脂蛋白和低密度脂蛋白,中层为HDL2和HDL3。用注射器穿刺离心管分别抽取HDL2和HDL3,置两离心管中,再于其上分别缓慢加入溴化钾/PBS溶液(0.3816 g/ml,密度至 1.24 g/ml),290000 g于15℃离心2 h后,HDL2和HDL3均漂浮于离心管上层,分别收集上层液体。将两种液体分别在含200 μmol/L乙二胺四乙酸的磷酸盐缓冲液中透析48 h,超滤除菌,4℃保存。
高密度脂蛋白亚组分介导的巨噬细胞氚三胆固醇转出率检测[7]:将J774巨噬细胞(美国,American Type Culture Collection公司)接种在24孔培养板上(细胞浓度2×105/ml),以 DMEM 培养液(含 0.2%BSA)于37℃、5%CO2培养箱中静置培养,同时在培养液中加入氚三胆固醇(终浓度1μCi/mL;美国PerkinElmer公司)及促进细胞吸收胆固醇的氧化低密度脂蛋白(终浓度30 μg/ml),培养24 h后弃去培养基,以无血清DMEM培养液洗涤2次后,再次加入DMEM全培养液(含0.2%BSA)及8-溴-磷酸腺苷(8-Br-cAMP终浓度0.3mmol/L)培养12 h后去培养液。以无血清DMEM培养液洗涤1次,再次加入DMEM全培养液(含0.2%BSA),同时加入待测的 HDL2或 HDL3(50 μg/ml),4 h后收集培养液并用0.45 μm玻璃纤维过滤器过滤后移出细胞碎片,细胞用磷酸盐平衡盐溶液洗涤并用1ml氢氧化钠(0.1 mol/L)完全溶解。最后利用液闪计数仪检测细胞溶解物及细胞介质的氚三放射量。氚三胆固醇转出率用细胞介质中氚三胆固醇放射量占总放射量(细胞内+细胞介质)的百分比表示。
高密度脂蛋白亚组分(HDL2和HDL3)脂氢过氧化物(LOOH)含量检测[8]:采用二甲苯酚橙显色实验法检测。取 HDL2或 HDL3溶液 90 μl,加 10 μl硫胺素焦磷酸(10mmol/L)或甲醇混匀,37℃反应30 min;加入 FOX 反应液(250 μmol/L 硫酸亚铁、100 μmol/L二甲酚橙、25mmol/L H2SO4、4mmol/L 2,6-二叔丁基对甲酚,溶于90%甲醇中)900 μl,混匀,室温反应30 min;室温下12000 g离心5 min。取上清液测D560 nm值,以加与不加硫胺素焦磷酸两管的D 560 nm值之差计算LOOH含量。
统计学分析:采用SPSS 13.0统计软件进行统计分析,计量资料以均数±标准差表示。检验各组变量正态分布情况,非正态分布的变量经对数转换后使之正态化后再分析;采用F检验进行方差齐性检验,两样本均数比较采用t检验,P<0.05为差异有统计学意义。
2 结果
两组基本临床资料比较:与对照组比较,ACS组血清LDL-C水平及高敏C-反应蛋白浓度均明显升高,差异具有统计学意义(P<0.05~0.001);两组年龄、总胆固醇、甘油三酯及HDL-C水平比较,差异均无统计学意义(P>0.05)。表1
表1 两组基本临床资料比较()
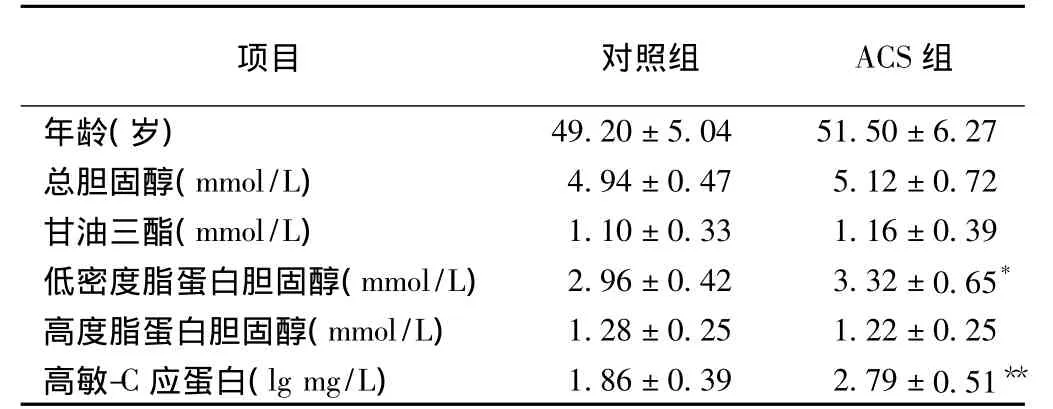
表1 两组基本临床资料比较()
注:与对照组比较*P=0.004 **P<0.001
?
两组HDL亚组分(HDL2和HDL3)介导的巨噬细胞氚三胆固醇转出率比较:ACS组HDL2、HDL3介导的氚三胆固醇转出率均低于对照组,差异具有统计学意义(P均<0.001)。表2
表2 两组HDL亚组分HDL2和HDL3促胆固醇逆转运及抗氧化功能比较()

表2 两组HDL亚组分HDL2和HDL3促胆固醇逆转运及抗氧化功能比较()
注:与对照组比较*P<0.001;与同组内 HDL2比较△P<0.05△△P<0.001 ACS:急性冠脉综合征;LOOH:脂氢过氧化物;HDL:高密度脂蛋白
?
两组HDL亚组分(HDL2和HDL3)LOOH水平比较:与对照组相比,ACS组HDL亚组分的HDL2-LOOH及HDL3-LOOH水平均升高,差异均具有统计学意义(P均<0.001)。表2
两组同组内HDL亚组分HDL2和HDL3功能比较:对照组及ACS组的HDL3介导的巨噬细胞氚三胆固醇转出率均较HDL2明显下降,差异均有统计学意义(P<0.05);对照组及ACS组的HDL亚组分HDL3-LOOH水平则均较HDL2-LOOH明显升高,差异均有统计学意义(P<0.05~0.001)。表2
3 讨论
近年来,大量研究证实HDL功能较高密度脂蛋白胆固醇(HDL-C)水平更能预测动脉粥样硬化及冠心病发生风险,其中HDL介导的逆胆固醇转运功能尤为重要。2011年Khera等[9]在新英格兰杂志上发表的文章显示:HDL-C与颈动脉内膜中层厚度(IMT)之间无明显相关关系,而HDL介导的巨噬细胞胆固醇转出率与颈动脉内膜中层厚度(IMT)和冠心病发生风险呈高度负相关,此相关关系独立于 HDL-C水平,表明HDL介导的促胆固醇逆转运功能可独立于HDL-C水平更好地预测AS及冠心病发生风险。本研究两组人群HDL-C水平无统计学差异,但ACS组患者促胆固醇逆转运功能较正常对照组明显下降(P<0.001),直接表明了HDL-C水平并不能完全代表HDL功能,进一步确证了HDL促胆固醇逆转运功能可独立于HDLC水平更好地预测AS发生风险。结构决定功能,对HDL亚组分结构及改善HDL功能药物的研究有望为AS及冠心病的防治提供新的干预手段。
炎症反应在ACS的发生发展中起重要作用,本研究ACS组患者较对照组高敏C-反应蛋白明显升高,亦可说明[10]。严晓伟等[11]报道显示,炎症性疾病中,HDL中磷脂含量降低、载脂蛋白A-I的氧化及糖基化修饰等均可以导致HDL与巨噬细胞的结合减少,从而使HDL介导的细胞内胆固醇的外流受抑制。与其报道相一致,我们的研究发现ACS的发生可使HDL亚组分介导的细胞内胆固醇的外流受抑制,其机制可能与炎症条件下HDL亚组分结构重塑及组成蛋白的改变有关。
脂氢过氧化物(LOOH)是评估HDL抗氧化功能的一个重要指标。它可通过与HDL结合氧化HDL,导致HDL抑制氧化型低密度脂蛋白产生的能力减弱,甚至使HDL出现促氧化作用。研究发现,在全身炎症的条件下,HDL的结构会被修饰,从而降低了其抗炎抗氧化功能,甚至促进氧化型低密度脂蛋白(ox-LDL)的形成加重斑块内的炎症反应[12]。本研究显示,与对照组比较,ACS患者HDL亚组分LOOH水平明显升高(P<0.001),证实ACS的发生可损害HDL亚组分的抗氧化功能,甚至可能使HDL亚组分转变为具有促氧化作用的失功能颗粒加剧ACS的发展。Alwail等[10]等通过蛋白组学方法发现,与正常对照组相比,急性冠脉综合征组患者其HDL组成发生改变,蛋白载脂蛋白A-IV水平较对照组显著减少,而血清淀粉样蛋白A(SAA)及补体3(C3)等炎症蛋白则较对照组明显增加,表明ACS患者HDL中炎性蛋白的增加可能是HDL发生失功能改变的重要机制。
血浆中HDL亚组分主要以HDL2和HDL3为主,HDL3为小的、密度较大、未成熟的颗粒,HDL2为大的、密度较小、成熟的颗粒[13]。研究发现,HDL2较HDL3包含有更多的载脂蛋白A-I(apoA-I),而HDL3包含有更多的载脂蛋白A-Ⅱ(apoA-Ⅱ),且其与载脂蛋白L-I、载脂蛋白F、载脂蛋白A-IV、载脂蛋白M、载脂蛋白J、载脂蛋白D、屛氧酶1、屛氧酶3和血清淀粉样蛋白 A(SAA)等蛋白更为相关[14,15]。大量研究证实HDL2较HDL3具有更好地心血管保护作用,但亦有一些专家认为,二者具有同等程度的心血管保护作用[16,17]。本研究证实,HDL2较 HDL3有更强的促胆固醇逆转运及抗氧化功能,提示HDL2可能较HDL3具有更好的心血管保护作用。有报道显示,血清淀粉样蛋白A可选择性损害HDL3促胆固醇逆转运功能[14],因而推测血清淀粉样蛋白A可能是HDL亚组分功能差异的重要因素。
总之,本研究证实,ACS的发生可损害HDL亚组分的促胆固醇逆转运及抗氧化功能,这也直接表明HDL-C水平并不能完全代表HDL功能,HDL亚组分介导的促胆固醇逆转运功能可独立于HDL-C水平更好地预测动脉粥样硬化和冠心病发生风险。同时还发现HDL2较HDL3具有更强的促胆固醇逆转运及抗氧化功能,其具体机制尚未明确。可见,对异常HDL功能的评估及HDL亚组分的深入研究是十分必要的,有望为动脉粥样硬化及冠心病的防治提供新的思路。此外,由于时间的限制,本研究仍存在不足之处,即缺少稳定性心绞痛组与ACS组进行对照,无法明确HDL亚组分功能在稳定性心绞痛患者和ACS患者是否亦存在差异,更进一步的深入研究有待进行。
[1]Ansell BJ,Watson KE,Fogelman AM,et al.High-density lipoprotein function recent advances.J Am CoU Cardiol,2005,46:1792-1798.
[2]deGoma EM,deGoma RL,Rader DJ.Beyond high-density lipoprotein cholesterol levels evaluating high-density lipoprotein function as influenced by novel therapeutic approaches.J Am Coll Cardiol,2008,51:2199-2211.
[3]Sviridov D,Mukhamedova N,Remaley AT,et al.Antiatherogenic functionality of high density lipoprotein:how much versus how good.J Atheroscler Thromb,2008,15:52-62.
[4]Shao B,Oda MN,Oram JF,et al.Myeloperoxidase:an inflammatory enzyme for generating dysfunctionalhigh density lipoprotein.Curr.Opin.Cardiol,2006,21:322-328.
[5]Heinecke JW.The HDL proteome:a marker-and perhaps mediator-of coronary artery disease.J Lipid Res,2009,50:S167-S171.
[6]Karlsson H,Leanderson P,Tagesson C,et al.LipoproteomicsⅡ:Mapping of proteins in high-density lipoprotein using two-dimensional gelelectrophoresis and mass spectrometry.Proteomics,2005,5:1431-1445.
[7]Berrougui H,Isabelle M,Cloutier M,et al.Age-related impairment of HDL-mediated cholesterol efflux.J Lipid Res,2007,48:328-336.
[8]Nourooz-Zadeh J,Tajaddini-Sarmadi J,Wolff SP.Measurement of plasma hydroperoxide concentrations by the ferrous oxidation-oxylenol orange assay in conjunction with triphenylphosphin.Anal Biochem,1994,220:403-409.
[9]Khera AV,Cuchel M,de la Llera-Moya M,et al.Cholesterol efflux capacity,high-density lipoprotein function,and atherosclerosis.N Engl J Med.2011,364:127-135.
[10]Alwaili K,Bailey D,Awan Z,et al.The HDL proteome in acute coronary syndromes shifts to an infl ammatory profl le.Biochim Biophys Acta.,2012,1821:405-415.
[11]严晓伟,包婺平.疾病状态下高密度脂蛋白的功能缺陷.中国循环杂志,2007,22:152-154.
[12]Patel PJ,Khera AV,Jafri K,et al.The Anti-Oxidative Capacity of High-Density Lipoprotein Is Reduced in Acute Coronary Syndrome But Not in Stable Coronary Artery Disease.JACC,58,2011:2068-2075.
[13]Singh IM,Shishehbor MH,Ansell BJ.High-density lipoprotein as a therapeutic target:a systematic review.JAMA,2007,298:786-98.
[14]Eren E,Yilmaz N,Aydin O,et al.High Density Lipoprotein and it’s Dysfunction.Open Biochem J,2012,6:78-93.
[15]Asztalos BF,Tani M,Schaefer EJ.Metabolic and functional relevance of HDL subspecies.Curr Opin Lipidol,2011,22,176-185.
[16]Movva R,Rader DJ.Laboratory Assessment of HDL Heterogeneity and Function.Clin Chem,2008,54,788-800.
[17]Gao X,Yuan S,Jayaraman S,et al.Differential stability of high-density lipoprotein subclasses:effects of particle size and protein composition.J Mol Biol,2009,387,628-638.

