TLR基因在人肺腺癌细胞和支气管上皮细胞中的表达!
喻 钧, 潘铁成, 魏 翔, 李 军, 潘友民, 刘立刚, 胡 敏
华中科技大学同济医学院附属同济医院心胸外科,武汉 430030
Toll样受体家族(Toll-like receptors,TLRs)属模式识别受体,是非常重要的天然免疫分子。目前国内外对于TLRs的研究大多集中于感染、自身免疫性疾病、内源性损伤疾病及器官移植后的排斥反应等免疫学方面。随着天然免疫研究的不断发展,人们逐渐关注TLRs和机体肿瘤的关系[1]。近来发现,部分TLRs基因序列的多态性与某些肿瘤的发生存在相关性;某些肿瘤细胞表面表达的TLRs则与肿瘤的免疫逃逸有关。肺癌是人类最常见的恶性肿瘤之一,其中非小细胞肺癌占80%。而腺癌相对于鳞癌恶性度更高,预后更差,因此,了解肺腺癌的发生发展机制有助于制定肺癌治疗的更优方案。本实验通过实时定量PCR的方法检测TLR2、TLR3、TLR9基因在人肺腺癌细胞(A549细胞)和人正常支气管上皮细胞(HBE细胞)之间的表达差异,为进一步研究TLRs基因在肺腺癌发生发展中的作用奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验细胞 人肺腺癌细胞株A549细胞和人支气管上皮细胞株HBE细胞为本实验室所有,均购自ATCC公司。
1.1.2 酶类及试剂 Taq酶购自TaKaRa公司;Trizol购自美国Invitrogen公司;逆转录酶MMLV、琼脂糖、DNA marker购自美国Promega公司;dNTP、Oligo dT、RNA 酶抑制剂、DEPC购自 MBI Fermentas公司;RNA抽提试剂盒购自美国Invtrogen公司;SYBR Master Mixture购自 TaKaRa公司;DMEM/F12 1∶1培养液、胰蛋白酶购自美国Invitrogen公司;特优级胎牛血清购于美国Gibco公司;总蛋白提取试剂盒购自SBS Genetech公司;鼠抗人TLR2、TLR3、TLR9单克隆抗体购自Bio-Legend公司;GAPDH购自北京博大泰克公司;二抗试剂盒购于北京中杉试剂公司。
1.2 细胞培养
A549细胞和HBE细胞培养在含有10%胎牛血清、青霉素、链霉素各100U/mL的DMEM培养液中,置37℃饱和湿度含5%CO2的恒温箱中无菌培养。0.25%胰蛋白酶消化传代。取指数生长期的A549细胞,以1×106/mL细胞接种于10cm培养皿中,细胞长至80%融合时,弃去含10%胎牛血清DMEM培养液,Hank’s液洗2次,换以新鲜无血清培养液待用。
1.3 QReal-time PCR反应
按照说明用Trizol提取细胞总RNA,并逆转录得到cDNA。QReal-time PCR在Bio-rad的iQ5上完成。QReal-time PCR反应体系 :每管加入SYBR premix ex taq 10μL,上游引物(5μmol/L)0.5μL,下游引物(5μmol/L)0.5μL,cDNA 1.0μL,水8.0 μL。设定程序为两步法Real-Time定量:预变性95℃、15s,之后每一步变性95℃、5s,退火延伸60℃、30s,共进行45个循环。每次在延伸阶段读取吸光值。PCR结束后,在95℃变性1min,然后冷却至55℃,使DNA双链充分结合,从55℃开始到95℃,每一步增加0.5℃,保持30s,同时读取吸光度值,制作熔解曲线。将PCR产物进行琼脂糖凝胶电泳,观察PCR扩增的特异性。通过GenBank网站查找基因全序列,根据引物设计原则应用软件Primer 5.0设计引物序列,见表1。

表1 TLR2、TLR3、TLR9基因引物序列Table 1 The primer sequences of TLR2,TLR3and TLR9gene
1.4 免疫印迹法
收集细胞,PBS洗涤2次,加入细胞裂解液100 μL,12 000r/min离心15min,定量蛋白。取20μg蛋白,加入上样缓冲液,95℃下变性10min。10%~15%的聚丙烯酰胺SDS凝胶电泳后,电转移至硝酸纤维膜上,以5%脱脂牛奶封闭后依次加入一抗、二抗,在室温下孵育2h,TBST缓冲液(10mmol/L Tris-HCl,pH7.4,150mmol/L NaCl,0.1%Tween20)洗涤3次,每次10min,暗室ECL显色。阳性条带以Gelpro4版凝胶吸光度分析软件进行分析,取平均吸光度值,以 GAPDH 为对照,检测TLRs的相对表达量。
1.5 统计学方法
全部数据采用SPSS 12.0软件进行分析,实验数据以±s表示,组间均数比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 PCR产物的鉴定
以A549、HBE细胞的cDNA为模板,分别用TLR2、TLR3、TLR9和β-actin引物扩增目的基因和内参基因,取5μL各PCR产物进行1%琼脂糖凝胶电泳鉴定,结果显示扩增产物符合预期片段大小(图1)。
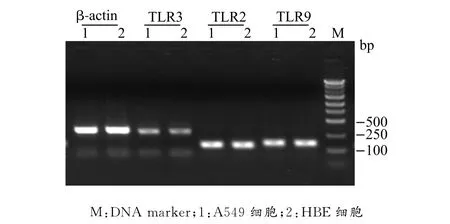
图1 TLRs基因RT-PCR产物琼脂糖凝胶电泳图Fig.1 The agarose gel electrophoresis image showing TLRs gene products
2.2 QReal-time PCR检测TLRs mRNA的表达
QReal-time PCR结果用iQ5序列检测系统软件制作扩增曲线(图2A)。然后运用比较阈值法计算目的基因相对于管家基因的定量[2]。输出Ct值,参照2-ΔΔCt数据分析法,进行相对定量计算,比较TLR3、TLR2、TLR9基因在A549和HEB细胞中的表达。实验结果可见这2种细胞中都有上述基因的表达,A549细胞中这3种基因的表达丰度均比在HBE细胞中高(均P<0.01)(图2B)。PCR结束后,绘出每个样品的熔解曲线,熔解曲线是扩增反应的质控途径,结果表明实验中未出现污染、引物二聚体和非特异性扩增,说明QReal-time PCR产物纯度较高,反应具有良好的特异性。

图2 TLRs基因QReal-time扩增曲线(A)及相对表达量(B)Fig.2 The amplification curve of quantitative real-time PCR products(A)and the relative expression of TLRs genes(B)
2.3 Western blot检测TLRs的表达
TLR2、TLR3、TLR9蛋白在A549细胞中的表达相对值分别为(0.472 8±0.010 3)、(0.319 3±0.011 2)和(0.856 9±0.007 9),而在 HBE细胞中的表达相对值分别为(0.258 5±0.005 7)、(0.160 7±0.003 0)和(0.699 1±0.010 0),A549细胞中TLR2、TLR3、TLR9蛋白表达水平均高于HBE细胞,差异有统计学意义(均P<0.01),见图3。
3 讨论
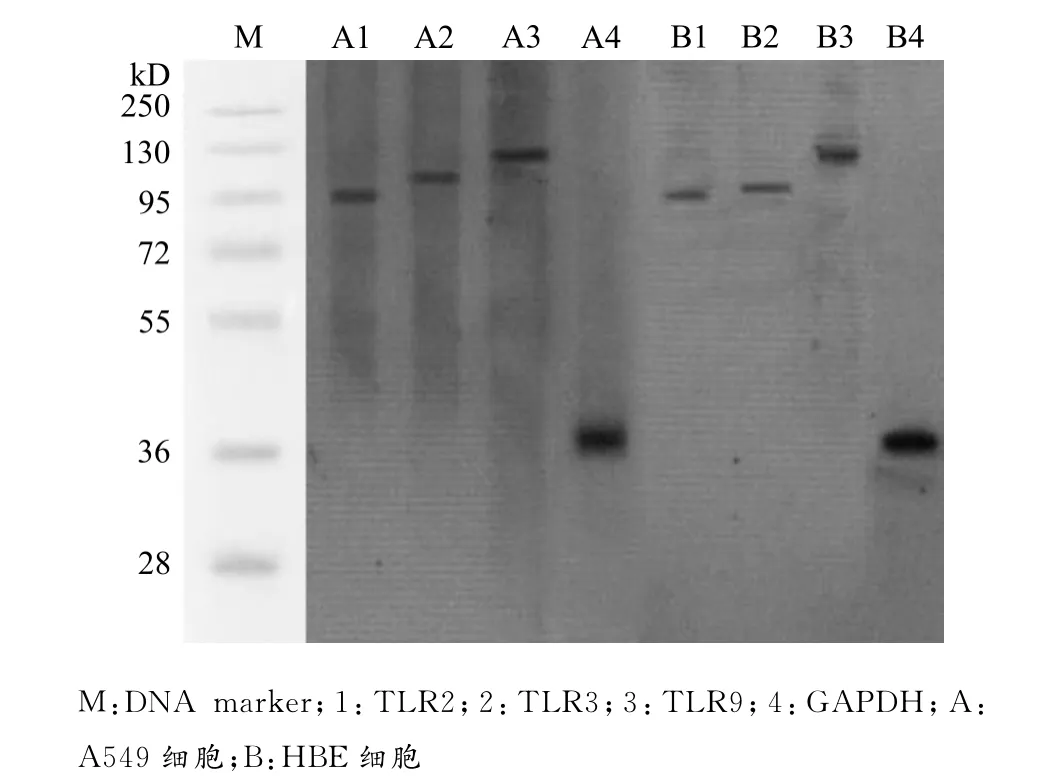
图3 Western blot检测TLRs蛋白在A549和HBE细胞中的表达Fig.3 Western blot analysis of the expression of TLRs proteins
Toll样受体家族(Toll-like receptors,TLRs)成员们属模式识别受体,它们广泛分布于免疫细胞以及上皮细胞表面,通过识别不同病原体的PAMP(pathogen-associated molecular pattern,PAMP)在天然免疫中发挥重要作用。TLRs识别的PAMP是一类高度保守的分子结构,这些分子结构存在于细菌、真菌和病毒。TLRs与PAMP相互作用,引发的信号传导能导致炎症介质的释放,在天然免疫防御中起重要作用,并最终激活获得性免疫系统,并被视为联系天然免疫和获得性免疫的桥梁[3]。目前已经检测到多种细胞表达TLR,包括不同的树突状细胞(DCs)亚群、T细胞、中性粒细胞、嗜酸性粒细胞、肥大细胞、单核细胞和多种上皮细胞。CD4十CD25十调节性T细胞上也有TLRs的表达[4]。
近年来随着天然免疫研究的不断发展,人们逐渐关注TLRs和机体肿瘤的关系。不少文献报道,TLR基因多态性和肿瘤的发生有着联系。研究表明TLR4基因序列的单核苷酸多态性(single nucleotide polymorphisms,SNP)位点与前列腺癌的发生存在相关性[5],TLR6-TLR1-TLR10基因簇序列的多态性也与前列腺癌的发生具有相关性[6]。人们亦在临床工作中发现炎症反应和手术中的细菌感染有可能引起肿瘤的恶化、迁移,多项实验证实脂多糖(LPS,TLR4的配体)在这一现象中起到了关键作用[7-8]。Luo等[9]证实 LPS可以通过炎症反应促进肿瘤生长,证明了TLR4是该作用的必要启动者,NF-κB参与了这一过程。幽门螺杆菌激活了胃上皮细胞上的TLR2和TLR9,可增加COX-2的表达进而促进胃癌进展[10]。
不少学者研究发现多种肿瘤细胞表面也表达多种TLRs,并且与肿瘤细胞的免疫逃逸密切相关。多种小鼠肿瘤细胞表面表达多种TLRs,用LPS刺激TLR4,发现细胞培养上清液能够显著抑制T细胞的增殖及NK细胞的活化[11]。TLR配体也参与调控树突状细胞的发育成熟及功能[12]。随着近年来对TLRs内源性配体的研究表明,肿瘤在进展中释放细胞内分子如HSPs、基质降解产物如纤连蛋白额外区A和硫酸肝素,释放的细胞内分子可能作为内源性配体通过TLR信号传导诱导持续的低度炎症反应,导致骨髓抑制细胞聚集,随后T细胞和NK细胞的受体下调,导致免疫抑制[13-15]。这可能对肿瘤的生长起到了一定的作用。
本实验采用 QReal-time PCR 及 Western blot检测TLR3、TLR2、TLR9在A549细胞及HBE细胞中的表达。结果显示TLR3、TLR2、TLR9mR-NA和蛋白在A549细胞中的表达均明显高于HBE细胞,提示TLRs基因可能参与人肺腺癌细胞的发生发展,其具体机制有待进一步研究。
[1] Chen R,Alvero A B,Silasi D A,et al.Cancers take their Tollthe function and regulation of Toll-like receptors in cancer cells[J].Oncogene,2008,27(2):225-233.
[2] Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))method[J].Methods,2001,25(4):402-408.
[3] Sabroe I,Parker L C,Dower S K,et al.The role of TLR activation in inflammation[J].J Pathol,2008,214(2):126-135.
[4] Iwasaki A,Medzhitov R.Toll-like receptor control of the adaptive immune responses[J].Nat Immunol,2004,5(10):987-995.
[5] Zheng S L,Augustsson-Balter K,Chang B,et al.Sequence variants of toll-like receptor 4are associated with prostate cancer risk:results from the Cancer Prostate in Sweden Study[J].Cancer Res,2004,64(8):2918-2922.
[6] Sun J,Wiklund F,Zheng S L,et al.Sequence variants in Tolllike receptor gene cluster(TLR6-TLR1-TLR10)and prostate cancer risk[J].J Natl Cancer Inst,2005,97(7):525-532.
[7] Harmey J H,Bucana C D,Lu W,et al.Lipopolysaccharide-induced metastatic growth is associated with increased angiogenesis,vascular permeability and tumor cell invasion[J].Int J Cancer,2002,101(5):415-422.
[8] Pidgeon G P,Harmey J H,Kay E,et al.The role of endotoxin/lipopolysaccharide in surgically induced tumour growth in a murine model of metastatic disease[J].Br J Cancer,1999,81(8):1311-1317.
[9] Luo J L,Maeda S,Hsu L C,et al.Inhibition of NF-kappaB in cancer cells converts inflammation-induced tumor growth mediated by TNFalpha to TRAIL-mediated tumor regression[J].Cancer Cell,2004,6(3):297-305.
[10] Chang Y J,Wu M S,Lin J T,et al.Induction of cyclooxygenase-2overexpression in human gastric epithelial cells by Helicobacter pylori involves TLR2/TLR9and c-Src-dependent nuclear factor-kappaB activation[J].Mol Pharmacol,2004,66(6):1465-1477.
[11] Huang B,Zhao J,Li H,et al.Toll-like receptors on tumor cells facilitate evasion of immune surveillance[J].Cancer Res,2005,65(12):5009-5014.
[12] Hermans I F,Silk J D,Gileadi U,et al.Dendritic cell function can be modulated through cooperative actions of TLR ligands and invariant NKT cells[J].J Immunol,2007,178(5):2721-2729.
[13] Vabulas R M,Ahmad-Nejad P,da Costa C,et al.Endocytosed HSP60suse toll-like receptor 2(TLR2)and TLR4to activate the toll/interleukin-1receptor signaling pathway in innate immune cells[J].J Biol Chem,2001,276(33):31332-31339.
[14] Okamura Y,Watari M,Jerud E S,et al.The extra domain A of fibronectin activates Toll-like receptor 4[J].J Biol Chem,2001,276(13):10229-10233.
[15] Johnson G B,Brunn G J,Platt J L.Cutting edge:an endogenous pathway to systemic inflammatory response syndrome(SIRS)-like reactions through Toll-like receptor 4[J].J Immunol,2004,172(1):20-24.

