TCDD激活芳香烃受体减轻小鼠肾脏缺血再灌注损伤*!
蔡兰军, 余道武, 高 义, 杨 超, 周鸿敏, 陈忠华△
1华中科技大学同济医学院附属同济医院器官移植研究所,器官移植教育部/卫生部重点实验室,武汉 430030
2重庆医科大学附属永川医院肝胆外科,重庆 402160
3华中科技大学同济医学院附属同济医院胸心外科,武汉 430030
缺血再灌注损伤(ischemia-reperfusion injury,IRI)是器官移植中影响移植物存活的重要因素,可导致移植物短期和长期功能损害,包括易于发生移植物原发性无功能、急性排斥反应、慢性移植物失功等,目前尚无特殊有效的治疗手段。以往关于IRI的研究主要集中在非免疫因素上,但是近来有直接证据表明调节性T细胞(Treg细胞)对IRI器官具有保护作用[1-2]。而据文献报道2,3,7,8-四氯联苯对二 恶 英 (2,3,7,8-tetrachlorodibenzo-p-dioxin,TCDD)激活芳香烃受体(aryl hydrocarbon receptor,AHR)可以选择性诱导Treg细胞亚群扩增,同时抑制 Th17的分化[3-6];TCDD通过激活 AHR诱导Treg细胞扩增使小鼠胰岛移植达到免疫耐受已有报道[7],但激活AHR能否减轻IRI尚无明确实验证据。本研究旨在探讨是否可以通过TCDD激活AHR而诱导Treg细胞亚群的扩增,从而发挥减轻小鼠肾脏IRI的作用。
1 材料与方法
1.1 实验动物
清洁级雄性近交系 C57BL/6(H-2b)小鼠,8~10周龄,体重20~25g,来自华中科技大学同济医学院附属同济医院器官移植研究所动物中心。标准条件饲养(清洁条件,55% 湿度,12h日/夜),动物实验过程经华中科技大学同济医学院附属同济医院伦理委员会审核通过。
1.2 肾脏IRI模型的建立及实验分组
据文献报道[8]建立小鼠肾脏IRI模型。腹腔注射1%戊巴比妥钠(60mg/kg)麻醉小鼠,仰卧位固定。腹部正中切口开腹,暴露右肾及其肾蒂,分离肾脏周围组织及肾被膜,结扎并切断输尿管以及肾蒂,移去右侧肾脏。然后暴露左侧肾脏及其肾蒂,用无损伤动脉夹夹闭肾蒂,肾脏由鲜红色变为暗红色。夹闭后即刻开始计时,小鼠置于约(31±0.5)℃的恒温箱中保暖。热缺血时间持续70min后,移除动脉夹,肾蒂避免塌陷、扭曲,数分钟内肾脏恢复鲜红色,即可关腹。再灌注24h后获取肾脏标本,同时采集脾脏、外周血等标本。标本分别保存于4%甲醛或者-80℃冰箱中。
实验设如下组别:①正常组(n=5),正常小鼠不给予手术及其他任何处理。②假手术组(n=5),除未进行结扎肾蒂这一步骤外,其他同上述建立模型操作。③PBS对照组(n=5),术前24h腹腔注射PBS 200μL,其他操作同上述步骤。④TCDD治疗组(n=5),术前24h腹腔注射 TCDD(Sigma-Aldrich,美国)0.5μg/只,其他操作同上述步骤。
1.3 肾脏组织病理学检测及肾小管坏死评分
术后24h获取肾脏标本,4%甲醛固定,脱水,石蜡包埋并切片,常规行苏木精-伊红(HE)染色。镜下观察肾脏组织病理学改变,肾小管坏死表现为刷状缘丢失,扩张,管型形成,细胞分解。由2位有经验的医师依坏死肾小管所占比例对其严重程度进行半定量评分。评分标准:0分,正常组织,无可见明显损伤;1分,很少量的肾小管坏死(少于10%);2分,轻度肾小管坏死(10%~25%);3分,中度肾小管坏死(26%~75%);4分,重度肾小管坏死(高于75%)。
1.4 小鼠肾功能检测
术后24h采集小鼠外周血样本,离心获取血清,送往同济医院检验科检测(采用BECKMAN LX20全自动生化分析仪检验),指标为血肌酐和尿素氮。
1.5 脾脏T细胞分离
术后24h获取脾脏并研磨、过滤,密度梯度离心法(Ficoll,GE Health,英国)分离得到单个核细胞。根据体外培养体系需要,利用T细胞分选套装(Miltenyi Biotec,德国)从单个核细胞中分选纯化T细胞待用。
1.6 T淋巴细胞体外培养
将96孔板以CD3抗体(1μg/mL,eBioscience,美国)预包被,每孔中加入5×105T细胞,以及可溶性 CD28 单克隆抗体 (1μg/mL,eBioscience,美国),重组人类白细胞介素-2(IL-2,50U/mL,eBioscience,美国),总反应体系设为200μL,干预因素为 TCDD (60nmol/L,Sigma-Aldrich,美国)或者PBS,每组设3复孔。培养板置于37℃、5%CO2培养箱中培养5d后,收集细胞进行相关检测。
1.7 流式细胞学检测
分别从体外培养体系或者模型脾脏中分离单个核细胞,与 FITC-抗 CD4 单克隆抗体、APC-抗CD25抗体(eBioscience,美国)在4℃冰箱中孵育30 min;外周血标本用全血直接与表面抗体孵育后,利用红细胞裂解液破红。然后固定、通透,与PE-标记抗Foxp3抗体(eBioscience,美国)反应后,细胞重悬于500μL冷流式液中上机分析检测(FACSAria流式细胞仪,BD Biosciences,美国)。
1.8 统计学处理
采用SPSS 12.0统计软件对数据进行分析处理,组间均数比较采用t检验或单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 TCDD预处理减轻小鼠肾脏IRI
TCDD预先给药处理后,IRI小鼠的肾功能改善明显,其术后24h血肌酐值为(39.6±11.1)μmol/L,明显低于PBS对照组的(174.2±36.7)μmol/L(图1A,P<0.05)。血尿素氮的结果与此一致,TCDD治疗组为(14.0±6.6)mmol/L,明显低于PBS对照组的(34.8±9.3)mmol/L(图1B,P<0.05)。术前24h给予腹腔注射TCDD(0.5μg)1次后,5只模型鼠存活时间均>30 d,而PBS对照组小鼠平均存活时间为(4.8±2.7)d,生存时间明显延长。

图1 各组小鼠术后24h的血肌酐(A)和血尿素氮(B)水平Fig.1 The levels of BUN(A)and Scr(B)in each group 24hafter operation
2.2 TCDD处理明显减轻肾脏IRI病理改变
苏木精-伊红染色显示,PBS对照组肾脏大体形态学改变明显,相比假手术组和正常组,可见大片重度急性肾小管坏死,病变延伸超出皮质延髓交界处到达皮质部分,有多量管型的形成,间质可见明显出血改变,“缺血样”肾小球也多见。而TCDD治疗组损伤明显减轻,肾小管坏死减少,且主要局限于皮质延髓交界处,肾小管上皮细胞的坏死较少,病变形态也较轻,以水样变为主,管型的数量减少,肾小球和肾小管周围毛细血管的内皮细胞完整。肾小管坏死评分TCDD治疗组为(1.4±0.5),明显低于PBS对照组(3.4±0.5),差异有统计学意义 (P<0.05)。见图2。
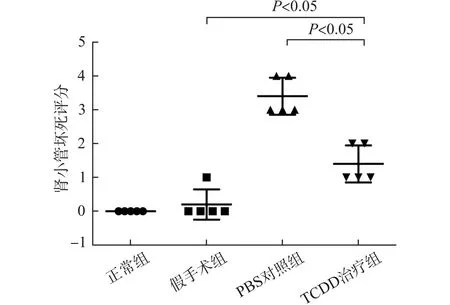
图2 各组小鼠术后24h肾小管坏死评分Fig.2 Scoring of tubular necrosis in different groups 24hafter operation
2.3 TCDD显著提升体外培养体系中Treg细胞的比例
流式细胞技术检测培养体系中Treg细胞的比例。如图3所示,相对于PBS对照组,TCDD的干预使体外培养体系中的CD4+CD25+Foxp3+Treg比例明显升高 [TCDD 治疗组 (15.1±2.6)%vs.PBS对照组 (5.2±2.7)%,P<0.05]。结果说明TCDD在体外可以诱导naive T细胞向Treg细胞定向分化。

图3 TCDD对体外培养体系中Treg细胞分化的影响Fig.3 The effect of TCDD on the differentiation of Treg cells in the in vitro culture system
2.4 TCDD处理明显提升IRI模型小鼠Treg细胞比例
同体外实验结果一致,如图4所示,TCDD明显提升了IRI模型小鼠脾脏细胞中Treg细胞的比例[TCDD治疗组(17.8±8.2)%vs.PBS对照组(4.8±2.0)%,P<0.05];且外周血中Treg细胞比例也有所提升 [TCDD治疗组(13.0±4.1)%vs.PBS对照组(4.0±1.9)%,P<0.05],但幅度明显较小。
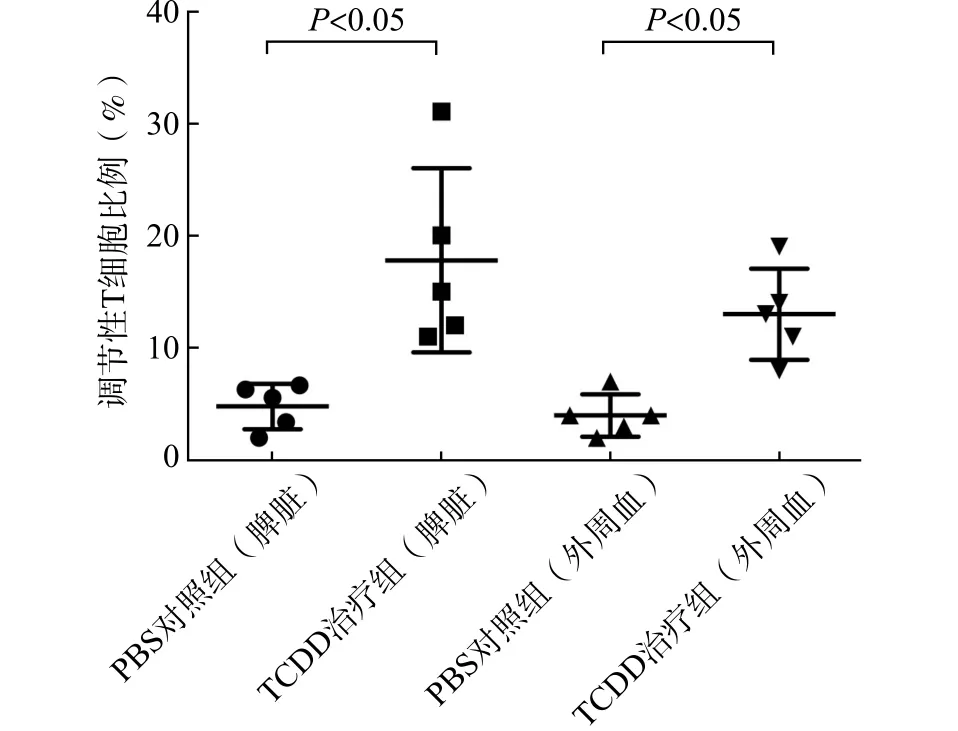
图4 TCDD提升小鼠IRI模型脾脏及外周血中Treg细胞的比例Fig.4 The effect of TCDD on the proportion of Treg cells in spleens or peripheral blood of IRI models
3 讨论
器官移植是治疗临床终末期脏器功能衰竭的唯一有效措施。随着免疫检测技术的发展和新型免疫抑制药物的开发并应用于临床,器官移植后的超急性、急性排斥反应得到了有效的控制,但是受者术后近期出现原发性移植物无功能、移植物功能延迟恢复以及远期并发慢性移植物失功等问题并没有得到有效解决,成为困扰临床医生的主要问题之一。而移植物的IRI就是造成这一现象的主要原因之一,至今也没有理想的干预措施。
以往关于IRI的研究主要集中在非免疫因素上,取得的进展有限,减轻移植物IRI的措施只有缩短冷、热缺血时间和低温保存等一般措施。因此,有必要重新审视IRI研究的切入点,探索新的发病机制和干预措施。起初,人们认为主要由T细胞和B细胞构成的获得性免疫系统对IRI并没有重要影响,但是近来越来越多的证据表明:淋巴细胞,尤其是Th1和Th17型CD4+T细胞在多个器官的IRI中发挥重要致病作用,并与天然免疫系统、非免疫系统相互影响[9-11]。而 Treg细胞具有强大的负性免疫调节能力,在多种疾病中可以对抗Th1和Th17等细胞的致病作用[12-13],因此 Treg细胞有望成为治疗器官IRI的重要工具之一,事实上目前已经有直接证据证明Treg细胞对IRI器官确有保护作用[1-2]。TCDD 激活 AHR 能够诱导 Treg细胞扩增,那么理论上TCDD对IRI模型应该能够通过扩增Treg细胞发挥保护作用。
TCDD是一种芳香烃受体外源性配体,新近有研究证实TCDD与AHR结合可以直接上调naive T细胞的Foxp3的表达,使Treg细胞得到扩增,同时抑制Th17的分化,并减少其细胞因子IL-17、IL-22的分泌,从而减轻 EAE(experimental autoimmune encephalomyelitis,一种小鼠多发性硬化症的模型)的病变[3-6]。而FICZ与 AHR结合所产生的效应恰恰与此相反:Treg细胞的分化及功能受到抑制,而 Th17细胞扩增明显,IL-17、IL-22分泌明显增加。上述研究表明,AHR可以通过结合不同的配体(TCDD/FICZ)向不同的方向调节 Treg/Th17的平衡。在移植领域,特异性激活AHR诱导小鼠胰岛移植达到免疫耐受已有报道[7],其主要机制就是诱导Treg细胞和耐受性树突状细胞扩增,发挥免疫抑制作用,诱导抗原特异性低反应性,建立免疫稳态。TCDD激活AHR诱导Treg细胞扩增,可能涉及多种机制,其中TGF-β的作用非常重要,有证据显示T细胞TGF-β受体突变可导致TCDD的作用丧失;其他机制如 NF-κB通路、耐受性 DC、IL-27等也参与了TCDD的调控作用。
本研究从IRI中的免疫学因素着手,通过建立小鼠肾脏IRI模型,验证了应用TCDD干预免疫系统对小鼠肾脏IRI后血肌酐、尿素氮和肾组织形态学变化的影响。结果表明,术前24h一次性给予TCDD 0.5μg,可使模型鼠肾功能明显改善,TCDD治疗组与PBS对照组比较,血肌酐、尿素氮明显降低,接近于正常水平;肾组织形态学观察显示,TCDD治疗组病理变化也明显减轻;同时小鼠生存时间显著延长,其保护作用非常明显。体外实验中,TCDD选择性扩增Treg细胞亚群,其比例较PBS对照组明显升高。而在体内实验中,流式细胞术分析结果显示TCDD使模型脾脏和外周血中Treg细胞比例均有明显升高,且脾脏中Treg细胞比例提升更为明显。由此可见,TCDD可以抑制肾脏IRI,保护再灌注肾脏,减轻其病变损伤程度。其作用机制可能是通过与AHR结合,扩增模型动物外周血和脾脏Treg细胞亚群,对抗致病性免疫因素,从而对IRI器官发挥保护作用。
随着对芳香烃受体及TCDD的深入研究,以AHR为靶点的治疗今后或将成为器官IRI预防的重要手段之一。若能进一步阐明TCDD和Treg细胞保护IRI器官的作用机制,明确其具体通路,则有可能制定出更为特异性的干预措施,这将会给IRI的防治和移植物的长期存活带来更美好的前景。
[1] Chen D,Zhang N,Fu S,et al.CD4+CD25+regulatory T-cells inhibit the islet innate immune response and promote islet engraftment[J].Diabetes,2006,55(4):1011-1021.
[2] Liesz A,Suri-Payer E,Veltkamp C,et al.Regulatory T cells are key cerebroprotective immunomodulators in acute experimental stroke[J].Nat Med,2009,15(2):192-199.
[3] Quintana F J,Basso A S,Iglesias A H,et al.Control of T(reg)and T(H)17cell differentiation by the aryl hydrocarbon receptor[J].Nature,2008,453(7191):65-71.
[4] Veldhoen M,Hirota K,Westendorf A M,et al.The aryl hydrocarbon receptor links TH17-cell-mediated autoimmunity to environmental toxins[J].Nature,2008,453(7191):106-109.
[5] Gandhi R,Kumar D,Burns E J,et al.Activation of the aryl hydrocarbon receptor induces human type 1regulatory T celllike and Foxp3(+)regulatory T cells [J].Nat Immunol,2010,11(9):846-853.
[6] Apetoh L,Quintana F J,Pot C,et al.The aryl hydrocarbon receptor interacts with c-Maf to promote the differentiation of type 1regulatory T cells induced by IL-27[J].Nat Immunol,2010,11(9):854-861.
[7] Hauben E,Gregori S,Draghici E,et al.Activation of the aryl hydrocarbon receptor promotes allograft-specific tolerance through direct and dendritic cell-mediated effects on regulatory T cells[J].Blood,2008,112(4):1214-1222.
[8] Godwin J G,Ge X,Stephan K,et al.Identification of a microRNA signature of renal ischemia reperfusion injury [J].Proc Natl Acad Sci USA,2010,107(32):14339-14344.
[9] Burne M J,Daniels F,El Ghandour A,et al.Identification of the CD4(+)T cell as a major pathogenic factor in ischemic acute renal failure[J].J Clin Invest,2001,108(9):1283-1290.
[10] de Perrot M,Young K,Imai Y,et al.Recipient T cells mediate reperfusion injury after lung transplantation in the rat[J].J Immunol,2003,171(10):4995-5002.
[11] Yang Z,Day Y J,Toufektsian M C,et al.Myocardial infarctsparing effect of adenosine A2Areceptor activation is due to its action on CD4+T lymphocytes[J].Circulation,2006,114(19):2056-2064.
[12] 陆小霞.哮喘儿童外周血单个核细胞Tim-3mRNA的表达及其与CD4+CD25+调节性T细胞的关系[J].华中科技大学学报:医学版,2011,40(1):60-63
[13] 陈刚,王清睿,胡少明.老年非小细胞肺癌患者Th1/Th2漂移状态与T-bet/GATA3基因表达的关系[J].华中科技大学学报:医学版,2011,40(5):509-512.

