1株高产凝乳酶菌株的鉴定及N+注入诱变选育*
洪丰,王志耕,梅林,薛秀恒
(安徽农业大学茶与食品科技学院,安徽省农产品加工工程实验室,安徽省乳品工程技术研究中心,安徽合肥,230036)
干酪生产中应用的凝乳酶主要有3类[1],包括动物凝乳酶、植物凝乳酶和微生物凝乳酶,评价凝乳酶优劣的两个重要指标是凝乳活力和蛋白水解力。近年来,由于世界干酪产量逐年上升,对凝乳酶的需求也不断增大,因此,来源广泛、价格低廉的微生物凝乳酶日益受到人们的重视[2]。
从自然界筛选出的天然菌株产酶能力一般不高,通过诱变选育是提高野生菌株产酶水平的有效途径之一[3]。由于离子束独特的生物学效应,低能离子通过加速器注入生物体内获得加速,以动量、质量、能量和电荷共同作用于生物体细胞,在与生物体作用过程中,与生物体的分子、原子发生一系列的碰撞,产生突变,在辐照微生物育种过程中经常表现出独特的优势[4-5]。离子束诱变育种与传统的化学和辐射诱变法相比,具有损伤轻、正突变率高、突变谱广、遗传稳定、易于获得理想菌种等优点,是菌种选育的较理想方法[6]。
目前关于产凝乳酶菌株的诱变选育研究大多集中在霉菌和真菌,对细菌的报道较少。本研究以市售干酪为原料,从中分离出1株产凝乳酶的菌株,采用生理生化特征分析和16S rDNA序列分析的方法对菌株进行鉴定,在此基础之上首次采用低能氮离子束注入法对该种产凝乳酶细菌进行诱变,探究离子注入的最佳条件,筛选高产凝乳酶株系,以期为细菌凝乳酶的工业化发酵生产奠定基础。
1 材料与方法
1.1 材料
1.1.1 样品
菌株分离样品来源于市售Mainland Edam Cheese(美兰契达干酪)。
1.1.2 试剂和仪器
酪蛋白(高纯级95%),美国AMRESCO公司;微量生化鉴定管,杭州天和微生物试剂有限公司;Taq酶等PCR反应试剂,上海生工生物工程有限公司;DNA提取试剂盒及凝胶回收试剂盒,北京天根;其他试剂均为分析纯。
DHP060型恒温培养箱,上海实验仪器厂有限公司;PHS-3B精密pH计,上海精密科学仪器有限公司雷磁仪器厂;SW-CJ-1F无菌操作台,苏州安泰空气技术有限公司;IX51倒置式基础型显微镜,日本奥林巴斯株式会社;Allegra 64R Centrifuge,美国BECKMAN COULTER公司;PCR扩增仪,杭州朗基科学仪器有限公司;培清JS-680D全自动凝胶成像分析仪,上海培清科技有限公司;离子注入机,中国科学院等离子体物理研究所。
1.1.3 培养基
酪蛋白平板培养基:酪蛋白10 g、牛肉膏3 g、Na2HPO42 g、NaCl 5 g、琼脂 15 g、蒸馏水 1 000 mL,pH 7.4。
发酵培养基:酪蛋白10 g、牛肉膏3 g、葡萄糖10 g、Na2HPO42 g、NaCl 5 g、蒸馏水 1 000 mL,pH 7.4。
1.2 实验方法
1.2.1 粗酶液的制备
在发酵培养基上按2%的比例接种菌液,37℃下120 r/min培养48 h,6 000 r/min离心10 min,取上清液即为粗酶液。
1.2.2 凝乳活力测定方法[7]
Arima方法:取5 mL 100 g/L的脱脂乳,35℃保温5 min,加入0.5 mL的发酵液,于旋涡混合器上混合,准确记录从加入酶液到乳凝固时间(min)。
1个索氏单位(SU):40 min凝固1 mL 100 g/L的脱脂乳的酶量。
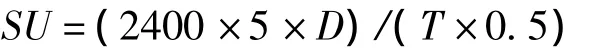
式中:T为凝乳时间;D为酶液稀释倍数。
1.2.3 蛋白水解活力测定方法[8]
取5 mL 1.2%酪素溶液,加1 mL稀释10倍后的酶液,35℃保温10 min,用5 mL 0.44 mol/L三氯醋酸终止酶反应,继续保温20 min,反应混合物用滤纸过滤。取滤液2 mL,加0.55 mol/L Na2CO3溶液5 mL后再加0.7 mol/L的Folin试剂1 mL,35℃保温20 min,于660 nm波长处测量吸光度值。
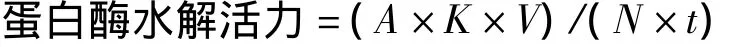
式中:A为660 nm波长处吸光度值;K为标准曲线中光吸收为“1”时的酪氨酸量(μg/μg);V为酶促反应的总体积/mL;t为酶促反应时间/min;N为酶的稀释倍数。
1.2.4 菌株的筛选
初筛:称取奶酪5 g,迅速倒入带玻璃珠的45 mL无菌水三角瓶中振荡30 min,即成为10-1的悬浮液。将悬浮液梯度稀释后涂布到酪蛋白平板上37℃培养48 h。从平板上挑取周围有凝乳圈的单菌落划线分离直至纯培养。
复筛:将纯培养物接种到发酵培养基中37℃下120 r/min振荡培养48 h。将发酵液6 000 r/min离心10 min,取其上清液测定凝乳活力,筛选出凝乳活力高的菌株。
1.2.5 菌株的鉴定
生理生化特征分析:对分离纯化的菌株依据《伯杰细菌鉴定手册》和《常见细菌系统鉴定手册》提供的方法进行生理生化特征分析鉴定[9-10]。
16S rDNA同源性序列分析:用试剂盒提取菌株的基因组 DNA,采用通用引物(正向引物27f:5'-AGAGTTTGATCCTGGCTCAG-3';反向引物1492r:5'-CGGTTACCTTGTTACGACTT-3')对菌株基因组进行16S rDNA扩增。PCR反应体系(50 μL):模板(约30 ng/μL)2 μL,dNTP(脱氧核苷三磷酸)1 μg,各 2.5 mmol/L,缓冲液 5 μL,正反向引物(10 μmol/L)各 1 μL,TaqDNA 聚合酶(5 U/μL)0.5 μL,去离子水39.5 μL。PCR反应条件:94℃预变性3 min,94℃变性45 s,55 ℃退火45 s,72 ℃延伸 90 s,30 个循环,72 ℃再保温10 min,保存于4℃。PCR产物经纯化后送交上海生工生物工程有限公司测序并与GenBank(美国国家生物信息中心)中的相关属种进行比对,利用Clustal X 1.83和MEGA 5.0软件并采用Neighbor-Joining(邻接法)方法构建系统进化树和Bootstrap analysis(自举法)方法进行1 000次重复抽样分析。
1.2.6 样品处理与 N+注入[11-12]
以培养24 h的菌液稀释1 000倍,取0.15 mL均匀涂布于无菌平皿上,用无菌风吹干。取镜检无细胞重叠者进行N+注入,注入能量选定为20 keV,注入剂量为0、1、2、3、4、5 × (0.52 ×1015ions/cm2),靶室真空度为10-3Pa,离子注入每个剂量和能量是相对于该剂量和能量只接受相同时间的真空处理而言。将平皿置于水冷靶台上,以5 s脉冲式注入,间隔55 s,然后取出平皿,以2 mL无菌水洗脱,涂布于酪蛋白平板,37℃培养3 d用于单菌落的挑选和存活率的计算。
1.2.7 存活率和正突变率的计算
存活率是指试验组平皿中的菌落平均数与对照组平皿中的菌落数之比。经离子注入后的样品,每皿用2 mL无菌水洗下,每个稀释度取0.2 mL涂布于初筛培养基,37℃恒温培养48 h后,统计存活细胞数A。未经处理的对照组平皿同条件培养后统计存活细胞数B。A和B的比值即为存活率。
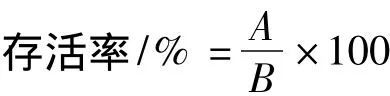
式中:A为实验组存活细胞数;B为对照组存活细胞数。
取经辐照处理后的单菌落分别进行发酵实验,同时以出发菌株为对照,考察菌株凝乳活力。凝乳活力比出发菌株高5%以上为正突变菌株。

1.2.8 诱变菌株的选育
从酪蛋白平板上挑选凝乳圈较大且透明圈较小的诱变菌株,进行发酵复筛。测定各菌株的凝乳活力、蛋白水解活力及凝乳效果,筛选出凝乳活力高、蛋白水解活力小及凝乳效果良好的菌株。
1.2.9 遗传稳定性实验及数据处理
进行遗传稳定性试验,将筛选得到的诱变菌株连续6代斜面转接、活化,并接种于发酵培养基培养,测定发酵液凝乳活力,每支斜面6个重复,所得结果取平均值。采用统计分析软件SPSS 18.0对遗传稳定性试验数据进行分析,试验结果以mean±SD表示,具有稳定遗传的菌株即为目的菌株。
2 结果与分析
经过初筛和复筛共得到5株纯培养物(见表1)。各菌在酪蛋白平板上均能生长,在菌落周围有凝乳圈。由表1可知,5株测试菌株在凝乳活力、蛋白水解活力、酶活比值(凝乳活力/蛋白水解活力)指标及凝乳效果上均存在差异,选取凝乳活力高、蛋白水解活力低、酶活比值高、凝乳效果良好的XC-1菌株作为后续研究及诱变出发菌株。
2.1 产凝乳酶菌株的分离纯化筛选

表1 菌株筛选结果Table 1 Screening results of the strains
2.2 XC-1菌株生理生化鉴定
XC-1菌株生理生化指标鉴定结果见表2,显示其生物学特征与枯草芽孢杆菌属的主要指标相符合,初步判定该菌株为Bacillus subtilis。
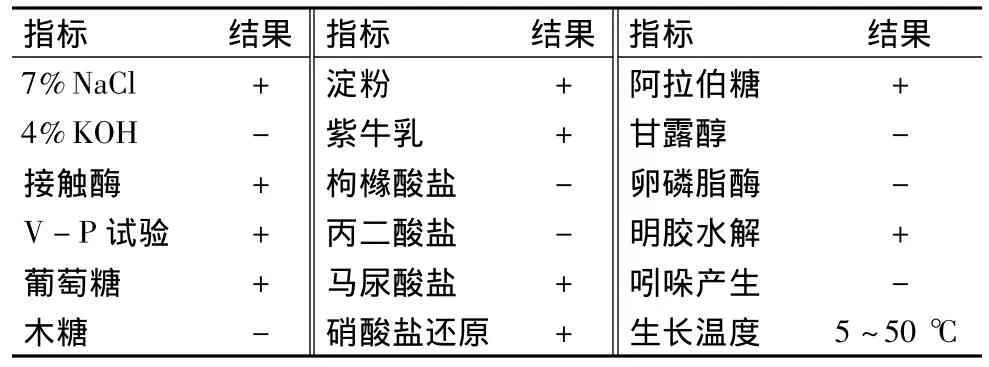
表2 XC-1菌株的生理生化特征Table 2 Physiological and biochemical characters of XC-1 strain
2.3 XC-1菌株的16S rDNA PCR扩增和序列分析
2.3.1 XC-1菌株的16S rDNA PCR扩增(图1)
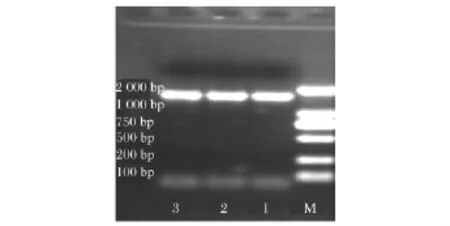
图1 XC-1菌株16S rDNAPCR扩增片段Fig.1 The PCR fragment of 16S rDNA of strain XC-1
用抽提的XC-1菌株DNA为模板进行PCR扩增,获得了一条大小约为1.5 kb特异的预期条带。获得的特异片段经纯化后测序,得到1 452 bp序列片段,其在GenBank上的登录号为KC492497。2.3.2 XC-1菌株系统进化树的构建(图2)
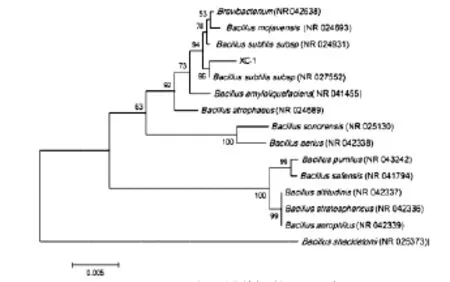
图2 XC-1与相关菌株的系统进化关系Fig.2 Phylogenetic tree of XC-1 based on the 16S rDNA sequences
将得到的序列与GenBank核酸序列库中的序列进行BLASTn(局部同源性比较),结果表明,XC-1菌株与Bacillus subtilis的16S rDNA序列有较高的同源性,其中与Bacillus subtilis(NR027552)有99%的同源性。参考XC-1细菌16S rDNA在GenBank的比较结果,利用Clustal X1.83和MEGA5.0软件构建系统发育树。系统进化树显示,菌株XC-1与Bacillus subtilis(NR027552)构成一个分支。细菌分类学家普遍认为,当16S rDNA序列同源性高于97%,可以认为是属内的同种,低于95%,则可能为属外成员[13]。因此,可确定菌株XC-1为Bacillus subtilis。
2.4 N+注入对XC-1菌株的诱变效应
XC-1菌株经N+注入处理后的存活率和正突变率如图3所示。图3显示在同一能量场作用下,注入剂量在0~1.04×1015ions/cm2之间时,随着注入剂量的增大,XC-1菌株的存活率明显下降,注入剂量在1.04×1015~2.08×1015ions/cm2时存活率逐渐回升。
N+注入诱变的突变频率与离子注入的剂量和能量有很大的相关性。当XC-1菌株诱变存活率在20%~30%时能达到最高的正突变率。图4显示在能量为20 keV,剂量为2.08×1015ions/cm2时正突变率最高,达到27.2%,随后正突变率又逐渐降低。
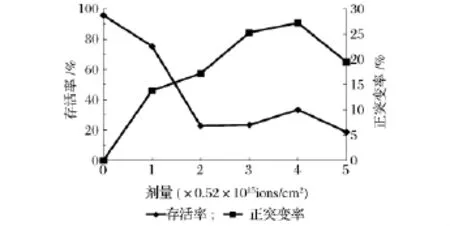
图3 N+辐照的存活率和正突变率曲线Fig.3 Curves for the survival rate and positive mutation of strain irradiated by N+
综合考虑菌株的存活率和正突变率,确立最佳诱变剂量值为2.08×1015ions/cm2。这个获得较高正突变率的注入剂量范围对应在存活率25%左右的区间,这可能是由于在此剂量范围内菌体细胞受到的能量、动量沉积和电荷交换等诱变因素最为丰富,能产生更广的诱变谱[14]。
2.5 诱变菌株的选育
2.5.1 诱变菌株的筛选
诱变菌株的部分筛选结果见表3。观察发现,XCYB-6菌株的凝乳活力最高为2 181.82 SU/mL,比出发菌株提高65.63%,同时,其蛋白水解活力最低(2.53 U/mL),酶活比值最高(862.38),该菌株的凝乳效果表现良好:凝乳时间最短,凝乳气味良好,质地光滑,硬度适中,均匀有光泽呈乳黄色。因此,选择XCYB-6菌株为诱变选育目的菌株。
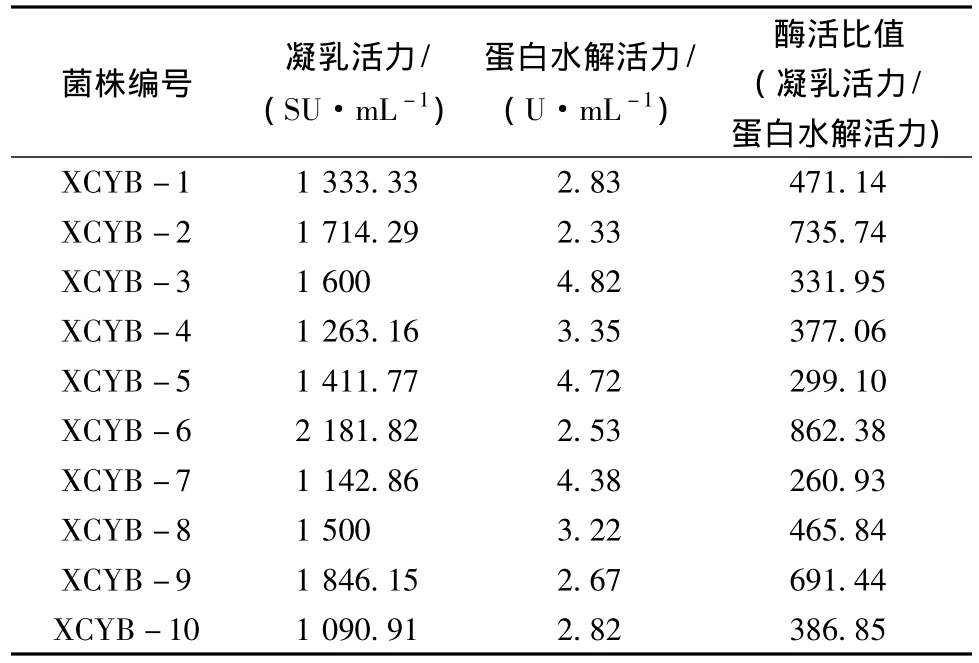
表3 氮离子束诱变菌株特性Table 3 Nitrogen ion beam mutant strains features
2.5.2 诱变菌株遗传稳定性检验
遗传稳定性实验和方差分析结果见表4。由表4可知诱变后筛选得到的XCYB-6菌株传至第6代,凝乳活力稳定在2 182.11~2 182.82 SU/mL之间。突变菌株XCYB-6凝乳活力6代间差异不显著(P>0.05),表明诱变菌株具有很好的遗传稳定性,其性状可以得到稳定遗传。

表4 诱变菌株XCYB-6不同代次的凝乳活力Table 4 Milk-clotting enzyme activity of mutant XCYB-6 of different generation
3 结论
N+束诱变处理可显著提高枯草芽孢杆菌菌属产凝乳酶的活力,最佳离子注入诱变条件为:能量20 keV、剂量2.08 ×1015ions/cm2。
本研究获得1株可用于凝乳酶生产诱变菌株,其凝乳活力为2 181.82 SU/mL(比出发菌株提高65.63%),蛋白水解活力为2.53 U/mL,遗传稳定性良好。
[1] 朱仁俊,石振兴,甘伯中,等.凝乳酶的研究进展[J].中国乳品工业,2010(1):39-42.
[2] 周俊清,林亲录,赵谋明.微生物源凝乳酶的研究进展[J].中国食品添加剂,2004(2):6 -9.
[3] Yu Zeng-liang.Introduction to Ion Beam Biotechnology[M].New York:Springer Press,2006:6 -12.
[4] 袁成凌,余增亮.低能离子束在生物技术中的应用研究[J].中国生物工程杂志,2003,23(4):57 -61.
[5] Yu Zeng-liang.The Progress of Ion Beam Bioengineering in China[J].Solid State Phenomena,2005,107(25):25 -30.
[6] 虞龙,张宁.离子注入微生物诱变育种的研究与应用进展[J].微生物学杂志,2005,25(2):80-83.
[7] Arima K,Shinjiro I,Gakuzo T.Milk-clotting enzyme from microorganism,Part II,Screening test and identification of potent fungus[J].Agricultural and Biological Chemistry,1967,31(5):540 -545.
[8] 钱世均,张纯青,矫庆华,等.微小毛霉凝乳酶的纯化和性质[J].微生物学报,1989,29(4):272 -277.
[9] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:北京科学出版社,2001:43-65.
[10] Buchanan R E,Gibbens N E.伯杰细菌鉴定手册8版[M].北京:北京科学出版社,1984:729-759.
[11] 马丽丽,王志耕,陈美姣,等.N+注入Lactobacillus bulgarius诱变选育高产ACE抑制剂的研究[J].激光生物学报,2010,19(3):391 -396.
[12] 虞龙,许安,姚建铭,等.低能离子注入在Vc高产菌株选育中的应用[J].激光生物学报,1999,18(3):200-217.
[13] Vandamme P,Pot B,Gillis M,et al.Polyphasic Taxonomy a consensus approach to bacterial systematic[J].Microbiology and Molecular Biology Reviews,1996,60(2):407-438.
[14] 韩荣飞,吴跃进,卞坡,等.低能重离子剂量-存活率效应及其拟合模型探讨[J].原子核物理评论,2009,26(4):352-355.

