孤立性纤维瘤的多层螺旋CT征象及病理特征
杨晓锋 YANG Xiaofeng
吴 凡 WU Fan
方 春 FANG Chun
孤立性纤维瘤的多层螺旋CT征象及病理特征
杨晓锋 YANG Xiaofeng
吴 凡 WU Fan
方 春 FANG Chun
目的探讨孤立性纤维瘤(SFT)的多层螺旋CT(MSCT)特征,并分析其病理改变。资料与方法6例经病理证实的SFT患者中,病灶位于胸壁2例,乳房1例,腹腔内1例,下腹壁1例,盆腔1例,分析其MSCT表现,并与手术病理结果进行对照。结果6例均表现为边界清楚的孤立性肿块,1例呈类圆形,5例呈分叶状。CT平扫1例密度均匀,2例有坏死、囊变,3例出现点状钙化。增强扫描示1例均匀强化,5例呈“苔藓样”不均匀强化,2例病灶内可见粗大的肿瘤血管,均呈“快进慢出”或“延迟强化”的强化模式。病理光镜下见肿瘤组织主要由胶原纤维及不同程度增生的梭形细胞组成。富于细胞与少细胞区相间,间质见瘢痕疙瘩样透明样变,胶原纤维束粗大,间质血管丰富。结论SFT的MSCT可以表现为边界清楚的孤立性肿块,增强后呈“苔藓样”不均匀强化,“快进慢出”或“延迟强化”等影像特征,结合病理检查,可以为临床诊断SFT提供依据。
孤立性纤维瘤;体层摄影术,螺旋计算机;病理学,外科
孤立性纤维瘤(solitary fibrous tumor, SFT)是一种少见的梭形细胞间叶肿瘤,全身软组织均可发生,以胸部脏层胸膜多见[1]。近年也有个案报道发生于胸膜外SFT的部位有眼眶、鼻腔、脑膜、肾脏及盆腔等[2,3]。本研究回顾性分析6例经病理证实的、发生于全身各部位的SFT患者的多层螺旋CT(MSCT)资料,并结合病理组织学进行分析,总结其MSCT特征,旨在提高对本病的认识及诊断水平。
1 资料与方法
1.1 研究对象 收集2009-02~2012-05嘉兴市第一医院经手术病理证实的6例SFT患者的资料,患者均为女性,年龄32~70岁,平均(52.0±9.3)岁;病灶部位:胸壁2例,乳房、腹腔内、下腹壁及盆腔各1例;4例为体格检查发现,2例肿瘤位置表浅、患者自行发现;主要临床表现:2例胸痛、咳嗽,1例下腹部疼痛,1例出现低血糖症状,入院测血糖为2.7 mmol/L。
1.2 仪器与方法 采用Siemens Definition AS 64层螺旋CT及GE LightSpeed 4层螺旋CT机。64层螺旋CT扫描参数:管电压120 kV,管电流550 mA,螺距0.856∶1,球管转速0.5 s/r,层厚0.5 mm,进床速度20 mm/r,矩阵512×512。4层螺旋CT扫描参数:电压120 kV,电流160 mA,层厚及层间距均为5 mm(靶区加做2 mm薄层扫描)。增强扫描均采用高压注射器,经肘静脉团注非离子型对比剂碘海醇(300 mgI/ml,扬子江药业),流速2~3 ml/s,注射总量为70~90 ml。注射对比剂后腹部增强行3期扫描(动脉期、门静脉期及平衡期),腹部以外部位行2期扫描(动脉期、实质期)。
1.3 图像分析 由2名有经验的放射科主治医师分别采用双盲法独立阅片,分析肿瘤的部位、形态、大小、数目、边界、密度、内部结构、强化方式、延迟情况及与周围组织器官的关系等。与周围正常肌组织进行对比,评价病灶增强前后的密度改变。
1.4 病理检查 5例行手术切除,1例行CT引导下穿刺活检。术后标本经4%福尔马林溶液固定,常规石蜡包埋,5 μm切片,常规HE染色,苏木素染色3~5 min,0.5%~1%伊红染色0~20 s,光镜下观察核质、胞质及纤维。免疫组化染色采用Envision二步法,一抗为CD34、波形蛋白(Vim)、细胞凋亡相关蛋白Bcl-2、酸性钙结合蛋白S-100等,稀释浓度为1∶60,二氨基苯胺显色。
2 结果
2.1 CT表现 6例SFT均表现为边界清楚的孤立性肿块。最大径线为4~11 cm,平均(7.6±1.1)cm。1例呈类圆形,5例呈分叶状。CT平扫1例密度均匀(图1A),2例病灶内可见低密度坏死或变性区(图2A),3例病灶内见点状钙化(图2B)。1例引起邻近骨质吸收(图3)。增强扫描示1例呈中等均匀强化(图1B),5例强化明显且不均匀,呈“苔藓样”强化(图2C),2例病灶内可见粗大的肿瘤血管或动脉侧支开放(图4A、4B)。动态增强扫描4例早期呈不均匀强化,并逐渐达峰,总体呈“快进慢出”型强化(图5)。2例胸壁SFT见“胸膜蒂”或“胸膜尾征”(图6)。

图1 患者女,70岁,腹腔孤立性纤维瘤。A. CT平扫示肿块体积较小,密度均匀,边界清楚(箭);B.增强扫描后呈中等均匀强化(箭)
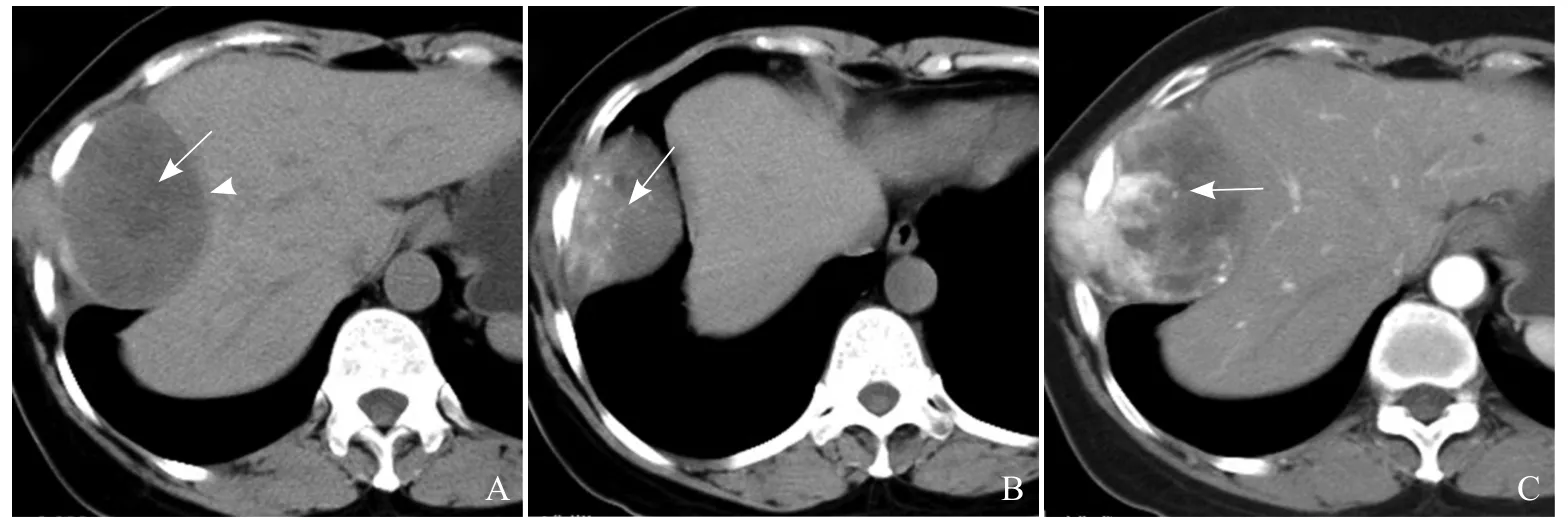
图2 患者女,55岁,胸膜孤立性纤维瘤。A、B. CT平扫示肿瘤边界清楚,密度不均,内见变性及钙化灶(箭);肿瘤周围见“假包膜”(箭头);C.增强扫描后见明显不均匀“苔藓样”强化(箭)
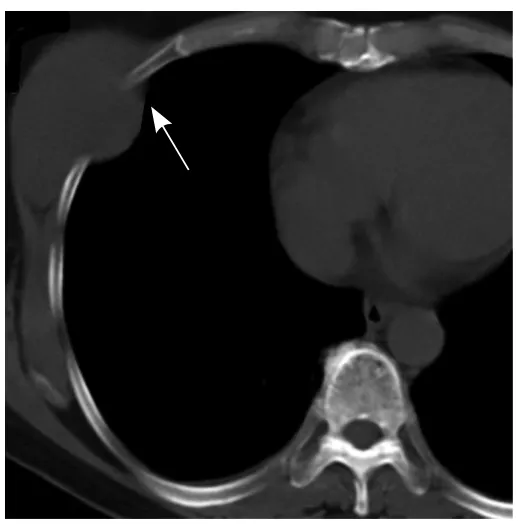
图3 患者女,61岁,右侧乳腺孤立性纤维瘤。骨窗显示病灶邻近肋骨稍有吸收变薄,局部肋间隙增宽(箭)
2.2 手术及病理结果 4例包膜完整,2例不完整。肿瘤质地较韧,边界较清,2例与周围组织粘连,肿瘤表面血管丰富。光镜下肿瘤组织主要由胶原纤维、不同程度增生的梭形细胞组成(图4C),富于细胞与少细胞区相间,间质见瘢痕疙瘩样透明样变,胶原纤维束粗大,间质血管丰富,可见分支样血管结构,部分形成血管外皮瘤样结构。免疫组化显示6例CD34(+),4例Bcl-2(+);2例Vim(+)(图4D、E)。

图4 患者女,52岁,胸膜孤立性纤维瘤。A.增强扫描示肿瘤血供丰富,见粗大的血管影(箭);B.侧支开放,内乳动脉显影,管径增粗(箭);C.梭形细胞间出现条索状胶原束及透明变区,富于细胞区与少细胞区相间隔,间质血管丰富(HE, ×200);D.免疫组化染色示CD34(+)(×100);E.免疫组化染色示Bcl-2(+)(×100)
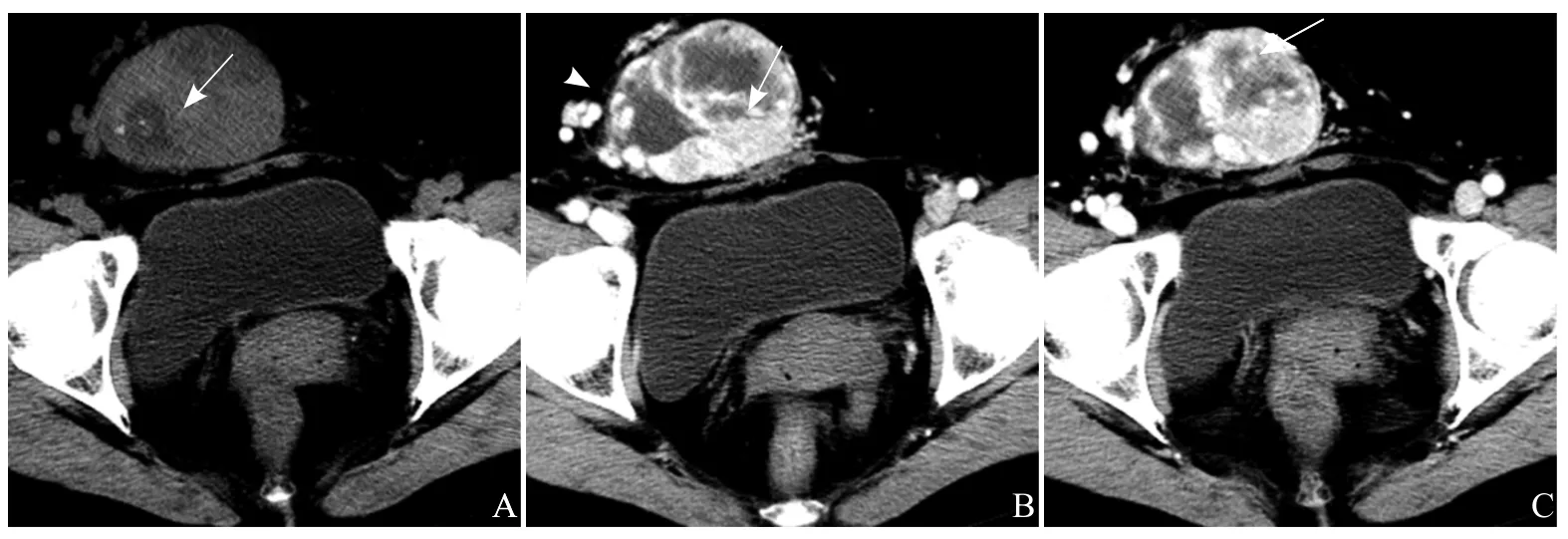
图5 患者女,45岁,右下腹壁孤立性纤维瘤。A.CT平扫示肿瘤边界清楚,密度不均,内见变性及钙化灶(箭);B.增强扫描后早期呈不均匀“苔藓样”强化(箭),肿瘤内部及周边可见粗大的血管影(箭头);C.延迟扫描示肿瘤呈渐进性强化,并逐步填充,强化面积增大(箭),内部粗大供血动脉更明显
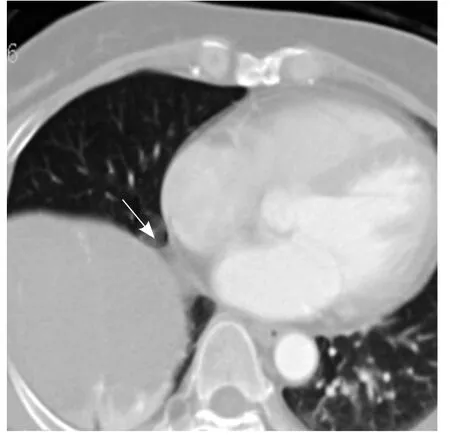
图6 患者女,32岁,增强扫描示肿块边缘变窄,呈“蒂”与纵隔胸膜相连(箭)
3 讨论
3.1 概述及流行病学特点 Wagner于1870年首次详述SFT的组织学表现;直至1931年,Klemperer和Rabin首先报道其病理学特征,并正式将其列为一种独立的病变[4]。WHO(2002)软组织肿瘤分类将SFT定义为一种少见的梭形细胞间叶肿瘤,认为该肿瘤起源于表达CD34抗原的树突状间充质细胞,并向纤维母细胞、肌纤维母细胞分化,常表现为明显的血管外皮瘤样结构[2]。SFT是一种交界性肿瘤,其中大部分是良性肿瘤,仅有少数(约15%)生物学上表现出侵袭性的特征[5]。SFT好发于组织的浆膜层,最常见于胸膜(脏层胸膜约占80%,壁层胸膜约占20%)[1],其他部位如腹膜、腹膜后间隙、纵隔、盆腔、鼻咽、眼眶、乳房、肝脏、上呼吸道及中枢神经系统等部位也有报道[6]。本组6例患者中,2例发生于脏层胸膜。SFT可以发生于任何年龄,以30~65岁多见,无明显性别差异[1],但个别研究报道女性略多见[7]。本组6例均为女性,考虑为样本量较少所致。SFT生长缓慢,因此4例患者行影像学检查时偶然发现。发生于胸部的较大肿瘤可以引起胸痛、咳嗽、呼吸困难等症状,部分患者偶尔可以出现肥大性骨关节病、杵状指(趾)及特发性低血糖等[8],以上症状与肿瘤体积过大有关,本组1例患者出现低血糖,手术后低血糖症状逐渐消失,与文献[9]报道一致。
3.2 病理组织学特点 大体观察:肿块边界清楚,包膜多完整,切面多呈灰白色或灰褐色,质地中等偏硬,可呈分叶状。侵袭性或恶性SFT常可见瘤周坏死或浸润改变。巨大肿块瘤体内常可见透明样变及黏液样变,若出现出血、坏死常提示为恶性[10]。部分瘤体内可见沙砾样钙化[11]。光镜下可见肿瘤组织主要由胶原纤维和增生的梭形细胞构成,细胞胞质红染,染色质均一,核分裂和异型性少见。细胞排列呈血管外皮瘤样、条束状、漩涡状、席纹状或不规则状,其中以血管外皮瘤样结构最为特异,即纤维组织内见分枝状血管;且梭形细胞疏密不均,富于细胞和少细胞区相间,在镜下构成细胞密集区和疏松区,其间间质血管较丰富。免疫组化是确诊SFT的依据。本组6例均表达CD34 2例表达Vim,是鉴别间质瘤、神经源性肿瘤、纤维肉瘤等其他梭形细胞肿瘤的重要依据。此外,本组中4例表达Bcl-2,提示Bcl-2在诊断CD34表达阴性的SFT中有重要的辅助作用。
3.3 CT表现SFT CT平扫基本表现为边界清楚、边缘光滑的孤立性软组织肿块,少数肿块可见分叶,但分叶不是该肿瘤的恶性征象[12]。瘤体内可见点状或沙砾样钙化,约7%~26%的病例可见钙化[11],本组中有3例出现钙化,稍高于文献报道。小病灶(直径<5 cm)一般密度较均匀,由于肿瘤内含有丰富的胶原纤维,因此可以表现为等或稍高密度(较同层面肌肉)。一般直径>10 cm的较大病灶内部可以出现透明样变、黏液样变、囊性变等退行性改变而形成低密度区[13]。因此,较大的SFT由于组织学形态的多样性决定了其CT表现有所不同,可以出现高、等、稍低、囊性密度等影像表现,高密度往往见于肿瘤内钙化灶,等密度影反映肿瘤细胞密集区或致密胶原纤维分布区,稍低密度影可见于肿瘤黏液样变。侵袭性或恶性SFT可以出现坏死及出血,密度更加混杂。然而,肿瘤的大小和分叶与肿瘤的良、恶性无关[12]。等或稍高密度中存在片状或结节状稍低区,偶伴散在钙化,是大多数SFT的典型CT平扫表现,具有重要的鉴别诊断价值,有利于缩小诊断和鉴别诊断的范围,因为绝大多数恶性肿瘤密度不均,且瘤体密度相对较低。
增强扫描:SFT肿瘤细胞排列密集,且病理上多呈现血管外皮瘤样结构,间质血管丰富,因此实性部分强化较明显,并且可见瘤内迂曲血管影,部分可见邻近侧支开放,本组共有5例可见瘤内血管,1例见内乳动脉显影增粗。动态增强往往可见病灶呈“快进慢出”型强化或“延迟强化”,这主要与肿瘤的组织成分有关。增强早期肿瘤明显强化,表明该肿瘤内梭形细胞排列较密集,间质血管丰富,这类强化表现主要见于较小的病变;如果增强早期未见明显强化,延迟扫描呈轻度强化,表明肿瘤细胞分布稀疏,肿瘤内胶原纤维较多,或胶原纤维发生成熟透明样变或玻璃样变,此类情况多见于较大的瘤体。由于SFT多为良性,生长缓慢,临床发现时肿瘤体积较大,因此肿瘤内部成分多样,强化不均,呈现“苔藓样”强化或“地图状”强化[14],较具特征性。
肿瘤与邻近组织的关系也有助于鉴别诊断。如胸膜孤立性纤维瘤重要的间接特征性表现是肿瘤边缘逐渐变窄,胸膜托起,出现“胸膜蒂”或“胸膜尾征”,前者见于脏层胸膜来源,后者则来源于壁层胸膜。Dedrik等[15]指出肿块相邻肺组织移位和肿块边缘部分逐渐变窄是提示肿瘤起源胸膜的较为可靠的征象,即称为“蒂征”。蒂内含有丰富的滋养血管,因此,增强后蒂亦可见强化[12]。本组发生于脏层胸膜的2例SFT均可见胸膜“蒂征”。此外,发生于胸壁的SFT一般不会破坏邻近的骨质,仅表现为局部肋间隙增宽。当瘤体较大时,可以出现受压骨质吸收改变。当伴有肿瘤周边骨质破坏或溶骨改变时,常提示恶性可能性大。
3.4 鉴别诊断
3.4.1 发生于胸膜的SFT 影像学上主要需与支气管肺癌、肺转移瘤等肺内病变及胸膜间皮瘤相鉴别,定位肺内外病变对诊断意义很大。使用CT螺旋薄层靶扫描及MPR技术可以清楚地显示“胸膜蒂”或“胸膜尾征”及邻近肺组织受压、移位、不张改变,可以与肺内病变鉴别。而发生于胸膜的SFT与胸膜间皮瘤的主要鉴别点在于病史,间皮瘤多见于老年男性,常有石棉接触史,影像学上多以胸膜多发结节及胸腔积液为特征。
3.4.2 发生于胸膜以外部位的SFT 发生于乳房的SFT需与乳腺癌相鉴别,SFT为富血供肿瘤,强化明显;而乳腺癌为乏血供肿瘤,呈轻至中度强化,由此可以鉴别。此外,乳腺癌病灶边缘常有毛刺,肿块内见簇状沙砾样钙化,常伴腋窝淋巴结肿大。发生于腹壁或腹腔内的SFT主要需与神经源性肿瘤和间质瘤鉴别。SFT胶原纤维成分相对较多,故CT平扫密度较神经源性肿瘤稍高,且其肿瘤血管粗大,实性区强化更明显;而间质瘤多发生于胃肠道,典型表现为局部肠管壁增厚形成的软组织肿块,强化程度低于SFT。发生于盆腔的SFT需与子宫阔韧带及浆膜下肌瘤相鉴别。子宫阔韧带、浆膜下肌瘤早期强化明显,且强化程度接近正常子宫肌层,可以通过MPR显示肿块与子宫浆膜层的关系,借此可以鉴别。
总之,SFT相对较少见,且发生部位广泛,临床症状无明显特异性,故术前诊断准确率较低。典型的SFT边界清楚,富含胶原纤维,CT平扫密度等或稍高,增强后呈均匀或“苔藓样”不均匀“快进慢出”型强化或“延迟强化”,可以伴粗大的肿瘤血管,应该考虑到SFT的可能。
参考文献
[1] Zhu Y, Du K, Ye X, et al. Solitary fibrous tumors of pleura and lung: report of twelve cases. J Thorac Dis, 2013, 5(3): 310-313.
[2] Zeitler DM, Kanowitz SJ, Har-El G. Malignant solitary fibrous tumor of the nasal cavity. Skull Base, 2007, 17(4): 239-246.
[3] 逄利博. 颅内孤立性纤维瘤MRI诊断一例. 中华放射学杂志, 2012, 46(2): 188.
[4] Klemperer P, Coleman BR. Primary neoplasms of the pleura. A report of five cases. Arch Pathol, 1992, 22(1): 1-31.
[5] Song SW, Jung JI, Lee KY, et al. Malignant solitary fibrous tumor of the pleura: computed tomography-pathological correlation and comparison with computed tomography of benign solitary fibrous tumor of the pleura. Jpn J Radiol, 2010, 28(8): 602-608.
[6] Cardillo G, Lococo F, Carleo F, et al. Solitary fibrous tumors of the pleura. Curr Opin Pulm Med, 2012, 18(4): 339-346.
[7] Znati K, Chbani L, El Fatemi H, et al. Solitary fibrous tumor of the kidney: a case report and review of the literature. Rev Urol, 2007, 9(1): 36-40.
[8] 陆洁莉, 赵咏桔, 王颖, 等. 胰岛素样生长因子Ⅱ表达异常与胸膜孤立性纤维瘤致低血糖. 中华内分泌代谢杂志, 2005, 21(6): 533-534.
[9] Milenkovic BA, Stojsic J, Motohiko A, et al. Solitary fibrous pleural tumor associated with loss of consciousness due to hypoglycemia. Med Oncol, 2009, 26(2): 131-135.
[10] Benchetritt M, Hofman V, Vénissac N, et al. Dedifferentiated liposarcoma of the pleura mimicking a malignant solitary fibrous tumor and associated with dedifferentiated liposarcoma of the mediastinum: usefulness of cytogenetic and molecular genetic analyses. Cancer Genet Cytogenet, 2007, 179(2): 150-155.
[11] Elicker BM, Leung JW, Reddy GP, et al. A slowly growing extraparenchymal mass: imaging considerations. Clin Pulm Med, 2005, 12(5): 328-331.
[12] 彭小芳, 汪秀玲, 病理, 等. 孤立性纤维瘤的临床、病理及影像学表现. 中国CT和MRI杂志, 2013, 11(2): 60-62.
[13] 陈小平, 沈东挥, 邹松, 等. 孤立性纤维瘤的CT、MR诊断.医学影像学杂志, 2013, 23(1): 87-89.
[14] 梁辉清, 关玉宝, 曾庆思, 等. 胸膜孤立性纤维瘤的多层螺旋CT表现与病理特征. 中国医学影像学杂志, 2012, 20(7): 499-501.
[15] Dedrik CG, McLoud TC, Shepard JA, et al. Computed tomography of localized pleural mesothelioma. Am J Roentgenol, 1985, 144(2): 275-280.
(责任编辑 张春辉)
Solitary Fibrous Tumor: CT Findings and Pathological Features
PurposeTo investigate the multi-slice spiral CT (MSCT) findings and pathological features of solitary fibrous tumor (SFT).ResultsAll the six cases presented solitary masses with well-defined margin, among which one was round-like and five were lobulated. On plain CT scans, one showed homogeneous density, two with necrosis or cystic degeneration, and three with calcification. On enhanced CT scans, one displayed homogeneous intensity, five heterogeneous intensity with lichenoid shape, two with hypertrophic tumor vessels, all presenting a “fast-in and slow-out” or “delayed enhancement” pattern. Tumor tissues mainly consisted of collagen fibers and spindle cells in different hyperplastic degrees under microscope, with cell enriched area alternating with less cell area, interstitial keloid hyaline degeneration, enlarged collagen bundle, and enriched interstitial vessels.Materials and MethodsA retrospective study was conducted on the MSCT findings of six cases of SFT proved pathologically, two located in the thoracic walls, one in the breast, one in the abdominal cavity, one in the inferior abdominal wall, and one in the pelvic cavity. The MSCT findings were further compared with pathological results.ConclusionThe MSCT findings of SFT can be expressed as isolated mass with well-defined margin, after enhancement, it presents image features such as heterogeneous intensity with lichenoid shape, and patterns such as “fast-in and slowout” or “delayed enhancement”. Combined with immunohistochemical test, they can be used as clinical evidence for the diagnosis of SFT.
Solitary fibrous tumors; Tomography, spiral computed; Pathology, surgical
嘉兴市第一医院放射科 浙江嘉兴 314000
杨晓锋
Department of Radiology, the First Hospital of Jiaxing, Jiaxing 314000, China
Address Correspondence to: YANG Xiaofeng
E-mail: yxfjxsdyyy@126.com
R73;R445.3
2013-01-29
修回日期:2013-09-01
中国医学影像学杂志
2013年 第21卷 第9期:710-714
Chinese Journal of Medical Imaging
2013 Volume 21(9): 710-714
10.3969/j.issn.1005-5185.2013.09.022

