小立碗藓Ran基因的克隆与表达分析
叶帅 王凤德 张一卉等

同等第一作者:叶 帅(1981-),男,硕士研究生,研究方向为植物分子遗传学;王凤德(1979-),男,副研究员,研究方向为植物分子生物学。
摘要:Ran是一种大量分布于细胞核内的小分子的GTP酶,在核质运输过程中具有十分重要的作用,参与调控细胞分裂及其信号传导。本研究利用基于同源序列的PCR技术,从小立碗藓(Physcomitrella patens)中成功克隆了PpRan基因的开放阅读框(ORF)序列,并对其编码的氨基酸序列进行了相关分析。利用半定量PCR技术对PpRan基因在不同组织中以及受到缺磷胁迫时的表达研究发现,PpRan基因的表达具有组织特异性,茎叶体和原丝体中表达量较高,假根中表达量比较低;PpRan基因受缺磷胁迫诱导表达,随着胁迫时间的延长表达量越来越高。这些结果表明,PpRan基因可能在小立碗藓响应缺磷胁迫时发挥重要作用。
关键词:小立碗藓;PpRan基因;基因克隆;表达分析
中图分类号:Q78 文献标识号:A 文章编号:1001-4942(2013)06-0015-05
磷是植物生长所必须的矿质元素,缺磷常导致植物的分枝比正常植株少,茎、根纤细,植株矮小,花果容易脱落等。但土壤中的磷一般不能满足农作物生长发育的需要,必须通过施肥来补充,这无疑增加了作物种植的成本,也存在破坏生态环境的风险。因此,如能克隆与缺磷胁迫耐性相关的基因,并通过基因工程手段改良作物将对农作物经济效益和生态环境都具有重要的作用。
GTP结合蛋白(GTP-binding protein)也叫G蛋白,广泛存在于生物界,在细胞信号传导中起着极为重要的作用。低分子量GTP结合蛋白的相对分子量通常在20~30 kD之间,根据分子量大小可以划分为Ras、Rap、Seg、Arf等七种不同的亚类[1]。其中Ran(Ras-related nuclear)也称为TC4[1],在动物中参与调控细胞周期中各个时期的生命活动,如:调控核运输、启动细胞分裂、DNA复制、RNA的转录和加工(或修饰)、有丝分裂和减数分裂的开始和结束的控制、纺锤体的组装、染色体的正确分配、核膜破裂和重组等。但到目前为止,关于Ran蛋白参与调控植物逆境胁迫反应的研究鲜有报道,尤其是对缺磷胁迫的耐性。
苔藓植物是自然界的拓荒者之一,能生活于沙碛、荒漠、冻原地带及裸露的石面或新断裂的岩层上,这种生活的特性可能与其本身的分子调控机制相关。因此,本研究以小立碗藓(Physcomitrella patens)为材料,对其Ran基因进行了克隆和相关表达模式的研究,不仅为了解Ran蛋白的生物学功能奠定了基础,也为植物的抗逆育种提供了理论参考。
1 材料与方法
11 试验材料
小立碗藓由德国Ralf Reski 教授惠赠。
12 试验方法
121 PpRan基因cDNA编码序列的克隆 利用Trizol 法提取小立碗藓总RNA,采用上海申能博彩生物科技有限公司的反转录试剂盒反转录合成cDNA 第一条链。利用NCBI上公布的小麦、水稻及拟南芥Ran基因的EST序列,通过BLAST比对找出小立碗藓中同源的EST并进行拼接,找出PpRan的ORF,设计特异性引物分别为PpRan-F:5′-ATGGCATTGCCCGGGCAGCAGACTCC-3′和PpRan-R:5′-CTAGCTGTCAAAGGCGTCATCGTCGT-3′。以小立碗藓反转录产物为模板进行PCR 扩增。扩增产物连pGEM-T easy vector System后测序验证。
122 序列比对和系统进化树分析 利用DNAMAN 软件,对不同物种(小麦:Triticum aestivum,AAL303961;水稻:Oryza sativa Japanica Group,NP_0010435501;拟南芥:Arabidopsis thaliana,AAN318651;酿酒酵母:Saccharomyces cerevisiae S228C,NP_0148281;果蝇:Drosophila yakuba,XP_0021009021;小家鼠:Mus musculus,NP_033417;人Homo sapiens:NP_0063161)来源的Ran蛋白进行氨基酸多序列比对分析,采用默认参数设置。使用MEGA 40 对不同物种中的Ran蛋白做系统进化分析,采用Bootstrap Test -Neighbor Joining 方法,重复500 次运算。
123 PpRan基因在不同组织中的表达模式分析 用Trizol法分别提取小立碗藓茎叶体、假根、原丝体组织的总RNA,反转录。分别以茎叶体、假根、原丝体的反转录产物为模板,利用PpRan-F/R引物PCR扩增PpRan基因,琼脂糖凝胶电泳检测不同组织PpRan基因的表达水平。以小立碗藓Actin基因(AW698983)作为内参,扩增引物为:PpActin-F:5′-CGGAGAGGAAGTACAGTGTGTGGA-3′和PpActin-R:5′-CTGGGCTCAATTCTAACGGCTGGT-3′。
124 小立碗藓受缺磷胁迫时PpRan基因的表达模式分析 将小立碗藓植株在不加入磷元素的固体培养基(培养基中的KH2PO4用等量的KCl代替)中培养,进行缺磷处理,以正常培养基培养的小立碗藓作为对照。在处理后第1、2、4、7、9天取小立碗藓假根,用Trizol法提取小立碗藓假根RNA,反转录成cDNA。利用PpRan-F/R引物PCR扩增PpRan基因,琼脂糖凝胶电泳检测不同处理时期PpRan基因的表达水平。并以小立碗藓Actin基因作为内参,扩增引物同123。2 结果与分析
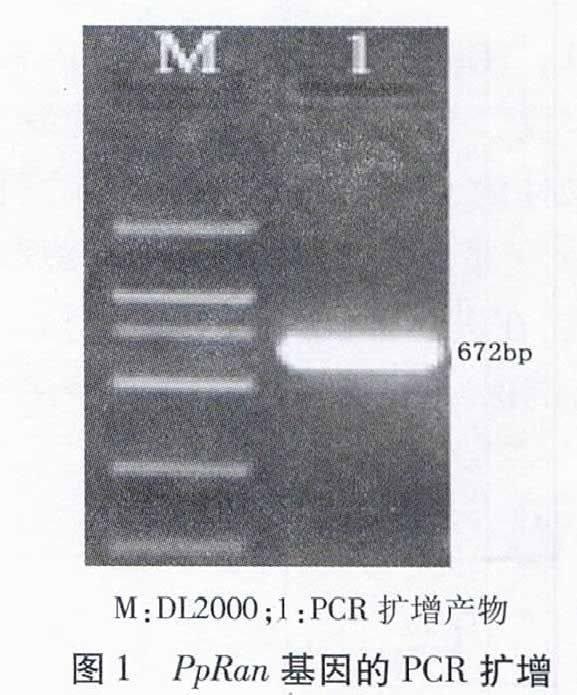
21 PpRan基因编码区克隆及分析
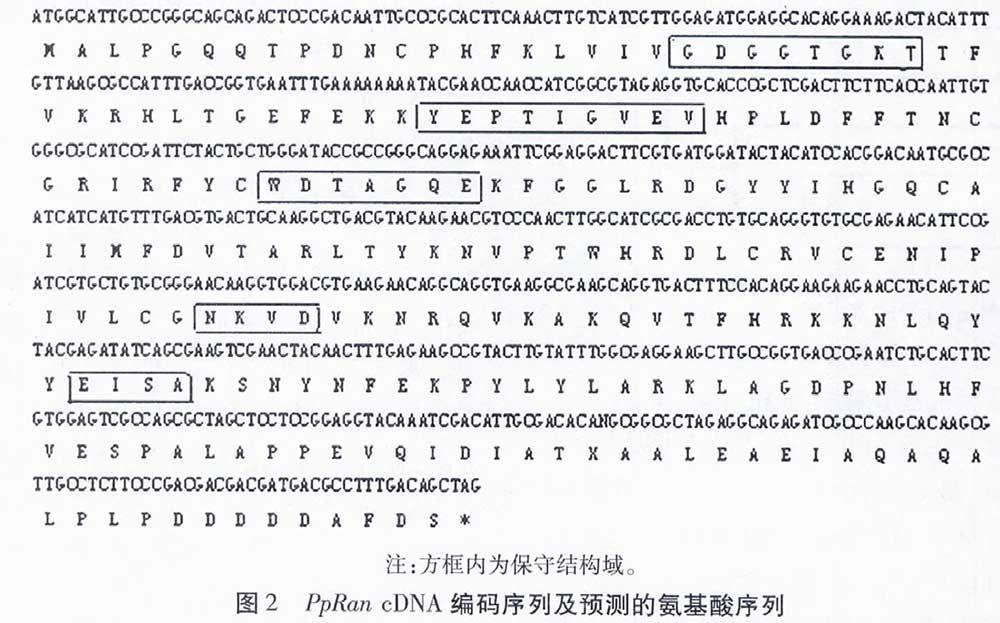
经PCR扩增得到约为700 bp的DNA片段(图1),将其命名为PpRan。经测序,PpRan ORF大小为672 bp,预测编码223个氨基酸。将预测的氨基酸序列提交NCBI保守域数据库进行比对,发现有5个Ras类GTP结合蛋白共有的保守区域(图2),这些区域是GTP及其辅助因子结合的区域。其中,“GDGGTGKT”与GXXXXGK(S/T)功能区相对应,是磷酸结合位点;“YEPTIGVEV”为Effector Loop区域;“WDTAGQE”区域负责结合GFP的τ-磷酸;“NKVD”与NKXD功能结构域相对应,对鸟嘌呤有特异的介导作用;“EISA”与FMETSA区域相对应,可与NKXD区域的D残基发生相互作用。
同源比对分析结果表明,PpRan编码的氨基酸序列与拟南芥、水稻、小麦、酿酒酵母、人的相似性分别达到了89%、87%、86%、73%、71%(图3)。在进化上与植物Ran蛋白具有更高的亲缘
关系(图4)。在动物中,Ran蛋白的C末端缺乏一个作为异戊二烯化受体位点的半胱氨酸残基,拥有一个酸性的C末端序列DEDDDL,而植物中的C末端保守序列为DDDDDL,小立碗藓是比较低等的植物,在进化上仅仅高于藻类,低于蕨类植物,其C末端保守序列与高等植物存在差异,为DDDDDA。
22 PpRan基因的表达模式分析
半定量RT-PCR分析发现,PpRan基因在茎叶体中的表达量最高,其次是在原丝体中,在假根中表达量很低(图5A)。因此,PpRan基因的表达具有组织特异性。
由图5B可以看出,受缺磷胁迫时PpRan基因表达量有所上升,并且随着缺磷胁迫时间的延长,表达量越来越高,但处理后第7天和第9天没有明显变化,说明表达量维持在此水平。
A:PpRan基因在小立碗藓不同组织中的表达模式,其中泳道1为假根,泳道2为茎叶体,泳道3为原丝体;B:PpRan基因对缺磷的响应,其中泳道1为对照,泳道2~6分别为缺磷处理后1、2、4、7、9天PpRan的表达
3 讨论
本研究克隆了小立碗藓Ran基因并对其序列进行测定,利用分子生物学分析软件和网络资源对测序结果进行分析,并根据基因序列和结构对其功能进行了预测。PpRan蛋白与其它植物有很高的同源性,属于植物Ran蛋白家族的一个成员。Ran是Ras蛋白的一个亚类,具有Ras蛋白的共同特点,所有的Ras蛋白都有相似的结构域[2]:N端1~165氨基酸是Ras蛋白功能结构域,负责结合、水解GTP;不同种类的Ras蛋白之间的差异主要发生在166~185氨基酸残基区域;Ras蛋白的C端有4个氨基酸残基组成的CAAX-BOX,其中C为半胱氨酸Cys,A代表任何一种脂族氨基酸,CAAX-BOX使Ras蛋白吸附在膜上,而与膜结合是Ras蛋白实现其生理功能所必须的。本实验从小立碗藓中克隆得到的编码低分子量GTP结合蛋白的PpRan基因,其编码的氨基酸序列C端没有4个氨基酸残基组成的CAAX-BOX,而是一段呈酸性的序列“PLPDDDDDA”,这与大多数Ras蛋白的特点不同,可能是PpRan蛋白为核蛋白,与拟南芥[3]、烟草[4]、马铃薯[5]的Ran蛋白相同,都是可溶的,存在于细胞质和细胞核中,不需要锚定在膜上。
本实验对小立碗藓不同组织中的PpRan基因的表达情况做了研究,发现在茎叶体中表达量最高,在原丝体组织中的表达量次之,假根中表达量最低,说明PpRan在小立碗藓中的表达具有组织特异性。可能茎叶体是小立碗藓最成熟、光合作用等发生的部分,因此表达量较高;原丝体是二维状态的小立碗藓组织,只是小立碗藓发育的一个过渡阶段,因此表达量较茎叶体次之;假根不是传统意义上的根,可能生活力较弱,表达量最低。在缺磷条件下,增强低浓度有效磷吸收能力是植物抵抗非生物胁迫所采取的一种适应机制,而这一机制的实现需要高亲和力Pi转运子的高效表达。李玉京等[6]认为在缺磷条件下植物对PO3-4吸收能力的增强信号,可能来自于植物体内PO3-4浓度的变化。我们推测PpRan蛋白也可能参与了这一信号的传导。Bun-ya等[7]在酿酒酵母Scerevisae中,分离到编码小G蛋白的Gtr1基因,该基因不仅参与调控酵母细胞分裂、生长的信号传导,而且和PH084 Pi转运子共同参与对Pi的吸收。本实验对小立碗藓进行缺磷处理,半定量PCR发现,小立碗藓假根中PpRan基因的表达量随着磷缺乏时间的延长而升高,这表明PpRan基因受缺磷胁迫的诱导,推测其可能在小立碗藓对缺磷胁迫应激反应中起着重要的作用。本实验结果与高建伟[8]对蓝粒小麦Ta-Ran 1的磷饥饿胁迫的诱导表达结果一致。由于小立碗藓在进化上低于小麦,本实验结果也说明了Ran-like基因在低等植物里也显示出在高等植物中相似的功能。
小立碗藓PpRan全长cDNA编码序列的获得以及该基因在不同组织和在非生物胁迫条件下的表达特性研究结果,为进一步研究其在非生物胁迫应答基因网络中的调控模式奠定了基础。PpRan基因编码蛋白的生物学功能还需进一步的研究。参 考 文 献:
[1] Nuoffer C,Balch W E GTPases: multifunctional molecular switches regulating vesicular traffic [J] Annual Review of Biochemistry, 1994, 63: 949-990
[2] 孙大业,郭艳林,马力耕细胞信号传导[M]北京:科学出版社,1998
[3] Haizel T, Merkle T, Turck F, et al Characterization of membrane-bound small GTP-binding proteins from Nicotiana tabacum [J] Plant Physiology,1995, 108(1): 59-67
[4] Merkle T, Haizel T, Matsamuto T, et al Phenotype of the fission yeast cell cycle regulatory mutant pim-1-46 is suppressed by a tobacco cDNA encoding a small, Ran-like GTP-binding protein [J] Plant Journal, 1994, 6(4):555-565
[5] Ach R A,Grusissem W A small nuclear GTP-binding protein from tomato suppresses a Schizosaccharomyces pombe cell-cycle mutant [J] Proceedings of the National Academy of Sciences of the United States of America, 1994, 91(13): 5863-5867
[6] 李玉京 高亲和力PO3-4转运子编码基因的cDNA克隆及特征分析[D]北京:中国科学院植物研究所,1999
[7] Bun-ya M,Harasnima S,Oshima Y Putative GTP-binding protein, Gtr1, associated with the function of the Pho84 inorganic phosphate transporter in Saccharomyces cerevisiae [J] Molecular and Cellular Biology, 1992, 12(7): 2958-2966
[8] 高建伟蓝粒小麦蓝色糊粉层色素合成及其色素合成途径相关基因的克隆以及编码小麦小Ras类GTP结合蛋白(Ran)基因的cDNA克隆及其表达特性分析[D]北京:中国科学院遗传与发育研究所,2001

