产后大出血、急性肾损伤
病史摘要
26岁女性患者,因“血压升高1.5月,无尿伴血清肌酐(SCr)升高半月余”入院。
现病史患者2012年11月妊娠36周体检时发现血压升高(具体不详),未予重视。2012-12-24在当地乡镇医院自然分娩,娩出第一胎时过程顺利,娩出第二胎时羊水红染大出血,伴腹痛、恶心、呕吐,同时有黑朦、四肢发凉,无意识丧失,予止血、输血等治疗(具体输血量不详),并转至当地县医院。入院后患者尿量逐渐减少至无尿,伴咳嗽、咳痰,SCr升高(具体不详),行右侧颈内静脉置管血液透析(HD)治疗2次后拔管。12月28日急诊查血红蛋白(Hb)75 g/L,血小板(PLT)正常,C反应蛋白(CRP) 170 mg/L,血清白蛋白(Alb) 25 g/L,乳酸脱氢酶(LDH) 1 641 U/L,SCr 522 μmol/L,淀粉酶 219 U/L,脂肪酶1 437 U/L,予头孢西丁抗感染及利尿、护胃等对症治疗。12月29日经左股静脉置管并行连续性肾脏替代治疗(CRRT)治疗,加用莫西沙星抗感染。12月30日血淀粉酶、脂肪酶进一步升高,腹部CT提示“胰头、小网膜囊内渗液,胰腺肿胀”,考虑“急性胰腺炎”,予留置胃管、禁食,并再次行CRRT治疗,同时加用乌司他汀、奥曲肽及白蛋白静脉滴注扩容治疗,无尿状态持续,遂收入院。
婚育史已婚,配偶体健,妊娠2次,育有1子2女,第一次妊娠分娩过程顺利,妊娠及分娩时血压正常。
既往史、个人史、家族史无特殊。
体格检查血压126/90 mmHg,心率82次/min,急性病容,贫血貌,鼻胃管在位,引流少许墨绿色液体,左侧股静脉置管在位,敷料干燥,心脏查体未见异常,双下肺呼吸音低,无干湿性啰音,腹部膨隆,腹壁皮肤大片淤斑,全腹轻压痛,伴反跳痛,肝脾未扪及,宫底脐下2 cm,有压痛,双下肢无水肿,阴道内少许暗红色血性分泌物。
辅助检查
尿液 尿沉渣红细胞计数140万/ml(均一型),白细胞0~1/HP;尿蛋白定量0.21 g/24h(尿量50 ml),N-乙酰-β-D-氨基葡萄糖苷酶(NAG)133.6 U/(g·cr),视黄醇结合蛋白(RBP) 44.6 mg/L。
血液 血常规:Hb 60 g/L,网织红细胞 4.6%,白细胞15.3×109/L,(中性粒细胞83%,淋巴细胞 12%),PLT 27.9×109/L,CRP 99.9 mg/L。血生化:Alb 24.4 g/L,球蛋白15.9 g/L,胆红素及转氨酶正常,LDH 922 U/L;尿素氮77.2 mg/dl,SCr 917.6 μmol/L,尿酸649 μmol/L;淀粉酶290 U/L,脂肪酶1 663 U/L,总胆固醇4.3 mmoL/L,三酰甘油3.72 mmol/L;钾5.82 mmol/L,钠134.6 mmol/L,氯99.3 mmol/L,总二氧化碳15.6 mmol/L,钙1.81 mmol/L,磷2.62 mmol/L;空腹血糖3.8 mmol/L。血清铁18 μmol/L,总铁结合力68 μmol/L,未饱和铁结合力50 μmol/L。凝血功能:凝血酶原时间12.4s,活化的部分凝血活酶时间30.8s,国际标准化比值(INR)1.08,凝血时间19.6s,纤维蛋白原334 mg/L,D-二聚体0.53 mg/L。
免疫检查 IgG 6.21 g/L(7~16 g/L),IgA 及IgM正常,抗“O”78.5 IU/ml,类风湿因子及补体正常;狼疮抗凝物(LA)阳性,抗β2糖蛋白Ⅰ抗体36.22 RU/ml(正常值<20 RU/ml);抗内皮细胞抗体1∶80阳性,抗核抗体(ANA)、抗双链DNA抗体(ds-DNA)、ENA多肽谱、抗中性粒细胞胞质抗体以及抗心磷脂抗体均阴性。外周血淋巴细胞亚群正常。直接、间接抗人球蛋白试验、血清酸化溶血试验阴性。
特殊检查 外周血红细胞碎片正常;内皮细胞功能:血管内皮细胞黏附分子(VCAM) 1 398.7 ng/ml(正常值300~1 000 ng/ml),血栓调节蛋白(TM) 6.54 ng/ml(正常值3.15~5.8 ng/ml),循环内皮细胞及E选择素正常。
其他 眼底检查未见明显异常。床边胸片:(1)两肺弥漫性改变,考虑肺水肿;(2)两侧胸腔积液。妇科彩超:(1)宫腔内声像图表现,考虑较多蜕膜组织伴积血可能;(2)双附件显示不清。心脏超声示心影增大。头颅MRI未见异常。
双肾B超 左126 mm×44 mm×63 mm;右126 mm×38 mm×63 mm,皮质回声增强,皮髓界限不清,集合系统松散(2013-01-07,图1);复查左94 mm×37 mm×47 mm,右98 mm×32 mm×49 mm,双肾皮质变薄,肾内结构不清,轮廓不规则,血流信号稀疏,血管树显示不清楚(2013-02-28,图2)。

图1 病初双肾体积增大,皮质回声增强,集合系统松散
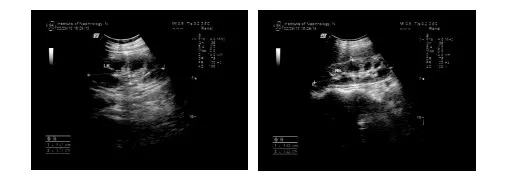
图2 病后1月余双肾体积较前缩小,结构差
诊疗分析青年女性,既往首次妊娠过程顺利。本次为第二次双胎妊娠,孕早、中期过程基本顺利,妊娠36周时发现高血压,分娩第二胎时大出血,临床多系统功能受累,肾脏表现为少尿性急性肾损伤(AKI),无明显镜下血尿及蛋白尿,同时合并急性充血性心力衰竭、肺水肿和急性胰腺炎。依据上述特点,患者发生AKI应首先考虑以下原因。
妊娠相关血栓性微血管病(TMA) 包括先兆子痫/溶血、肝酶升高和血小板减低(HELLP)综合征、妊娠急性脂肪肝及血栓性血小板减少性紫癜(TTP)等。先兆子痫是指既往无高血压和蛋白尿的孕妇,在妊娠20周后新发高血压和蛋白尿,常伴水肿和高尿酸血症为特征的一组临床综合征,约占妊娠的5%~7%[1,2]。临床以高血压、蛋白尿、水肿、视力障碍、头痛和上腹部疼痛等为著,严重者出现溶血、肝酶升高和HELLP综合征,其风险因素包括初产妇、高龄产妇、多胎妊娠、高血压病史等。该患者为经产妇多胎妊娠,妊娠末期出现血压升高,但患者无水肿、头痛、蛋白尿表现,因此先兆子痫诊断不成立。
妊娠急性脂肪肝表现为妊娠晚期出现急性肝功能衰竭和凝血功能异常,特征性表现为高胆红素血症、肝酶升高、低血糖和白细胞增多,凝血功能异常表现为低纤维蛋白原、凝血酶原时间延长、抗凝血酶Ⅲ降低和血小板减低,该患者临床表现明显与之不符。
妊娠相关TTP特征性表现为血小板减少、溶血、AKI及其神经系统损害。该患者产后出现AKI,LDH明显升高伴贫血,但红细胞碎片及游离血红蛋白正常,无血小板减少,以上均不支持该病诊断,肾活检未见TMA样病变,亦可除外此类疾病。
急性肾小管坏死(ATN) 患者分娩大出血后起病,病程中有低血压、休克的表现,之后出现少尿型AKI,支持失血性休克所致的缺血性ATN,但患者肾功能恢复不佳,临床考虑该诊断可能性小。
脓毒症性AKI 患者产后有咳嗽、咳痰等表现,伴血像、CRP明显升高,CT示两肺弥漫性病变(水肿),提示其有肺部感染,但该患者病程中无持续发热,肺部感染治愈后,肾功能持续不恢复亦不支持该诊断。
肾皮质坏死 患者双胎妊娠分娩中大出血急骤起病,多系统受累,肾功能恢复不佳,临床应高度警惕妊娠相关的肾皮质坏死。
抗磷脂抗体综合征 患者为育龄期女性,抗β2糖蛋白抗体、LA阳性,临床亦不除外抗磷脂抗体综合征引起的多系统受累。
系统性红斑狼疮、狼疮性肾炎(LN) 青年女性患者,妊娠起病,临床多系统受累,临床需警惕该病,但患者ANA、ds-DNA、ENA多肽谱均阴性,补体正常,临床可排除LN。
诊疗经过入院后予胃肠减压、禁食、生长抑素、抑酸等治疗胰腺炎,经间断CRRT维持内环境稳定,比阿培南、奥硝唑、扶康唑抗感染,刮宫术清除宫腔残留物,输血纠正贫血等治疗后,患者胃肠道症状明显好转,脂肪酶、淀粉酶逐渐降低,咳嗽、咳痰症状好转,体温正常,逐渐停用胃肠减压、生长抑素、抗感染药物。于2013-01-16行肾穿刺活检术。
肾活检
光镜 42个肾小球。片状凝固性坏死,肾小球、肾小管、血管正常结构消失,仅见膜样结构,肾小球内红细胞堆积,一处动脉管腔内见纤维素样物质(图3A)。未坏死组织中见3个肾小球,一处节段硬化,未硬化处系膜区增宽不明显,血管袢开放尚好,节段袢分层(图3B)。肾小管间质急性病变基础上伴慢性病变。急性病变包括肾小管上皮细胞刷状缘脱落,管腔内见蛋白管型及淡黄色结晶、偏振光下具有折光性;间质散在单个核细胞浸润;慢性病变包括灶性或条索状肾小管萎缩、基膜增厚。动脉内皮细胞肿胀,管腔狭窄,血栓形成。
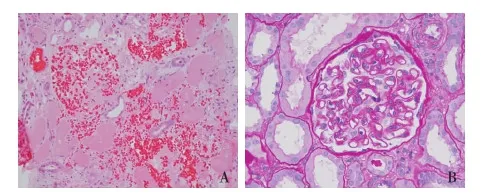
图3 A:肾小球、肾小管及血管正常结构消失(HE,×200);B:未坏死区域肾小球结构大致正常(PAS,×400)
免疫荧光 IgM+,C3++,呈细颗粒状弥漫沉积于血管袢,节段袢渗出样阳性着色;C1q+,节段呈颗粒状沉积于系膜区。
最终诊断产后大出血:(1)肾皮质坏死;(2)AKI 3期。
随访结合患者病史、临床表现及肾活检病理诊断为肾皮质坏死,予低分子肝素抗凝,虫草制剂护肾治疗,出院后继续行HD治疗;1月后尿量增至500 ml/d,透前SCr在574.6 μmol/L左右,HD改为2次/周。
讨 论
肾皮质坏死是病理学诊断名词,以肾脏皮质组织坏死继而钙化为特征,髓质部分受累或无累及。皮质弥漫坏死者可造成不可逆性肾衰竭,而片状坏死者肾功能最终可能部分恢复,但恢复所需时间远较ATN长,可达数倍之久(与病初无尿持续时间相关),且患者均逐渐发展为终末期肾病。
肾皮质坏死是最为严重的AKI类型,属灾难性AKI,占所有AKI的2%,在部分发展中国家甚至高达6%~7%,占发达国家妊娠相关AKI的15%~20%,预后极差[3]。随着社会经济条件的好转和孕妇保健的改善,近20年来妊娠所致的急性肾皮质坏死显著降低,而非妊娠所致的急性肾皮质坏死比例升高。Kim等[4]分析了1980年~1995年急性肾皮质坏死的28篇英文文献,产科因素由1980年前的约70%下降到约30%,而非产科原因上升到约70%,但在发展中国家产科因素仍是其主要致病原因[4,5]。
非妊娠相关的肾皮质坏死常见原因为脓毒症、蛇咬伤、肿瘤及溶血尿毒综合征(HUS)[6-10]。此外移植引起的急性排斥反应患者肾皮质坏死的发生率也较高,尤其是体液免疫介导的超急性排斥反应[11]。近年发现病因有抗磷脂综合征、冷球蛋白血症及头孢呋肟、氨甲环酸等药物所致[12-15]。
产科相关肾皮质坏死最常见诱因为胎盘早剥,其他诱因还有前置胎盘出血、难产或脓毒症性流产等[16]。产科性肾皮质坏死有两个发病高峰:第一个高峰见于妊娠30~35周时、年龄>30岁的经产妇;第二高峰常见于早期脓毒症和非脓毒症性流产后[17,18]。其发病机制尚未明确,出血、休克及毒血症等因素导致的全身血管痉挛、微循环损伤和血管内凝血,引起肾小叶间动脉和入球小动脉收缩、血管内膜损伤;如诱因持续存在不消除,可导致肾动脉灌注压持续下降、弥漫性血管内凝血和血栓形成,最终导致肾皮质缺血。而包膜下皮质由肾外血管供血而免于受累。
妊娠期之所以肾皮质坏死高发,可能与性激素增加使肾血管系统更易收缩、前凝血因子生理性增加、对革兰阴性菌内毒素易感性增加等因素相关[19,20]。动物实验显示妊娠动物单次注射小剂量内毒素即可导致肾皮质坏死表现,非妊娠动物需要间隔24h两次注射才能诱导相似反应。Stratta等[21]报道妊娠相关AKI是否进展至肾皮质坏死,唯一相关因素为胎盘早剥,与母亲年龄、产次、胎龄、先兆子痫或子痫严重程度均无关。胎盘早剥时,可并发大出血,大量组织因子进入血循环、激活凝血系统、导致弥散性血管内凝血(DIC),此外同时易并发感染。上述因素导致血管内皮受损、肾血管强烈收缩、局部微血管形成,进而导致肾皮质坏死。
内皮细胞受损后内皮素1(ET-1)释放在急性肾皮质坏死的发生发展中起重要作用,ET-1是已知最强的缩血管物质,且肾脏血管对其的敏感性是其他器官血管的10倍。肾脏低灌注、细胞内毒素、蛇毒和HUS等均可直接或间接造成内皮细胞受损,ET-1释放而诱发和加重肾皮质缺血坏死[22]。
肾皮质坏死临床表现无特异性,突发无尿是急性肾皮质坏死最常见和最主要的临床症状。发病初多伴原发病的临床表现,如病理性妊娠、感染性休克等表现。妊娠相关的急性肾皮质坏死多见于>30岁多次妊娠者。妊娠35周左右胎盘早剥,引起出血、低血压,继之发生无尿。此前患者可有毒血症或高血压,有的伴子痫:无规律的腰痛、触痛、轻度发热、血压正常或偏低、肉眼血尿。同时可伴其他脏器严重受累,如DIC、心肌炎、肝坏死,脑部病变常引起惊厥,同时可存在胰腺和消化道缺血,甚至可并发脑垂体和肾上腺细胞溶解。
肾脏病理是其诊断的金标准。组织学改变病变性质与患病时间有一定关联,最初24h肾小球病变从轻的、少量的纤维素沉积,逐渐进展至整个肾小球毛细血管袢扩张、充血;36~72h全部肾脏的整个肾小球坏死。入球动脉坏死,管腔内充满血栓及纤维素。血栓从叶间动脉蔓延至坏死边缘,终止于弓状动脉。2~3周后血栓机化。由于皮质组织减少,纤维组织增加,肾脏体积逐渐缩小[23]。坏死组织和尚正常组织的界限十分明确。例如坏死区域的肾小球毁损,同时可见中性多形核白细胞浸润,而非坏死区则完全无损。
该患者属第二次双胎妊娠,分娩时第一个胎儿顺利娩出,第二胎娩出时伴大出血起病,伴黑朦、四肢发凉、腹痛等休克表现,续而出现少尿、肾功能不全、急性胰腺炎、心力衰竭及肺水肿等多脏器衰竭表现,经肾活检证实为肾皮质坏死。依据患者上述发病经过,考虑该患者急性肾皮质坏死的主要原因为病理性妊娠及失血性休克。患者娩出第二胎时羊水红染大出血,提示存在胎盘早剥可能。胎盘早剥后羊水等有毒物质进入母体体内,损伤血管内皮细胞,严重时甚至发生凝血障碍、DIC。本患者临床及实验室检查未提示凝血障碍,但内皮功能指标VCAM、TM升高,且组织学见未受累肾小球外周袢分层、动脉内皮细胞肿胀,均提示内皮细胞受损,进而促进血栓形成。此外产后大出血致失血性休克,肾脏、胰腺等内脏血管强烈收缩、痉挛,局部血管损害、血栓形成,进而引起肾皮质坏死、胰腺炎。肾皮质坏死后尿量减少,进而导致容量负荷过重,出现急性心功能不全及肺水肿表现。
本患者为育龄期女性,抗β2糖蛋白抗体及LA阳性,肾活检见动脉血栓形成,临床应警惕抗磷脂综合征。抗磷脂抗体综合征是由抗磷脂抗体引起的一组自身免疫性疾病,临床表现为反复发生的动静脉血栓、习惯性流产和血小板减少,以血中存在的抗磷脂抗体等自身抗体为特征。其中血栓形成可发生在全身各个脏器,尤其以神经系统病变最为常见。Kim等[24]报道抗磷脂抗体综合征并发双肾皮质坏死亦屡见不鲜。抗磷脂抗体综合征诊断主要依据抗磷脂抗体阳性及动脉血栓临床表现,且间隔12周复查抗体仍为阳性诊断方能成立。此外LA阳性亦可见于药物因素(氯丙嗪、抗生素、普鲁卡因、肝素类等)及感性性疾病,8%的正常女性亦可出现阳性。
该患者发病后存在发热、血白细胞及CRP明显升高,考虑合并感染,诊疗过程中予多种抗生素及低分子肝素抗凝治疗,不排除上述因素所致的LA阳性。且患者既往妊娠分娩顺利,无习惯性流产及皮肤网状青斑等反复动静脉血栓形成表现,故临床考虑抗磷脂抗体综合征可能性小,建议在随访中监测抗β2糖蛋白抗体及狼疮抗凝物变化。
小结:肾皮质坏死主要病因仍属病理妊娠,妊娠患者发生不可逆性AKI,应高度考虑此病。肾皮质坏死预后极差,因此临床医师要充分重视孕产妇围生期的健康评估,同时尽早诊断治疗,有助于改善患者预后。
(张丽华 谢红浪 刘志红 整理)
1 James PR,Nelson-Piercy C.Management of hypertension before,during,and after pregnancy.Heart,2004,90(12):1499-1504.
2 Duckitt K,Harrington D.Risk factors for pre-eclampsia at antenatal booking:systematic review of controlled studies.BMJ,2005,330(7491):565.
3 Goplani KR,Shah PR,Gera DN,et al.Pregnancy-related acute renal failure:A single-center experience.Indian J Nephrol,2008,18(1):17-21.
4 Kim HJ.Bilateral renal cortical necrosis with the changes in clinical features over the past 15 years (1980-1995).J Korean Med Sci,1995,10(2):132-141.
5 Ali SS,Rizvi SZ,Muzaffar S,et al.Renal cortical necrosis:a case series of nine patients & review of literature.J Ayub Med Coll Abbottabad,2003,15(2):41-44.
6 Lauler DP,Schreiner GE.Bilateral renal cortical necrosis.Am J Med,1958,24(4):519-529.
7 Matlin RA,Gary NE.Acute cortical necrosis.Case report and review of the literature.Am J Med,1974,56(1):110-118.
8 Kleinknecht D,Grünfeld JP,Gomez PC,et al.Diagnostic procedures and long-term prognosis in bilateral renal cortical necrosis.Kidney Int,1973,4(6):390-400.
9 Prakash J,Tripathi K,Pandey LK,et al.Renal cortical necrosis in pregnancy-related acute renal failure.J Indian Med Assoc,1996,94(6):227-229.
10 Oram S,Ross G,Pell L,et al.Renal cortical calification after snake-bite.Br Med J,1963,1(5346):1647-1648.
11 Van Geet C,Proesmans W,Arnout J,et al.Activation of both coagulation and fibrinolysis in childhood hemolytic uremic syndrome.Kidney Int,1998,54(4):1324-1330.
12 Campbell AC,Henderson JL.Symmetrical cortical necrosis of the kidneys in infancy and childhood.Arch Dis Child,1949,24(120):269-285.
13 Palapattu GS,Barbaric Z,Rajfer J.Acute bilateral renal cortical necrosis as a cause of postoperative renal failure.Urology,2001,58(2):281.
14 Williams GM,Hume DM,Hudson RP Jr,et al."Hyperacute" renal-homograft rejection in man.N Engl J Med,1968,279(12):611-618.
15 Kim JO,Kim GH,Kang CM,et al.Bilateral acute renal cortical necrosis in SLE-associated antiphospholipid syndrome.Am J Kidney Dis,2011,57(6):945-947.
16 Thaunat O,Aaron L,Desbene C,et al.Type III cryoglobulinemia complicated by renal cortical necrosis.Am J Kidney Dis,2005,45(5):e79-e81.
17 Manley HJ,Bailie GR,Eisele G.Bilateral renal cortical necrosis associated with cefuroxime axetil.in Nephrol,1998,49(4):268-270.
18 Koo JR,Lee YK,Kim YS,et al.Acute renal cortical necrosis caused by an antifibrinolytic drug (tranexamic acid).Nephrol Dial Transplant,1999,14(3):750-752.
19 Smith K,Browne JC,Shackman R,et al.Acute renal failure of obstetric origin:an analysis of 70 patients.Lancet,1965,2(7408):351-354.
20 Gant NF,Chand S,Whalley PJ,et al.The nature of pressor responsiveness to angiotensin II in human pregnancy.Obstet Gynecol,1974,43(6):854.
21 Stratta P,Canavese C,Colla L,et al.Acute renal failure in preeclampsia-eclampsia.Gynecol Obstet Invest,1987,24(4):225-231.
22 Husberg B,Linell F,Nilsson T,et al.Renal cortical necrosis induced in rabbits by local perfusion followed by systemic administration of endotoxin.Eur Surg Res,1975,7(4-5):230-241.
23 Alexopoulos E,Tambakoudis P,Bili H,et al.Acute renal failure in pregnancy.Ren Fail,1993,15(5):609-613.
24 Kim JO,Kim GH,Kang CM,et al.Bilateral acute renal cortical necrosis in SLE-associated antiphospholipid syndrome.Am J Kidney Dis,2011,57(6):945-947.

