抗肾小球基膜肾炎合并膜性肾病
病例摘要
病史29岁男性,因“发热4月,尿检异常1月,肾功能不全2周,肉眼血尿2d”于2013-05-31入院。
患者于2013年2月无诱因低热伴头晕乏力,体温最高37.4℃,伴轻微咳嗽,无咳痰、咯血,未予治疗。2013年4月底因症状无改善,当地医院检查后诊断为“甲状腺功能亢进症”,予丙硫氧嘧啶(PTU)治疗。1周后发现尿色深,查尿蛋白+++,隐血+++,无尿频、尿急、尿痛,无尿量减少。5月9日查尿蛋白定量3.41 g/24h,尿沉渣红细胞计数(RBC)560 万/ml(多形型),血清肌酐(SCr)92.8 μmol/L,pANCA、cANCA阴性,嘱患者停用PTU。5月13日患者回当地医院查血红蛋白(Hb)103 g/L,白细胞计数(WBC)、血小板(PLT)正常, 游离三碘甲状腺原氨酸(FT3)增高(7.06 pmol/L),游离甲状腺素(FT4)增高(36.29 pmol/L),促甲状腺激素(TSH)下降(0.01 mIU/L),1周内SCr升至222 μmol/L,补体C3 1.26 g/L,C4 0.41 g/L,尿蛋白定量3.29 g/24h,RBC 1 800万/ml(多形型)。5月15日外院肾活检免疫荧光示IgG沿血管壁呈线状及颗粒状沉积,光镜肾小球血管袢纤维素样坏死性病变及基膜增厚伴钉突形成,诊断为“显微镜下血管炎性肾损伤,膜性肾病待排”。5月21日开始予甲泼尼龙0.5 g/d冲击治疗3d,继以泼尼松30 mg/d口服,5月25日予环磷酰胺(CTX)0.4g冲击治疗一次。5月29日突发肉眼血尿伴腹痛、腹胀,急诊查尿蛋白++、 隐血+++,Hb 98 g/L,WBC 13.4×109/L,SCr 184 μmol/L,以“急进性肾炎综合征”收住我科。病程中患者精神尚可,感乏力、纳差,睡眠正常,体重减轻2.5 kg,大便正常,尿色深,尿量约1 500 ml/d。
既往史2003年行阑尾切除术。婚育史及家族史无特殊。
体格检查体温37.7 ℃,血压146/87 mmHg,心率89次/min,呼吸23次/min。心律齐,各瓣膜区未闻及病理性杂音;双肺呼吸音清,未闻及干湿啰音;腹软,无压痛、反跳痛及肌紧张,移动性浊音阴性,右下腹可见一5 cm左右手术瘢痕;双下肢无水肿及皮疹。
尿液 蛋白定量3.65 g/24h,RBC 4 200万/ml(多形型),WBC 0~1/HP,管型阴性。C3 4 mg/L (正常值≤2.76 mg/L),α2巨球蛋白5 mg/L (正常值≤2.87 mg/L)。肾小管损伤标志物:N-乙酰-β-D-氨基葡萄糖苷酶(NAG)62.6 U/(g·Cr)[正常值≤16.5 U/(g·Cr)],视黄醇结合蛋白(RBP)16.9 mg/L (正常值≤0.5 mg/L)。中性粒细胞明胶酶相关载脂蛋白(NGAL)19.40 μg/L(正常值<20 μg/L),肾损伤分子1(KIM-1) 0.47 μg/L(正常值<0.4 μg/L),白细胞介素18(IL-18)10.29 ng/L(正常值<20 ng/L)。
血常规 Hb 90 g/L,WBC 7.8×109/L,PLT 265×109/L。
血生化 白蛋白32.7 g/L,球蛋白18.7 g/L,尿素氮15.3 mmol/L,SCr 269 μmol/L,尿酸418 μmol/L,谷丙转氨酶17 U/L,谷草转氨酶15 U/L,乳酸脱氢酶197 U/L,钾4.37 mmol/L,钠141.4 mmol/L 氯106 mmol/L,二氧化碳31.8 mmol/L,钙2.17 mmol/L,磷1.84 mmol/L,C反应蛋白(CRP) 22.4 mg/L。空腹血糖4.95 mmol/L。
免疫学 IgA 1.660 g/L、IgG 7.680 g/L、IgM 0.769 g/L;C3 1.15 g/L,C4 0.343 g/L。抗肾小球基膜(GBM)抗体荧光法1∶160,酶标法139.37 RU/ml。cANCA、pANCA、MPO-ANCA、PR3-ANCA、ANA、dsDNA阴性。抗脐静脉内皮细胞抗体(AECA)1∶40。抗磷脂酶A2受体抗体阴性。
其他 甲状腺功能:T3 0.59 nmol/L(1.23~3.07 nmol/L),FT3 2.98 pmol/L(3.8~6.5 pmol/L),T4、FT4 正常,TSH 0.01~0.4 mIU/L(0.3~4.5 mIU/L),甲状腺球蛋白正常。甲状腺自身抗体:抗甲状腺球蛋白抗体、甲状腺微粒体抗体、甲状腺过氧化物酶抗体、促甲状腺激素受体抗体均正常。乙肝标志物:HBsAb(+),余阴性。外周血淋巴细胞亚群:CD3+494个/μl,CD4+304个/μl,CD8+164个/μl,CD4+/CD8+1.85。T细胞斑点检测(T-spot)阴性。痰培养及血培养阴性。大便常规正常。
双肾B超左127 mm×48 mm×63 mm;右126 mm×56 mm×63 mm,肾皮质厚度不清,皮质回声增强,皮髓界限欠清楚,包膜连续完整。
辅助检查胸部CT:左肺尖陈旧性结核。颅脑CT:双侧筛窦少许炎症;鼻中隔偏曲。
选取2017级临床医学专业9~13班学生60名,随机分为教改组和对照组,每组30名。对照组采用传统教学模式,教改组则采用“基于微课的翻转课堂+对分课堂”教学模式。期末考试试题一致,考试成绩以卷面成绩为主,占80%,标本考试占20%。课程结束后向教改组学生发放纸质无记名调查问卷,并对两组的考试成绩进行统计分析。
患者入院后查抗GBM抗体阳性,结合临床符合抗GBM肾炎诊断,但仍存在低热,无咳嗽、咳痰,经抗感染治疗后体温逐渐趋于正常,予双重血浆滤过2次、甲泼尼龙0.5 g/d冲击2d及输注红细胞悬液等对症支持治疗,SCr降至179 μmol/L,抗GBM抗体降至87.69 RU/ml,但尿检仍无显著缓解,于2013-06-14行肾活检术以一步明确诊断。
肾活检病理
光镜 皮质肾组织2条。25个肾小球,2个球性废弃。未废弃肾小球中见14个细胞性新月体(图1A),多个肾小球伴节段袢坏死(图1B)。余正切肾小球体积增大,少数节段系膜区轻度增宽,毛细血管袢开放、僵硬(图1C),囊壁节段增厚。PASM-Masson:GBM上皮侧较多嗜复红物沉积及钉突形成(图1B、C)。肾小管间质急性病变重度,片状肾小管上皮细胞刷状缘脱落,见小管炎,管腔内见蛋白管型、红细胞管型及白细胞管型;间质灶性单个核细胞及中性粒细胞浸润。动脉未见明确病变。
免疫荧光 IgG++,呈线状伴颗粒状弥漫分布于血管袢(图1D);C3++,呈颗粒状沉积于血管袢(图1E);IgA、IgM、C1q阴性。3个肾小球Fibrin节段阳性。IgG1++,在线状分布的基础上伴颗粒状沉积于血管袢;IgG2+,呈线状伴少量颗粒状沉积于血管袢;IgG3+、IgG4+,主要以颗粒状沉积于血管袢线状沉积相对较弱。κ轻链+、λ轻链++,呈线状及颗粒状弥漫分布于血管袢。
电镜 观察3个肾小球,其中2个球见细胞性新月体,1处基膜断裂,邻近囊腔内见纤维蛋白分布。肾小球毛细血管袢开放好,基膜上皮侧较多高电子密度致密物沉积,多数致密物被“钉突”分隔、少数被包绕(图1F),少数致密物溶解、密度减低;基膜内皮下一处中-高电子密度致密物沉积。肾小球系膜区略增宽,未见电子致密物沉积。肾小球足细胞足突广泛融合(80%~90%),较多胞质微绒毛化,见吞噬性溶酶体。肾小管基膜未见电子致密物沉积。

图1 A:肾小球细胞性新月体形成 (PAS,×400);B:肾小球新月体形成,见节段袢坏死(),基膜上皮侧钉突形成()(PASM-Masson,×600);C:肾小球开放的毛细血管袢略僵硬,上皮侧嗜复红物沉积(Masson三色,×400);D: IgG++,呈线状伴颗粒状弥漫分布于肾小球毛细血管袢(IF,×400) ;E: C3++,呈颗粒状弥漫分布于肾小球毛细血管袢(IF,×400); F:肾小球基膜上皮侧高电子密度致密物沉积,致密物被钉突分隔、包绕(EM)
小结 抗GBM肾炎合并膜性肾病。
该患者经肾活检明确诊断后,再行甲泼尼龙0.5g冲击3次,血浆置换1次,后续予泼尼松45 mg/d,3周后SCr降至110 μmol/L,复查抗GBM抗体降至31.43 RU/ml,尿检好转(尿蛋白定量2.23 g/24h,RBC 950万/ml,多形型)。
讨 论
青年男性,病程4月,临床以急进性肾炎综合征(急性起病,肉眼血尿、肾功能进行性下降、贫血)起病伴大量蛋白尿,肾外症状有低热、鼻窦炎、腹痛。因血FT3、FT4增高,TSH低下,外院诊断为“甲状腺功能亢进症”,使用PTU治疗12 d,复查FT3低下、FT4正常。外院肾活检为显微镜下血管炎性肾损伤,膜性肾病待排,予甲泼尼龙冲击及CTX治疗,病情未控制。为明确诊断,患者入院行重复肾活检。
肾活检病理光镜改变突出表现在两方面:(1)肾小球大量新月体形成(56%),均为细胞性新月体,同时伴节段袢坏死,符合新月体肾炎诊断标准;(2)开放的肾小球毛细血管袢僵硬,特殊染色及电镜证实肾小球上皮侧存在免疫复合物沉积,符合膜性肾病诊断。
该患者的免疫荧光具有特殊性。低倍镜下观察,IgG呈颗粒状沿肾小球毛细血管袢弥漫分布;在高倍镜下仔细观察发现,IgG在颗粒状分布同时存在连续线状沉积的背景,GBM轮廓清晰可见,同时基膜内、外侧缘与周围背景境界清晰(图2A)。与单纯膜性肾病的免疫荧光IgG沉积特点相比,单纯膜性肾病IgG无颗粒沉积的部位与周围背景亮度相同,无线状沉积的背景(图2B)。该患者C3的沉积方式与特发性膜性肾病的IgG和C3沉积方式类似,无线状沉积的背景,因此,其IgG在线状沉积的基础上伴颗粒状沉积,颗粒状沉积与膜性肾病相关。需根据IgG线状沉积的特点进行鉴别诊断。IgG线状沉积于毛细血管袢最常见于抗GBM肾炎,光镜下可为新月体肾炎。其次还见于重链沉积病,但重链沉积病常同时伴IgG线样沉积于肾小管,且光镜下结节病变常见,电镜观察GBM内侧缘和肾小管基膜外侧缘见颗粒状电子致密物沉积。此外,糖尿病肾病亦可见IgG线样沉积于GBM和肾小管基膜,但电镜下无电子致密物沉积,光镜下也以结节性病变多见。该患者线样沉积仅分布于肾小球毛细血管袢,无肾小管沉积,亦无结节性病变,电镜下见上皮侧电子致密物分布,临床无糖尿病,结合患者光镜下肾小球存在节段袢坏死和新月体,临床抗GBM抗体阳性,最终诊断考虑抗GBM肾炎合并膜性肾病。
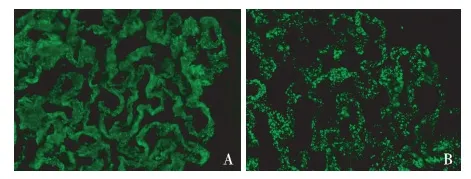
图2 A:本例患者 IgG++,在颗粒状分布于血管袢,同时存在连续线状沉积的背景;B:特发性肾小球膜性病变患者 IgG++,呈颗粒状沉积于血管袢,无线状沉的背景(IF,×600)
该患者存在肾小球节段袢坏死伴新月体,临床曾因“甲状腺功能亢进症”使用PTU药物治疗,应与PTU相关性血管炎鉴别[1]。PTU相关性血管炎光镜下常表现为寡免疫复合物节段坏死性肾炎伴新月体形成,少数病例表现节段坏死性肾炎伴膜性病变,但免疫荧光无IgG线样沉积,临床常伴ANCA阳性,虽然患者有低热、鼻窦炎等肾外表现,但该患者的免疫病理不符合PTU相关性血管炎,且ANCA检测阴性。
临床上常有膜性肾病合并其他疾病,如膜性肾病合并DN[2]、 膜性肾病合并系统性淀粉样变性[3]、膜性肾病合并系统性血管炎[4]等。当膜性肾病出现急性肾损伤,应考虑可能合并其他疾病的情况,如新月体肾炎、间质性肾炎、恶性高血压、肾静脉血栓等。对于有肉眼血尿的患者,应积极检查ANCA和抗GBM抗体,在条件允许的情况下争取行肾活检明确诊断。
1974年,Klassen等[5]首次报道膜性肾病合并抗GBM肾炎,至今报道近30例[6-8],绝大多数为个
案报道。光镜下均表现为肾小球大量新月体形成,大多数为细胞性,亦见纤维细胞性新月体,伴或不伴纤维素样坏死,少数病例报道银染下GBM钉突形成[6,9]。免疫荧光主要表现三类:(1)约半数报道的病例IgG呈颗粒状及线状沉积于肾小球毛细血管袢,IgG颗粒状沉积、同时可见线状沉积背景多见[6],少数文献报道IgG染色GBM内侧缘线状沉积(抗GBM抗体与GBM结合),外侧缘细颗粒状沉积(GBM上皮侧沉积物)[9,10],低倍镜下观察可能难以区分,需借助高倍镜仔细观察。本文报道的病例与前者相类似,也表现为线状沉积的背景存在颗粒状沉积。(2)约1/3报道的病例IgG呈颗粒状沉积于肾小球毛细血管袢。(3)IgG线状沉积于肾小球毛细血管袢。超微结构均见肾小球上皮侧电子致密物沉积。由此可见,抗GBM肾炎需要电镜观察是否存在电子致密物,以避免漏诊合并的其他肾小球疾病。
Basford等[6]将这些病例汇总分析,按照肾小球膜性病变与抗GBM肾炎起病时间先后顺序不同将病例分为3类(表1):(1)肾小球膜性病变起病在前者均为中老年患者,肾脏表现以水肿为主,预后差;(2)抗GBM肾炎起病在前者均为青年患者,肾脏表现均为血尿,预后好;(3)抗GBM肾炎与肾小球膜性病变同时被发现者年龄16~71岁,肾脏表现为血尿或水肿为主,约半数患者肾脏进入终末期肾病(ESRD)或死亡,约半数患者治愈。本例患者为青年男性,抗GBM肾炎与肾小球膜性病变同时被发现,临床存在肉眼血尿及肾病范围蛋白尿,经甲泼尼龙冲击(共4g)及双重血浆滤过治疗,病情明显改善,由于时间短,具体预后有待以后随访观察。

表1 抗GBM肾炎合并肾小球膜性病变文献报道汇总
抗GBM肾炎合并膜性肾病的发病机制尚不明了。抗GBM肾炎的发病主要是针对GBM Ⅳ型胶原α3和α5链非胶原区(NC1)的自身抗体产生[11]。膜性肾病的发病机制可能与针对肾小球足细胞分子、种植在上皮侧的外源性抗原的抗体或者循环免疫复合物沉积相关。GBM上皮侧免疫复合物的沉积可能使GBM受损、抗原释放,或者隐藏的抗原位点暴露,抗GBM抗体与之结合;同样,抗GBM抗体介导的肾脏损伤使抗原释放,上皮侧免疫复合物沉积。近年发现在特发性膜性肾病中,抗磷脂酶A2受体抗体常阳性,继发性膜性肾病则多为阴性[12]。本文报道的病例血清抗磷脂酶A2受体抗体阴性,高度提示该例患者为继发性膜性肾病。由于抗磷脂酶A2受体抗体于2009年首次报道[13],目前抗GBM肾炎合并膜性肾病的病例尚未见该抗体检测结果的报道。特发性膜性肾病IgG亚型为IgG4沉积为主,而继发性膜性肾病(如狼疮性肾炎)则以IgG1沉积为主。Hoshino等[14]报道1例患者首次活检IgG1线状沉积为主,IgG4颗粒状沉积为主,经治疗后病情稳定,1年后重复活检肾组织免疫荧光IgG1线状沉积及IgG4颗粒状沉积强度减弱,电镜下电子致密物吸收,提示可能肾小球上皮侧沉积物为继发的免疫反应。该患者免疫荧光IgG亚型以IgG1线状沉积为主,IgG4颗粒状沉积为主,与上述报道病例相类似。
总之,该患者青年男性,临床表现为急进性肾炎综合征伴大量蛋白尿、低蛋白血症,血清抗GBM抗体阳性,组织学为新月体肾炎合并膜性肾病,免疫病理IgG呈线状及颗粒状沉积于毛细血管袢,超微结构GBM上皮侧电子致密物沉积等特点,最终诊断为抗GBM肾炎合并膜性肾病,对于这类患者免疫荧光和外周血抗GBM抗体检测意义重大。
1 陈樱花,胡伟新,贺红光,等.丙基硫氧嘧啶相关血管炎肾损害的临床病理特征及转归.肾脏病与透析肾移植杂志,2010,19(3):219-224.
2 Zhuo L,Zou G,Li W,et al.Prevalence of diabetic nephropathy complicating non-diabetic renal disease among Chinese patients with type 2 diabetes mellitus.Eur J Med Res,2013,18:4.
3 陈浩,曾彩虹,刘志红.膜性肾病合并系统性淀粉样变性.肾脏病与透析肾移植杂志,2012,21(6):577-581.
4 章海涛,陈惠萍,程震,等.系统性血管炎合并肾小球膜性病变.肾脏病与透析肾移植杂志,2011,20(1):18-22.
5 Klassen J,Elwood C,Grossberg AL,et al.Evolution of membranous nephropathy into anti-glomerular-basement-membrane glomerulonephritis.N Engl J Med,1974,290(24):1340-1344.
6 Basford AW,Lewis J,Dwyer JP,et al.Membranous nephropathy with crescents.J Am Soc Nephrol,2011,22(10):1804-1808.
7 Cui Z,Zhao MH,Wang SX,et al.Concurrent antiglomerular basement membrane disease and immune complex glomerulonephritis.Ren Fail,2006,28(1):7-14.
8 Imtiaz S,Alswaida A,Rehman H,et al.Transformation of membranous into anti-GBM nephritis.Indian J Nephrol,2012,22(5):370-373.
9 Nasr SH,Ilamathi ME,Markowitz GS,et al.A dual pattern of immunofluorescence positivity.Am J Kidney Dis,2003,42(2):419-426.
10 Jennette JC,Lamanna RW,Burnette JP et al.Concurrent antiglomerular basement membrane antibody and immune complex mediated glomerulonephritis.Am J Clin Pathol,1982,78(3):381-386.
11 Pedchenko V,Bondar O,Fogo AB,et al.Molecular architecture of the Goodpasture autoantigen in anti-GBM nephritis.N Engl J Med,2010,363(4):343-354.
12 Qin W,Beck LH Jr,Zeng C,et al.Anti-phospholipase A2 receptor antibody in membranous nephropathy.J Am Soc Nephrol,2011,22(6):1137-1143.
13 Beck LH Jr,Bonegio RG,Lambeau G,et al.M-type phospholipase A2 receptor as target antigen in idiopathic membranous nephropathy.N Engl J Med,2009,361(1):11-21.
14 Hoshino J,Hara S,Ubara Y,et al.Distribution of IgG subclasses in a biopsy specimen showing membranous nephropathy with anti-glomerular basement membrane glomerulonephritis:an uncharacteristically good outcome with corticosteroid therapy.Am J Kidney Dis,2005,45(4):e67-e72.

