肥大细胞在抗肾小球基膜肾炎患者肾组织浸润中的意义
肥大细胞来源于骨髓造血细胞,进入外周循环系统,在血管组织或浆膜腔中完成分化和(或)成熟,通过局部分泌炎症介质或引发系统反应参与炎症反应的多个步骤[1]。既往数十年内,肥大细胞被认为在过敏反应中发挥重要作用,而近年来研究发现,在多种免疫应答中,尤其是在持续性炎症及组织重建的状态下(如肝硬化,肺纤维化及伤口愈合等)过程中[2],肥大细胞的分布常伴随纤维化形成,表明肥大细胞可能参与这些病理过程[3]。近年来研究也发现在糖尿病肾病、IgA肾病、膜性肾病、狼疮性肾炎、急性间质性肾炎和慢性间质性肾炎等多种肾脏疾病中,均存在肥大细胞增多现象[8-14]。我们前期研究以肾移植供肾为对照也发现,抗肾小球基膜(GBM)肾炎患者肾组织中肥大细胞数量明显增多。郑敬民等[9]曾报道肥大细胞加重肾脏炎症及纤维化,并通过脱颗粒分泌类胰蛋白酶至肾脏间质进而参与糖尿病肾病过程。
单核巨噬细胞被认为在新月体及肾间质损害中发挥关键作用[6-8],单核细胞在肾小球及肾间质的浸润被认为是急进性新月体形成及肾间质改变的起始事件,而肥大细胞由于与单核巨噬细胞拥有类似表型特征[9],故其可能也参与新月体肾炎的发生发展过程[10]。抗GBM肾炎,以急进性肾炎(RPGN)为特征,起病急骤,进展迅速,预后差;病理表现为肾小球大量新月体形成及包囊壁断裂,间质炎症反应和纤维化病变程度与肾小球病变的严重程度相平行,并直接影响患者的预后。已有部分动物实验报道肥大细胞在抗GBM肾炎中的作用,但在人类抗GBM肾炎中却鲜有报道。本文对抗GBM肾炎患者肾组织中肥大细胞的数量、分布、临床及组织病理的关系进行了分析研究。
对象与方法
病例选择选取2001年~2010年经肾活检明确诊断为抗GBM肾炎的患者38例,所有患者均予以甲泼尼龙冲击治疗后续口服泼尼松/吗替麦考酚酯或环磷酰胺冲击治疗。收集患者临床及病理资料,根据患者肾活检病理组织中肥大细胞数量将38例患者分为组1(肥大细胞计数<50 个/mm2,n=18)及组2(肥大细胞计数≥50 个/mm2,n=20),比较两组患者临床资料、实验室检查及病理结果。
临床资料及实验室检查临床资料数据,包括一般状况、性别、年龄、病程及临床表现。实验室检查,包括尿蛋白定量,尿沉渣红细胞计数(RBC),肾小管功能指标[N-乙酸-β-D-氨基葡萄糖苷酶(NAG酶),视黄醇结合蛋白(RBP)],血红蛋白,血清肌酐(SCr)和血清学试验(如抗GBM抗体滴度、补体C3和C4)。
高血压定义为成人静息收缩压≥140 mmHg和(或)舒张压≥90 mmHg;儿童收缩压≥120 mmHg和(或)舒张期血压≥80 mmHg,至少需两次测量。镜下血尿定义为尿沉渣红细胞计数≥1.0万/ml。蛋白尿定义为尿蛋白定量>0.4 g/24 h。肾病综合征定义为尿蛋白定量≥3.5 g/24 h,血清白蛋白<30 g/L。肾功能不全定义为SCr>109.62 μmol/L。慢性肾功能衰竭(CRF)定义为SCr>109.62 μmol/L持续至少3月,肾皮质回声增强。根据2012年KDOQI将急性肾损伤(AKI)定义为48h内SCr升高≥26.52 μmol/L,或者7d内SCr升高至≥1.5倍基础值,或者尿量<0.5 mL/(kg·h)达6h。终末期肾病(ESRD)定义为SCr≥530 μmol/L 或肾脏替代治疗超过3月。
组织学检查光镜,肾穿刺活检标本经氯化汞-苦味酸,石蜡包埋,切片1.5 μm。分别HE、PAS、PASM-Masson和Masson三色染色。观察肾小球,肾小管间质及血管病变。肾小管和间质慢性病变的程度根据受累的范围进行半定量评分:1分(轻度,<25%),2分(中度,25%~50%),3分(重度,>50%)。常规石蜡切片免疫组化Envision法检测间质和肾小球T淋巴细胞(CD4、CD8),巨噬细胞(CD68)阳性和增殖细胞核抗原(PCNA)阳性细胞。以NIS E1 ement BR3.4软件测量所选区域间质面积,得到浸润炎症细胞平均数。免疫荧光采用直接法IgG、IgA、IgM、C3、及C1q染色。
肾脏肥大细胞的检测胰蛋白酶(Novocastra公司,1∶2 000)免疫组化染色进行标记肾肥大细胞。CD68(DaKo公司,1∶100)用于标记巨噬细胞。使用单盲方法一个高倍视野下两个不同的研究者观察,对至少20个随机选择的区域进行了检查,对胰蛋白酶免疫组化染色阳性的细胞(肥大细胞)的总数进行计数。以NIS E1 ement BR3.4软件测量所选区域间质面积,得到肥大细胞平均数。
统计学分析所有数据采用SPSS 16.0软件进行分析。计量资料根据其是否正态分布分别以均数±标准差或中位数(25%分位数~75%分位数)表示,分类数据采用率(百分比)表示。组间均值比较采用t检验或Mann-Whitney U检验,两组之间率的比较采用χ2检验及确切概率法检验,变量间相关性探讨采用Spearman相关分析,P<0.05为差异有统计学意义,P<0.01为统计学差异显著。
结 果
一般情况和临床特点所有患者均表现为RPGN,65.8%患者伴肉眼血尿,84.2%合并高血压。组2患者病程较长,年龄较大,发生肉眼血尿患者较多,少尿/无尿比例较高且CRF较多但两组之间无显著差异(表1)。

表1 一般情况和临床特征
实验室检查组2患者SCr较高,而尿渗透压较低,血尿及低蛋白血症程度较轻尽管两组间无显著性差异,但观察到组2患者蛋白尿较轻,贫血程度较重、抗GBM抗体滴度较高(表2)。
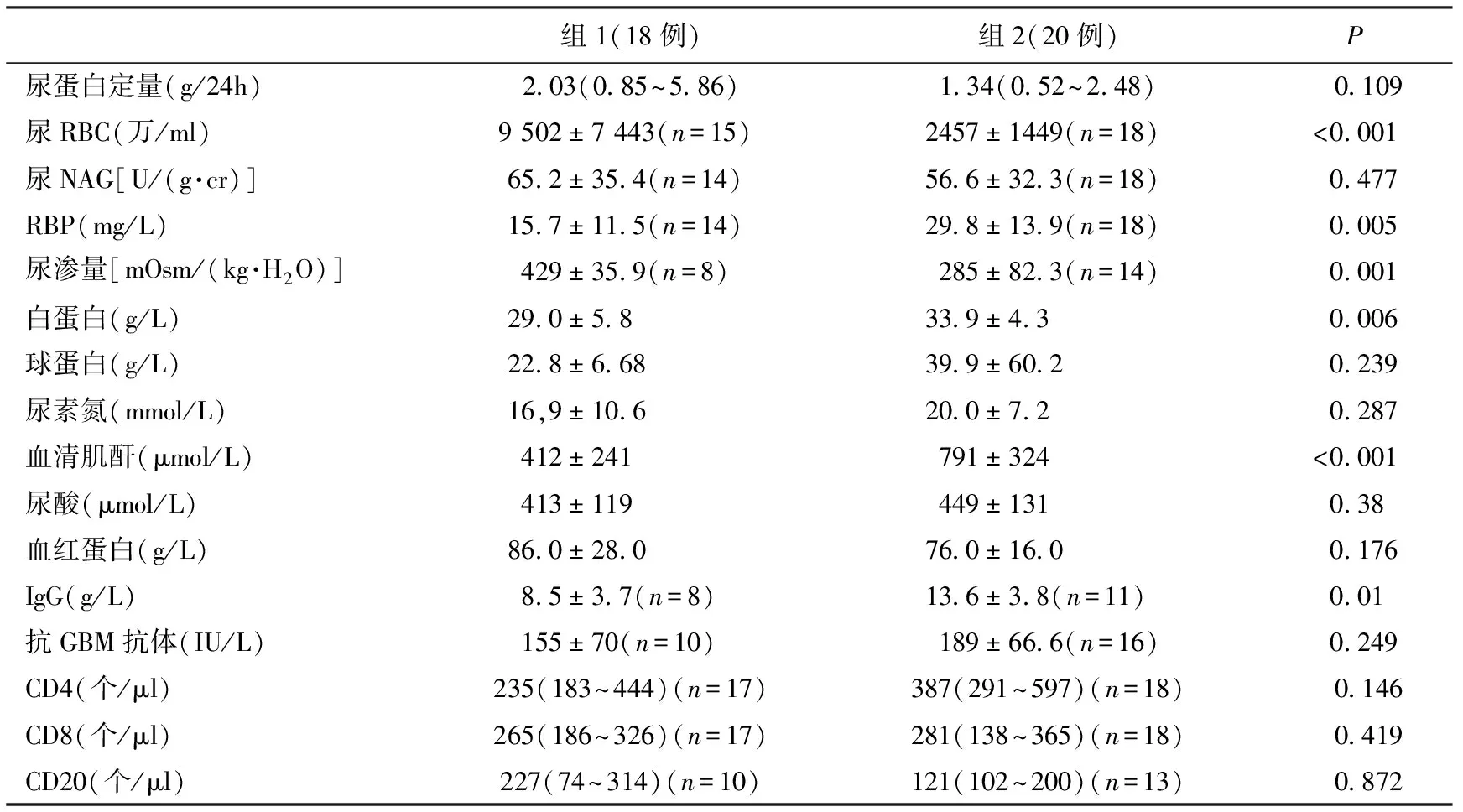
表2 两组患者实验室检查结果
组织学检查组2患者肾小球硬化和包囊破裂比例较高且间质纤维化程度重(P>0.05),纤维性/纤维细胞新月体比例较高(P<0.05),细胞性新月体比例较低(P>0.05)。组2肾组织间质可见较多炎性细胞。尤其是CD8+细胞(180 个/mm2vs268 个/mm2,P<0.05)及CD68+细胞(534 个/mm2vs792 个/mm2,P<0.05)(表3)。免疫荧光均表现IgG沿肾小球毛细血管袢呈线状沉积,常伴颗粒状或非连续性C3沉积。当新月体挤压毛细血管袢只是血管袢开放欠佳时,IgG线状沉积可不典型。
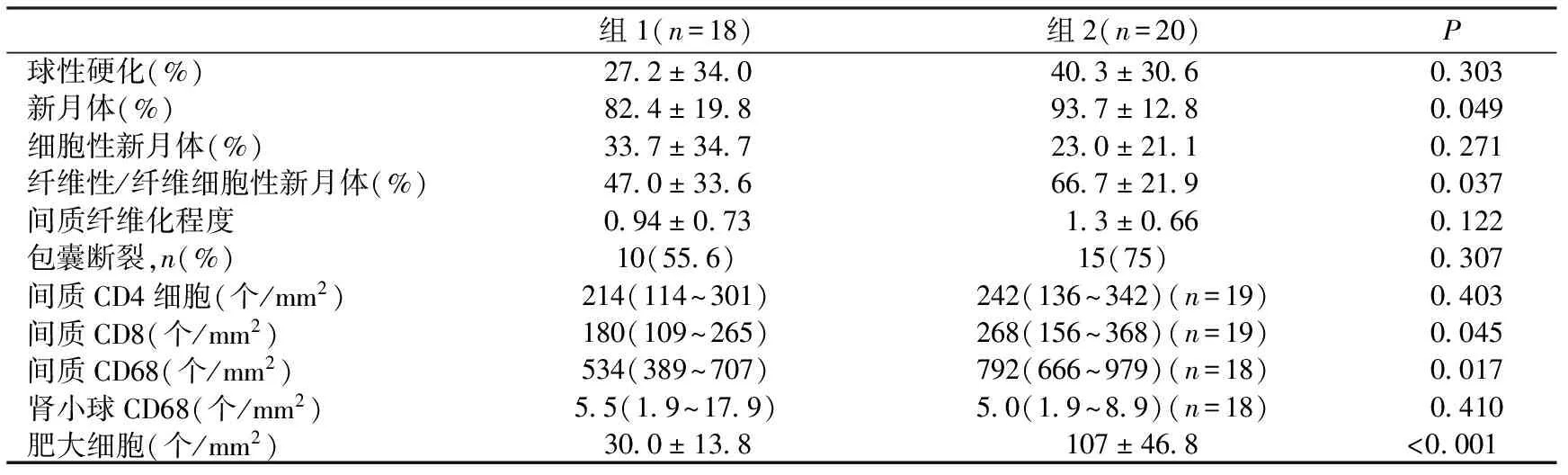
表3 两组患者的组织病理学特征
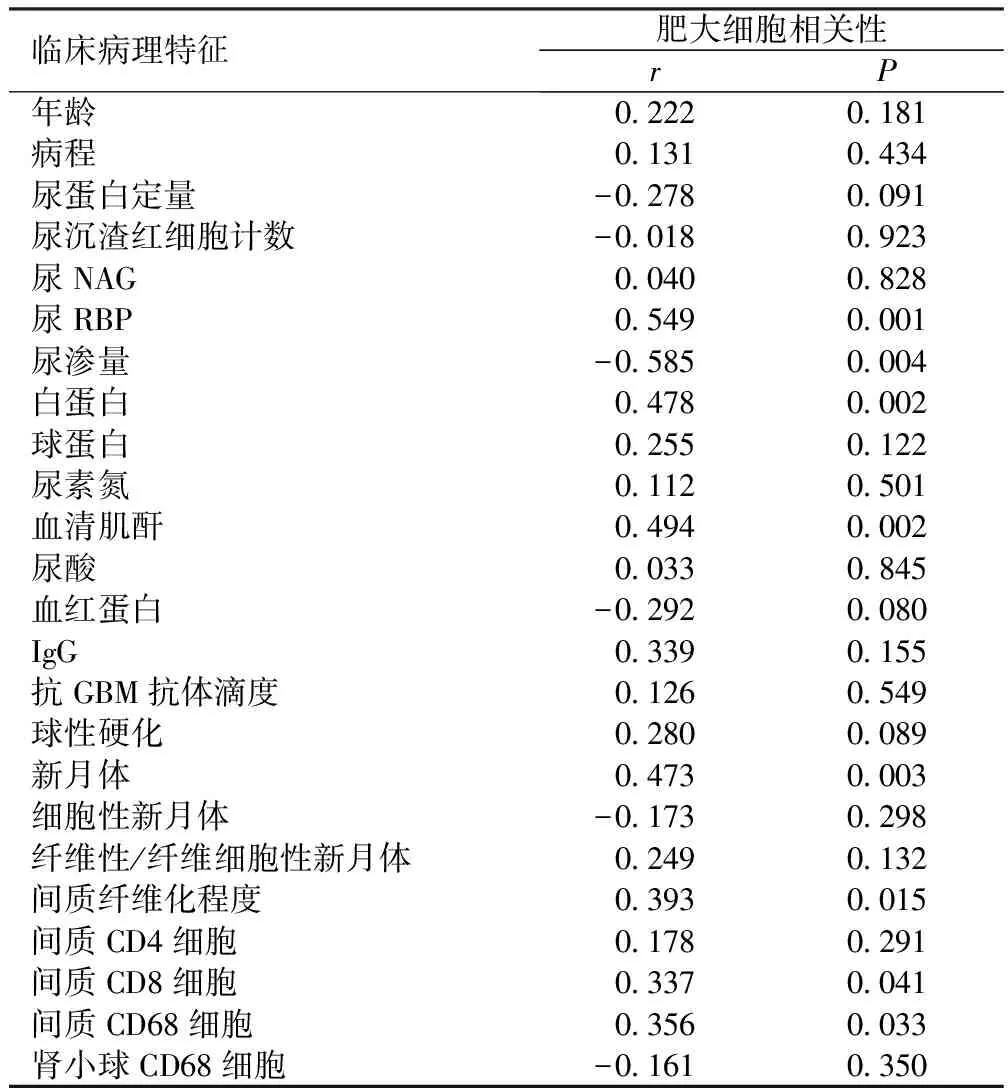
表4 肥大细胞与临床病理特征之间的相关性
讨 论
肥大细胞作为炎症细胞的重要成员,既往研究发现其在炎症和纤维化部位有大量浸润[1-3]。近年来对肥大细胞在新月体肾小球肾炎发病机制中作用的了解逐渐增多[11-13]。然而,在为数不多的动物实验报道中关于肥大细胞在抗GBM肾炎中的作用所得结果并不一致,目前尚无关于肥大细胞在人类抗GBM肾炎的相关报道,其在抗GBM肾炎中的作用仍不清楚。
本研究发现在人类抗GBM肾炎肾组织间质中肥大细胞浸润并研究其与临床及病理特征的关系。组2患者临床表现及肾脏病理表现较组1慢性化表现较明显。相关性分析表明,肾脏肥大细胞与新月体和肾小管间质炎症细胞,包括巨噬细胞和CD8阳性T淋巴细胞的数量显著相关。以上结果表明肥大细胞可能加重肾脏慢性病变。据报道,SCr高,少尿或无尿,晚期诊断等已被证实为肾脏预后较差的预测因素,起病时SCr水平是导致ESRD的独立预测因素[14-17]。通过观察一般情况和临床特征,尽管两组间无显著差异,较多肥大细胞浸润组(组2)患者具有病程较长,年龄较大,较少AKI和较多CRF的倾向,表明肥大细胞可能与慢性肾损害相关。临床数据较高水平的SCr及尿RBP,但渗透压较低,少尿/无尿比例较高,贫血程度较重,尿蛋白和镜下血尿较少等慢性肾功能损害表现,及较高滴度的抗GBM抗体,也支持肥大细胞浸润可能与慢性肾功能病变相关。在这些患者中,我们观察到更多的肥大细胞浸润,间接证明肥大细胞浸润与肾脏慢性病变相关。
本研究中所有患者肾脏病理表现较重,均有>40%的新月体,平均为88.4%±17.7%,超过三分之一的患者新月体比例>85%,纤维性/纤维细胞性新月体达57.3%,与本研究中患者晚期诊断相关。随着抗GBM肾炎疾病进展,病理表现肾小球新月体可呈纤维细胞性随后转化为纤维性新月体,伴随间质纤维化等肾小管间质损害的慢性化病变。两组比较发现,组2纤维性/纤维细胞性新月体和球性硬化等晚期新月体比例较高,相关分析进一步证实,肥大细胞浸润与晚期新月体的比例呈正相关,表明肥大细胞参与肾小球慢性化病变,大量晚期新月体难以由免疫抑制治疗逆转和并导致ESRD。既往Tóth等[10]的研究也同样发现在合并细胞纤维性新月体的肾小球肾炎中,肥大细胞计数明显增多。Timoshanko等[11]的研究也表明肥大细胞加重新月体肾炎进展。人们研究已认识新月体肾炎主要与Th1细胞和肾小球T细胞效应相关[18]。Hochegger等[12]的研究中发现肥大细胞可介导T淋巴细胞、巨噬细胞浸润。结合本研究及既往研究发现,肥大细可通过介导T淋巴细胞、巨噬细胞浸润进而促进新月体形成,但仍需进一步研究证实肥大细胞在肾小球损伤的免疫调节的作用。
导致CRT进展的病理改变除肾小球硬化外,也包括肾小管间质纤维化[19]。本研究也显示肥大细胞与肾小管间质损伤相关。在病理切片中发现肥大细胞浸润主要分布于肾间质(图1),较多肥大细胞浸润的患者其间质小管病变较严重,与临床及实验室检查结果(较高的SCr和RBP)一致,表明肥大细胞可能与肾小管损伤相关,且可能是加重肾损害的另一因素。此外,本研究发现,接受血液透析患者肥大细胞浸润的程度往往更严重。肥大细胞与RBP、SCr和纤维化程度的水平正相关,也进一步证实肥大细胞参与肾小管间质损伤。基于这些观察,肥大细胞可通过促进肾小管间质损伤导致肾功能减退。在其他肾脏疾病中也同样报道了相似的间质病变[4,20]。据报道,肾小管间质损害程度是肾功能进行性下降重要决定因素之一[21]。这些研究发现均表明,肥大细胞在肾小管间质损害中的作用不容忽视。实验性研究已经发现肥大细胞促进肾小管间质损害的某些可能机制。部分研究结果强调间质纤维化、肥大细胞聚集与局部肾组织肾素-血管紧张素系统(RAS)作用密切相关[22-25],表明肥大细胞可能诱导RAS激活。并且肥大细胞能够释放各种成纤维因子和生长因子(包括组胺、类胰蛋白酶、转化生长因子及碱性成纤维细胞生长因子等),而这些因子具有成纤维细胞促有丝分裂活性及可增强胶原蛋白的合成[2,26]。
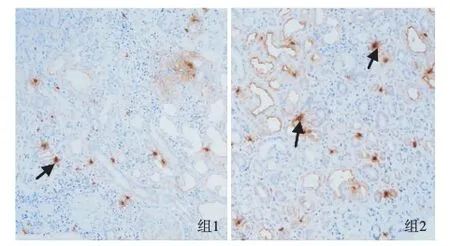
图1 肥大细胞主要分布于抗肾小球基膜肾炎患者肾组织肾间质区域(↑)(IH,×200)
如前所述,肥大细胞可介导和增强T细胞和巨噬细胞浸润。本研究中发现组2炎性细胞浸润较组1增多,尤其是CD8细胞及CD68细胞。巨噬细胞已被证明在新月体形成中发挥重要的作用。巨噬细胞聚集可预测肾功能损害程度和疾病的进展[27]。基于本文相关性分析中肥大细胞和巨噬细胞的正相关推测,肥大细胞与巨噬细胞的相互作用可能在加重病情发展中起部分作用。T淋巴细胞可诱发间质炎症,加重肾损伤,且T细胞在新月体的形成及发展中同样扮演不可忽视的角色。前文已述,肥大细胞具有介导T细胞聚集的作用。肥大细胞与T细胞及巨噬细胞的相互作用可解释肥大细胞加重肾脏损害的作用。这些假说也得到了其他研究的支持,揭示肥大细胞和其他免疫细胞的相互作用可促进疾病恶化。肥大细胞可产生和释放一些介质,这些介质可以调节生物反应,调节细胞因子的表达或炎性细胞浸润[28]。Tanda等[29]的研究也发现浸润的肥大细胞具有通过招募迟发型超敏反应(DTH)白细胞浸润诱导肾功能损伤的作用。这些局部效应与肥大细胞在皮肤的DTH作用相似。肥大细胞和炎症细胞之间的相关性表明,肥大细胞可促进抗GBM肾炎肾脏炎症反应。
相关分析表明肥大细胞浸润与球性硬化、肾间质纤维化程度及间质细胞浸润(尤其是CD8及CD68阳性细胞)呈正相关。肥大细胞导致的肾功能减退可能与肾小球和肾小管的病理变化均有关,意味着肥大细胞可能与疾病晚期阶段相关,进一步证实我们的观点——肥大细胞与肾脏慢性病变相关。
尽管本研究发现肥大细胞促进抗GBM肾炎的进展,但由于临床研究的限制,尚未明确其机制。而肥大细胞缺陷的大鼠和小鼠实验性研究表明肥大细胞在抗GBM肾炎扮演活跃角色,但各项研究并未得出一致结果,肥大细胞在肾脏损伤的作用目前仍有争论,因此仍需要进一步研究以明确其确切机制。
1 Kitamura Y.Heterogeneity of mast cells and phenotypic change between subpopulations.Annu Rev Immunol,1989,7:59-76.
2 Blank U,Essig M,Scandiuzzi L,et al.Mast cells and inflammatory kidney disease.Immunol Rev,2007,217:79-95.
3 Armbrust T,Batusic D,Ringe B,et al.Mast cell distribution in human liver disease and experimental rat liver fibrosis:Indications for mast cell participation in development of liver fibrosis.J Hepatol,1997,26(5):1042-1054.
4 Roberts IS,Brenchley PE.Mast cells:The forgotten cells of renal fibrosis.J Clin Pathol,2000,53(11):858-862.
5 Kondo S,Kagami S,Kido H,et al.Role of mast cell tryptase in renal interstitial fibrosis.J Am Soc Nephrol,2001,12(8):1668-1676.
6 Ferrario F,Castiglione A,Colasanti G,et al.The detection of monocytes in human glomerulonephritis.Kidney Int,1985,28(3):513-519.
7 Tang Z,Wu Y,Hu W,et al.The distribution and significance of renal infiltrating cells in patients with diffuse crescentic glomerulonephritis.Chin Med J(Engl),2001,114(12):1267-1269.
8 Holdsworth SR,Allen DE,Thomson NM,et al.Histochemistry of glomerular cells in animal models of crescentic glomerulonephritis.Pathology,1980,12(3):339-346.
9 Zheng JM,Yao GH,Cheng Z,et al.Pathogenic role of mast cells in the development of diabetic nephropathy:a study of patients at different stages of the disease.Diabetologia,2012,55(3):801-811.
10 Tóth T, Tóth-Jakatics R,Jimi S,et al.Mast cells in rapidly progressive glomerulonephritis.J Am Soc Nephrol,1999,10(7):1498-1505.
11 Timoshanko JR,Kitching AR,Semple TJ,et al.A pathogenetic role for mast cells in experimental crescentic glomerulonephritis.J Am Soc Nephrol,2006,17(1):150-159.
12 Hochegger K,Siebenhaar F,Vielhauer V,et al.Role of mast cells in experimental anti-glomerular basement membrane glomerulonephritis.Eur J Immunol,2005,35(10):3074-3082.
13 Kanamaru Y,Scandiuzzi L,Essig M,et al.Mast cell-mediated remodeling and fibrinolytic activity protect against fatal glomerulone-phritis.J Immunol,2006,176(9):5607-5615.
14 Cui Z,Zhao MH,Xin G,et al.Characteristics and prognosis of Chinese patients with anti-glomerular basement membrane disease.Nephron Clin Pract,2005,99(2):c49-55.
15 Daly C,Conlon PJ,Medwar W,et al.Characteristic s and outcome of anti-glomer ular basement membrane disease:a single-center experience.Ren Fail,1996,18(1):105-112.
16 Levy JB,Turner AN,Rees AJ,et al.Long-term outcome of anti-glomerular basement membrane antibody disease treated with plasma exchange and immunosuppression.Ann Intern Med,2001,134(11):1033-1042.
17 Jindal KK.Management of idiopathic crescentic and diffuse proliferative glomerulonephritis:evidence-base d recommendations.Kidney Int Suppl,1999,70:S33-40.
18 Kitching AR,Holdsworth SR,Tipping PG.Crescentic glomerulonephritis-A manifestation of a nephritogenic Th1 response? Histol Histopathol,2000,15(3):993-1003.
19 El Nahas AM.Glomerulosclerosis:intrinsic and extrinsic pathways.Nephrol Dial Transplant,1996,11(5):773-777.
20 Holdsworth SR,Summers SA.Role of mast cells in progressive renal diseases.J A m S oc Nephrol,2008,19(12):2254-2261.
21 El-Koraie AF,Baddour NM,Adam AG,et al.Role of stem cell factor and mast cells in the progression of chronic glomerulonephritides.Kidney Int,2001,60(1):167-172.
22 Kobori H,Nangaku M,Navar LG,et al.The intrarenal renin-angiotensin system:From physiology to the pathobiology of hypertension and kidney disease.Pharmacol Rev,2007,59(3):251-287.
23 Mackins CJ,Kano S,Seyedi N,et al.Cardiac mast cell-derived renin promotes local angiotensin formation,norepinephrine release,and arrhythmias in isch-emia/reperfusion.J Clin Invest,2006,116(4):1063-1070.
24 Jones SE,Kelly DJ,Cox AJ,et al.Mast cell infiltration and chemokine expression in progressive renal disease.Kidney Int,2003,64(3):906-913.
25 Silver RB,Reid AC,Mackins CJ,et al.Mast cells:a unique source of renin.Proc Natl Acad Sci U S A,2004,101(37):13607-13612.
26 Chevalier RL,Forbes MS,Thornhill BA.Ureteral obstruction as a model of renal interstitial fibrosis and obstructive nephropathy.Kidney Int,2009,75(11):1145-1152.
27 Atkins RC.Macrophages in renal injury.Am J Kidney Dis,1998,31(1):xlv-xlvii.
28 Villa I,Skokos D,Tkaczyk C,et al.Capacity of mouse mast cells to prime T cells and to induce specific antibody responses in vivo.Immunology,2001,102(2):165-172.
29 Tanda S,Mori Y,Kimura T,et al.Histamine ameliorates anti-glomerular basement membrane antibody-induced glomerulonephritis in rats.Kidney Int,2007,72(5):608-613.

