心脏死亡器官捐献供者肾移植29例报告
随着我国心脏死亡器官捐献(DCD)工作的逐步开展,临床工作中经常遇到供者存在急性肾衰竭(ARF)。在供体资源极度紧缺的情况下,我们根据供肾体外机器灌注参数和穿刺活检病理结果选择性移植了部分供肾,取得良好效果。
对象和方法
供者选择ARF根据RIFLE标准[1]确定,终末血清肌酐(SCr)为入院SCr的3倍,或SCr>350 μmol/L伴急性升高至少44 μmol/L。供者的选择方法根据文献报道的伴ARF的脑死亡供者选择程序加以改良[2,3],主要选择标准为:年龄<60岁;入院后最高肌酐清除率>60 ml/min(Cockcroft-Gault公式);无肾脏疾病史;终末尿量≥30 ml/h;肾脏大小外形正常;供肾活检显示无微血栓形成,无皮质坏死,无明显的慢性改变(>10%肾小球硬化,间质纤维化、肾小管萎缩和血管改变如小动脉内膜增厚和玻璃样变);肾脏体外机器灌注6h后,每克肾组织灌注流量>0.4 ml/min,阻力指数<0.5 mmHg/(ml/min);当终末尿量<30 ml/h时,阻力指数<0.4 mmHg/(ml/min)。本组病例均在移植前行供肾活检。出现以下情况时行冰冻切片快速病理检查(HE染色):(1)供者有高血压;(2)尿量<30 ml/h;(3)SCr持续升高。如供者不存在以上情况,仅送常规病理检查(石蜡切片,免疫荧光和电镜检查)。
器官保存采用LifePort肾脏转运器(Organ Recovery Systems)灌注每例供者的其中一只肾脏,对侧肾脏采用静态冷保存。灌注液为KPS-1(Organ Recovery Systems),每升灌注液中常规加入前列腺素E1 10 μg[4,5]。如果灌注1h后发现阻力>0.4 mmHg/(ml/min),选择性在灌注通路中加入维拉帕米10 mg,罂粟碱10 mg或酚妥拉明5 mg[6]。灌注温度4~8℃,设定灌注收缩压为30 mmHg(平均灌注压约24~27 mmHg)。灌注时间:如阻力<0.4 mmHg/(ml/min),则应手术需要随时中断灌注;如阻力>0.4 mmHg/(ml/min),则一般要求灌注至少6h。
免疫抑制治疗所有患者采用抗胸腺细胞球蛋白(即复宁)诱导治疗[1.0 mg/(kg·d),3~5d],首剂在术中给予。术后采用他克莫司、霉酚酸酯和激素三联免疫抑制治疗。霉酚酸酯在术后当天开始(1.0g,2次/d),术后1月减量为0.75g,2次/d;他克莫司在最后一剂即复宁当天开始,调整剂量至血药谷值浓度术后3月内8~10 μg/L,术后>3月为5~8 μg/L。
统计学方法所有数据采用SPSS 16.0统计软件处理,计量资料资料以均数±标准差表示。两个均数比较采用配对t检验,两个率的比较采用精确t检验。以P<0.05为有统计学差异。
结 果
供者和受者资料供者15例,男性14例,女性1例,年龄37±15岁(12~56岁),均为中国Ⅲ类DCD供体(脑死亡加心脏死亡)。受者29例,男性17例,女性12例,年龄43±11岁(22~70岁)。热缺血时间17.2±4.4 min,冷缺血时间7.2±3.4 h。供体初始和终末SCr水平分别为90±35 μmol/L(52~190 μmol/L)和356±153 μmol/L(182~702 μmol/L)。机器灌注流量为94±39 ml/min(55~168 ml/min),阻力指数为0.32±0.11 mmHg/(ml/min) [0.15~0.46 mmHg/(ml/min)]。1例死于脑出血的41岁供者的双肾被植入1例45岁体重85 kg的受者体内(表1、2)。
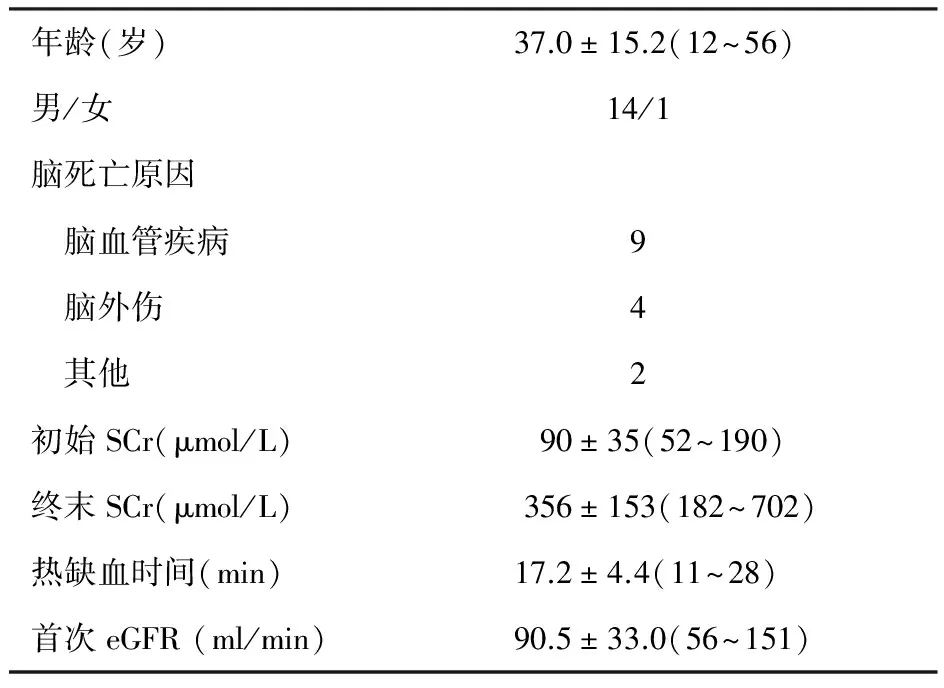
表1 15例供者的临床资料

表2 29例受者的临床资料
移植结果29例受者接受ARF供肾。8例(27.6%)发生移植肾功能延迟恢复(DGF),肾功能均于术后4周内恢复。未发生移植肾原发性无功能(PNF)。随访2~21月,所有受者和移植肾均存活。2例(6.9%)发生移植肾急性排斥反应。术后1月和12月以MDRD公式计算的肾小球滤过率(eGFR)分别为55.5±10.5 ml/(min·1.73m2)和60.8±10.6 ml/(min·1.73m2)。
机器灌注对移植肾功能的影响28例单肾移植中,7例发生DGF,其中机器灌注组3例(27.3%),静态冷保存组4例(40.0%),P<0.05。机器灌注组和静态冷保存组术后1月eGFR分别为55.0±9.6 ml/(min·1.73m2)和55.8±11.7 ml/(min·1.73m2)(P>0.05);术后1年eGFR分别为60.5±10.2 ml/(min·1.73m2)和61.1±10.9 ml/(min·1.73m2)(P>0.05)。
讨 论
导致DCD供肾损伤的原因复杂,包括基础疾病、脑死亡相关的器官损伤、心脏死亡后的热缺血损伤、住院期间的肾损伤(如心肺复苏期间的热缺血损伤、血容量不足引起的肾前性肾损伤、甘露醇肾损害和肌红蛋白导致的肾小管阻塞等),各种肾损伤原因的叠加使得DCD供者常出现ARF。ARF的存在使得判断器官质量困难。如何使用ARF供肾目前尚无统一意见。
目前有关ARF供肾移植的经验主要源于脑死亡供者。在标准脑死亡供者中,终末SCr升高是丢弃肾脏的独立危险因素,但是一旦供肾被移植,SCr升高并不是导致移植肾失功的危险因素[7]。一般情况下,是否使用ARF供肾主要根据发生急性肾小管坏死前的肾功能状态,一般要求入院SCr<133 μmol/L,eGFR>80 ml/min(Cockcroft-Gault公式)[2,8]。当肾功能稳定时(SCr持续下降),移植肾被丢弃的可能性较小;而当SCr持续升高时,选择的困难更大。Morgan等[9]报道根据以下标准使用SCr持续升高的供肾:(1)终末尿量≥30 ml/h;尿量0~29 ml/h时,灌注流量必须>100 ml/h;(2)无皮质坏死和慢性病变。活检标本中急性肾小管坏死的程度一般不能用来判断肾脏的活性。由于器官的极度短缺、经验的累积和双肾移植的采用,ARF供肾的使用标准在逐渐放宽[2,8]。
与脑死亡供者比较,DCD供者由于器官切取前的热缺血使问题更加复杂,移植前必须测定供肾活力以避免出现移植肾PNF。根据机器体外灌注的参数判断供肾活力很有实用价值。Navarro等[10]报道,在器官切取前发生ARF的Maastricht马斯特里赫特Ⅲ类DCD供体,肾移植后12月GFR与来源于肾功能正常的DCD供体的移植肾无显著差异。Tesi等[11]报道可接受移植肾的灌注参数为:流量>70 ml/min,阻力<0.4 mmHg/(ml/min)。Matsuno等[12,13]报道DCD供肾的可接受的灌注参数为:每克肾组织流量>0.4 ml/(min·g)且灌注阻力不会升高。根据我们有限的经验,我们认为在供者终末尿量≥30 ml/h时,每克肾组织流量>0.4 ml/(min·g),阻力指数<0.5 mmHg/(ml/min) 可作为安全使用供肾的标准;如果供者终末尿量<30 ml/h,对灌注参数的要求应该更加严格,流量>70 ml/min,阻力<0.4 mmHg/(ml/min)。术前应行移植肾穿刺活检以排除肾小球微血栓、皮质坏死或慢性病变。在相同研究期间,本科室总共丢弃ARF供肾7例,其中2例阻力指数分别为0.46和0.48 mmHg/(ml/min),其余5例阻力指数均>0.5 mmHg/(ml/min)。
本组病例术后DGF发生率为27.6%,低于UNOS数据库DCD肾移植DGF发生率(38.7%)[14],可能与本组冷缺血时间较短有关。文献也报道将DCD供肾的冷缺血时间缩短至<12h,可显著减少DGF[14]。因本科室暂时仅有一台LifePort机器,所以采用一只供肾机器灌注,对侧供肾静态冷保存的方式。本组病例中机器灌注组DGF发生率低于静态冷保存组,但是病例数尚少,需累积病例进一步观察。
我们开展DCD肾移植仅2年,很多问题尚在初步探索阶段,对ARF供肾的使用也存在开始标准严格,以后标准逐渐放宽的过程。总之,合并ARF的DCD供肾移植后近期效果良好,远期效果有待进一步观察。术前采用体外机器灌注保存方法判断供肾活力并行穿刺活检排除慢性病变是使用ARF供肾的基础。
1 Bellomo R,Ronco C,Kellum JA,et al.Acute renal failure-definition,outcome measures,animal models,fluid therapy and information technology needs:the Second International Consensus Conference of the Acute Dialysis Quality Initiative (ADQI) Group.Crit Care,2004,8(4):R204-212.
2 Zuckerman JM,Singh RP,Farney AC,et al.Single center experience transplanting kidneys from deceased donors with terminal acute renal failure.Surgery,2009,146(4):686-694.
3 Sonnenday CJ,Cooper M,Kraus E,et al.The hazards of basing acceptance of cadaveric renal allografts on pulsatile perfusion parameters alone.Transplantation,2003,75(12):2029-2033.
4 Polyak MM,Arrington BO,Stubenbord WT,et al.The influence of pulsatile preservation on renal transplantation in the 1990s.Transplantation,2000,69(2):249-258.
5 Polyak MM,Arrington BO,Stubenbord WT,et al.Prostaglandin E1 influences pulsatile preservation characteristics and early graft function in expanded criteria donor kidneys.J Surg Res,1999,85(1):17-25.
6 Stratta RJ,Moore PS,Farney AC,et al.Influence of pulsatile perfusion preservation on outcomes in kidney transplantation from expanded criteria donors.J Am Coll Surg,2007,204(5):873-882.
7 Kayler LK,Garzon P,Magliocca J,et al.Outcomes and utilization of kidneys from deceased donors with acute kidney injury.Am J Transplant,2009,9(2):367-373.
8 Farney AC,Rogers J,Orlando G,et al.Evolving experience using kidneys from deceased donors with terminal acute kidney injury.J Am Coll Surg,2013,216(4):645-655.
9 Morgan C,Martin A,Shapiro R,et al.Outcomes after transplantation of deceased-donor kidneys with rising serum creatinine.Am J Transplant,2007,7(5):1288-1292.
10 Navarro AP,Sohrabi S,Wilson C,et al.Renal transplants from category III non-heart-beating donors with evidence of pre-arrest acute renal failure.Transplant Proc,2006,38(8):2635-2636.
11 Tesi RJ,Elkhammas EA,Davies EA,et al.Pulsatile kidney perfusion for evaluation of high-risk kidney donors safely expands the donor pool.Clin Transplant,1994,8(2 Pt 1):134-138.
12 Matsuno N,Konno YN,Jyojima Y,et al.Machine perfusion preservation for kidney grafts with a high creatinine from uncontrolled donation after cardiac death.Transplant Proc,2010,42(1):155-158.
13 Matsuno N,Sakurai E,Uchiyama M,et al.Role of machine perfusion preservation in kidney transplantation from non-heartbeating donors.Clin Transplant,1998,12(1):1-4.
14 Locke JE,Segev DL,Warren DS,et al.Outcomes of kidneys from donors after cardiac death:implications for allocation and preservation.Am J Transplant,2007,7(7):1797-1807.

